Центральная толерантность , также известная как отрицательный отбор, - это процесс устранения любых развивающихся Т- или В-лимфоцитов , которые реагируют на себя. [1] Путем устранения аутореактивных лимфоцитов толерантность гарантирует, что иммунная система не атакует собственные пептиды. [2] Созревание лимфоцитов (и центральная толерантность) происходит в первичных лимфоидных органах, таких как костный мозг и тимус . У млекопитающих В-клетки созревают в костном мозге, а Т-клетки созревают в тимусе. [1]
Центральная толерантность несовершенна, поэтому периферическая толерантность существует как вторичный механизм, гарантирующий, что Т- и В-клетки не будут самореактивными после того, как покидают первичные лимфоидные органы. [3] Периферическая толерантность отличается от центральной толерантности тем, что она возникает, когда развивающиеся иммунные клетки покидают первичные лимфоидные органы (тимус и костный мозг), до их экспорта на периферию. [1]
Функция центрального допуска [ править ]
Центральная толерантность важна для правильного функционирования иммунных клеток, поскольку она помогает гарантировать, что зрелые В-клетки и Т-клетки не распознают аутоантигены как чужеродные микробы. [2] В частности, центральная толерантность необходима, потому что рецепторы Т-клеток (TCR) и рецепторы В-клеток (BCR) производятся клетками посредством случайной соматической перестройки. [1] Этот процесс, известный как рекомбинация V (D) J , важен, поскольку он увеличивает разнообразие рецепторов, что увеличивает вероятность того, что В-клетки и Т-клетки будут иметь рецепторы для новых антигенов. [1] Разнообразие соединений возникает во время рекомбинации и служит для дальнейшего увеличения разнообразия BCR и TCR. [1]Производство случайных TCR и BCR является важным методом защиты от микробов из-за их высокой скорости мутации. Этот процесс также играет важную роль в содействии выживанию вида, потому что внутри вида будет происходить множество перегруппировок рецепторов, что означает очень высокую вероятность того, что по крайней мере один член вида будет иметь рецепторы для нового антигена. [1]
Хотя процесс соматической рекомбинации необходим для успешной иммунной защиты, он может привести к аутореактивности. Например, отсутствие функциональных RAG1 / 2 , ферментов, необходимых для соматической рекомбинации, было связано с развитием иммунных цитопений, при которых вырабатываются антитела против клеток крови пациента. [4] Из-за природы случайной рекомбинации рецепторов будут производиться некоторые BCR и TCR, которые распознают аутоантигены как чужеродные. [2] Это проблематично, поскольку эти В- и Т-клетки, если они будут активированы, инициируют атаку иммунной системы против себя, если не убиты или не инактивированы центральными механизмами толерантности. [2]Следовательно, без центральной толерантности иммунная система может атаковать себя, что не является устойчивым и может привести к аутоиммунному расстройству. [2] [3]
Механизмы центральной толерантности [ править ]
Конечным результатом толерантности является популяция лимфоцитов, которые не реагируют на аутоантигены, но могут распознавать чужеродные, не аутоантигены, в зависимости от случайно расположенного рецептора. [2] Важно отметить, что лимфоциты могут развить толерантность только к антигенам, которые присутствуют в костном мозге (для B-клеток) и тимусе (для T-клеток).
Толерантность к В-клеткам [ править ]
Незрелые В-клетки в костном мозге подвергаются отрицательной селекции, когда связываются с собственными пептидами. [2]
Правильно функционирующие рецепторы В-клеток распознают не собственный антиген или молекулярные белки, связанные с патогенами ( PAMP ). [1]
Основные результаты аутореактивности BCR [1] [2]
- Апоптоз (клональная делеция)
- Редактирование рецепторов : самореактивные В-клетки изменяют специфичность путем перестройки генов и вырабатывают новый BCR, который не реагирует на себя. Этот процесс дает B-клетке возможность редактировать BCR до того, как она получит сигнал об апоптозе или анергии.
- Индукция анергии (состояние безреактивности)
Толерантность [ править ]
Центральная толерантность Т-клеток возникает в тимусе. [1] Т-клетки подвергаются положительному и отрицательному отбору. [2]
Рецепторы Т-клеток должны обладать способностью распознавать собственные молекулы главного комплекса гистосовместимости (MHC) со связанным несамостоятельным пептидом. [1]
Этапы толерантности Т-клеток [2] [5]
- Во время положительного отбора Т-клетки проверяются на их способность связывать комплексы пептид-MHC с аффинностью. Если Т-клетка не может связывать комплекс MHC класса I или MHC класса II , она не получает сигналов выживания, поэтому она умирает в результате апоптоза. Рецепторы Т-клеток с достаточным сродством к комплексам пептид-MHC отбираются для выживания.
- В зависимости от того, связывает ли Т-клетка MHC I или II, она станет CD8 + или CD4 + T-клеткой соответственно.
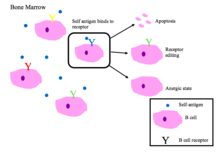
- Положительный отбор происходит в коре тимуса с помощью эпителиальных клеток тимуса, которые содержат поверхностные молекулы MHC I и MHC II.На этом рисунке изображен процесс отрицательного отбора Т-клеток.
- Во время отрицательного отбора Т-клетки проверяются на их сродство к себе. Если они связываются с собственным пептидом, то они получают сигнал об апоптозе (процесс клональной делеции).
- Эпителиальные клетки тимуса отображают собственный антиген по отношению к Т-клеткам, чтобы проверить их сродство к себе.
- Регуляторы транскрипции AIRE и Fezf2 играют важную роль в экспрессии собственных тканевых антигенов на эпителиальных клетках тимуса в тимусе.
- Отрицательный отбор происходит в корково-мозговом соединении и мозговом веществе тимуса.
- Т-клетки, которые не связываются сами с собой, но распознают комплексы антиген / MHC, и являются либо CD4 +, либо CD8 +, мигрируют во вторичные лимфоидные органы в виде зрелых наивных Т-клеток.
Регуляторные Т-клетки - это еще один тип Т-клеток, созревающих в тимусе. Отбор T reg-клеток происходит в мозговом веществе тимуса и сопровождается транскрипцией Foxp3 . Регулярные Т-клетки важны для регулирования аутоиммунитета, подавляя иммунную систему, когда она не должна быть активной. [6]
Генетические заболевания, вызванные дефектами центральной толерантности [ править ]
Генетические дефекты центральной толерантности могут привести к аутоиммунитету.
- Синдром аутоиммунной полиэндокринопатии типа I вызывается мутациями гена AIRE человека . Это приводит к недостаточной экспрессии периферических антигенов в тимусе и, следовательно, к отсутствию негативного отбора в отношении ключевых периферических белков, таких как инсулин. [7] [8] Результатом являются множественные аутоиммунные симптомы.
История центральной толерантности [ править ]
Впервые центральную толерантность использовал Рэй Оуэн в 1945 году, когда он заметил, что у крупного рогатого скота с дизиготными близнецами не вырабатывались антитела, когда одному из близнецов вводили кровь другого. [9] Его выводы были подтверждены более поздними экспериментами Хасека и Биллингема. [9] Результаты были объяснены гипотезой клональной селекции Бурэ. [10] Бернет и Медавар получили Нобелевскую премию в 1960 году за свою работу по объяснению того, как работает иммунная толерантность. [10] [11]
См. Также [ править ]
- Аутоиммунитет
- Иммунология
- Периферическая толерантность
- Клональный отбор
Ссылки [ править ]
- ^ Б с д е е г ч я Owen JA, Punt J, Stranford SA, Jones PP, Kuby J (2013). Кубы иммунологии (7-е изд.). Нью-Йорк: WH Freeman. ISBN 978-1-4292-1919-8. OCLC 820117219 .
- ^ Б с д е е г ч Romagnani S (2006). «Иммунологическая толерантность и аутоиммунитет». Внутренняя и неотложная медицина . 1 (3): 187–96. DOI : 10.1007 / bf02934736 . PMID 17120464 .
- ^ a b Джейнвей C (2011). Иммунобиология 5: иммунная система в здоровье и болезнях (5-е изд.). Нью-Йорк: Гарленд. ISBN 978-0-8153-3642-6. OCLC 45708106 .
- ↑ Chen K, Wu W, Mathew D, Zhang Y, Browne SK, Rosen LB, McManus MP, Pulsipher MA, Yandell M, Bohnsack JF, Jorde LB, Notarangelo LD, Walter JE (март 2014 г.). «Аутоиммунитет из-за дефицита RAG и предполагаемая частота заболевания мутациями RAG1 / 2» . Журнал аллергии и клинической иммунологии . 133 (3): 880–2.e10. DOI : 10.1016 / j.jaci.2013.11.038 . PMC 4107635 . PMID 24472623 .
- ^ Sprent Дж, Kishimoto Н (май 2001 г.). «Тимус и центральная толерантность» . Философские труды Лондонского королевского общества. Серия B, Биологические науки . 356 (1409): 609–16. DOI : 10.1098 / rstb.2001.0846 . PMC 1088448 . PMID 11375064 .
- ^ Bettelli E, Carrier Y, W Гао, Korn T, Strom TB, Oukka M, Weiner HL, Kuchroo В.К. (май 2006). «Взаимные пути развития для генерации патогенных эффекторных TH17 и регуляторных Т-клеток». Природа . 441 (7090): 235–8. DOI : 10,1038 / природа04753 . PMID 16648838 .
- ^ Андерсон М.С., Venanzi Е.С., Клейн L, Z Чен, Берзиньш С.П., Тёрли SJ, фон Boehmer Н, Бронсона R, Dierich А, С Benoist, Матис D (ноябрь 2002 г.). «Проекция иммунологической собственной тени в тимусе белком воздуха». Наука . 298 (5597): 1395–401. DOI : 10.1126 / science.1075958 . PMID 12376594 .
- ^ Листон А, Лесаж S, Уилсон Дж, Peltonen л, Goodnow CC (апрель 2003 г.). «Aire регулирует негативный отбор органоспецифических Т-клеток». Иммунология природы . 4 (4): 350–4. DOI : 10.1038 / ni906 . PMID 12612579 .
- ^ a b Schwartz RH (апрель 2012 г.). «Исторический обзор иммунологической толерантности» . Перспективы Колд-Спринг-Харбор в биологии . 4 (4): а006908. DOI : 10.1101 / cshperspect.a006908 . PMC 3312674 . PMID 22395097 .
- ^ a b Листон A (январь 2011 г.). «Иммунологическая толерантность через 50 лет после присуждения Нобелевской премии Бернета» . Иммунология и клеточная биология . 89 (1): 14–5. DOI : 10.1038 / icb.2010.138 . PMID 21209621 .
- Перейти ↑ Silverstein AM (март 2016 г.). «Любопытный случай с Нобелевской премией 1960 года Бернету и Медавару» . Иммунология . 147 (3): 269–74. DOI : 10.1111 / imm.12558 . PMC 4754613 . PMID 26790994 .