 | |
| Идентификаторы | |
|---|---|
3D модель ( JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.003.009 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| Номер ООН | 3276 2666 |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
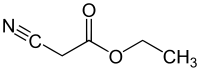
| C 5 H 7 N O 2 | |
| Молярная масса | 113,116 г · моль -1 |
| -67,3 · 10 −6 см 3 / моль | |
| Опасности | |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| H302 , H312 , H319 , H332 | |
| Р261 , Р264 , Р270 , Р271 , Р280 , Р301 + 312 , P302 + 352 , Р304 + 312 , Р304 + 340 , P305 + 351 + 338 , P312 , P322 , P330 , P337 + 313 , P363 , P501 | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Этилцианоацетат - это органическое соединение, которое содержит сложный эфир карбоксилата и нитрил . Это бесцветная [1] жидкость с приятным запахом. Этот материал полезен в качестве исходного материала для синтеза из-за его разнообразия функциональных групп и химической активности.
Производство [ править ]
Этилцианоацетат можно получить различными способами:
- Синтез нитрила Кольбе с использованием этилхлорацетата и цианида натрия . [2]
- Фишер этерификации из цианоуксусной кислоты с этанолом в присутствии сильных минеральных кислот (например , концентрированной серной кислоты ). Цианоуксусная кислота может быть получена синтезом нитрила Кольбе с использованием хлорацетата натрия и цианида натрия. [2]
- Реакция цианоацетата натрия с этилбромидом в водно-органической двухфазной системе в присутствии катализатора межфазного переноса . [3]
- Окисление 3-этоксипропионитрила, простого эфира , кислородом под давлением в присутствии тетрагидрата ацетата кобальта (II) в качестве катализатора и N- гидроксифталимида в качестве генератора радикалов. [4]
Свойства [ править ]
Физические свойства [ править ]
Этилцианоацетат - бесцветная жидкость, кипит при атмосферном давлении при 209 ° C. [5] Давление пара следует уравнению Антуана log 10 (P) = A− (B / (T + C)) (P в барах, T в K) с A = 7,46724, B = 3693,663 и C = 16,138 в диапазон температур от 341 до 479 К [6] В твердой фазе могут встречаться две полиморфные формы . [7] [ требуется полная ссылка ] Ниже -111 ° C кристаллическая форма II является доминирующей. [7] Выше этой температуры образуется кристаллическая форма I, плавящаяся при -22 ° C. [5] теплоемкость при 25 ° С составляет 220,22 Й К -1 моль−1 . [7]
Химические свойства [ править ]
Обладая тремя различными реакционными центрами - нитрильным, сложноэфирным и кислотным метиленовым центром - этилцианоацетат представляет собой универсальный синтетический строительный блок для множества функциональных и фармакологически активных веществ. Он содержит кислотную метиленовую группу, окруженную как нитрилом, так и карбонилом , и поэтому может использоваться в реакциях конденсации, таких как конденсация Кневенагеля или присоединение Михаэля . Эта реакционная способность аналогична сложных эфиров из малоновой кислоты . В качестве примера реакционной способности по отношению к нитрилу диэтилмалонат получают из этилового эфира цианоуксусной кислоты реакцией с этанолом в присутствии сильных кислот . [2]При нагревании в присутствии этоксида натрия образуется димерный диэтиловый эфир 3-амино-2-циано-2-пентендицида. [8]
Используйте [ редактировать ]
Благодаря своей функциональности цианоацетат реагирует:
- По нитрильной группе по-разному:
- Гидрирование приводит к β-аминокислоте β-аланину.
- Нуклеофильная атака на углерод, как стадия синтеза многих гетероциклов (см. Ниже) и других продуктов.
- Как безопасный цианидодонорный реагент [9]
- Нуклеофильная атака сложноэфирной группы как часть ацильного замещения: реакция с аммиаком приводит к цианоацетамиду, который может быть превращен дегидратацией с помощью PCl 5 или POCl 3 в малононитрил. [10]
- Через кислотную метиленовую группу как нуклеофил
Этилцианоацетат является строительным материалом для синтеза гетероциклов, которые используются, например, в качестве лекарств:
- Аллопуринол , используемый для лечения хронической подагры, можно синтезировать, начиная с конденсации Кневенагеля с триэтилортоформиатом ; продукт конденсации подвергается циклизации с гидразином с образованием замещенного пиразола, а затем с формамидом до аллопуринола, замещенного пиразолопиримидина. [11]
- Производные пурина теофиллин , кофеин и мочевая кислота синтетически доступны из этилцианоацетата и N, N ' -диметилмочевины . [12]
- Птеридин производная фолиевая кислота назначаются витамин B комплекса ; этилцианоацетат и гуанидин можно использовать в качестве исходного материала в многостадийном конвергентном синтезе .
- Пиррол этосуксимид используется для лечения эпилепсии , он может быть получен из этилцианоацетата и бутанон в многоступенчатом синтезе.
- Пиримидина производные триметопрят используются в качестве ко-тримоксазола в фиксированной комбинации с сульфаметоксазол , используемой в качестве бактериостатического агента и синтезируются из этилцианоацетата и 3,4,5-триметоксибензальдегида или его бензилхлорида.
Также многие другие функциональные гетероциклы с хорошими выходами доступны из этилцианоацетата, такие как 3-замещенные производные кумарина. [13]
Нециклические продукты из этого исходного материала включают:
- Противосудорожные вальпроевые кислоты
- Этилцианоакрилат , используемый в качестве суперклея, в результате реакции с формальдегидом.
Этилцианоацетат также используется для получения 3,3-дифенилпропан-1-амина, который является предшественником, используемым в синтезе прениламина и дропрениламина .
Безопасность [ править ]
Этилцианоацетат имеет LD50 2820 мг / кг (перорально, крыса). [14]
Ссылки [ править ]
- ^ Запись на Cyanessigsäureester . в: Römpp Online . Георг Тиме Верлаг, получено 15 июня 2016 г.
- ^ a b c Дж. К. Х. Инглис. «Этилцианоацетат». Органический синтез . DOI : 10.15227 / orgsyn.008.0074 .
- ^ ЕР 1028105 , Hanselmann, Paul & Хильдебранд, Стефан, «Способ получения сложных эфиров циануксусных», опубликованная 2000-08-16, назначен Lonza AG
- ^ Патент ЕРА 1208081 , Hanselmann, Paul & Хильдебранд, Стефан, "Способ получения сложных эфиров кислоты Цианоуксусных", выданные 2004-04-14, назначен Lonza AG
- ^ a b Запись CAS RN 105-56-6 в базе данных веществ GESTIS Института безопасности и гигиены труда , доступ 3 марта 2011 г.
- ^ Stull, DR (1947). «Давление паров чистых веществ органических соединений». Ind. Eng. Chem . 39 (4): 517–540. DOI : 10.1021 / ie50448a022 .
- ^ a b c Ходжаева, МГ; Бугаков, Ю.В .; Исмаилов Т.С. Теплоемкость и термодинамические функции этилцианоацетата в Хим.-Фарм. Жур. 21 (1987) 760-762, DOI: 10.1007 / BF00872889 .
- ^ Дорохов, В. А.; Баранин, С.В. Диб, А .; Богданов, В.С. (1992). « « Кодимеры » N - (пирид-2-ил) амидов и этилцианоацетата». Русь. Chem. Бюллетень . 41 (2): 287–291. DOI : 10.1007 / bf00869516 .
- ^ Чжэн, Шуянь; Ю, Чуньхуэй; Шен, Чжэнву (2012). «Этилцианоацетат: новый цианирователь для цианирования арилгалогенидов, катализируемого палладием». Орг. Lett . 14 (14): 3644–3647. DOI : 10.1021 / ol3014914 .
- ^ Мэри Иглсон: Краткая энциклопедия химии , Вальтер де Грюйтер, Берлин - Нью-Йорк 1994, ISBN 3-11-011451-8 .
- ^ Axel Kleemann , Jürgen Engel: "Pharmazeutische Активные вещества", 2. Aufl, Georg Thieme, Штутгарт - НьюЙорк 1982,. ISBN 3-13-558402-X .
- ^ Бейер-Вальтер: "Lehrbuch der Organischen Chemie", 24. Aufl., S. Hirzel, Stuttgart - Leipzig 2004.
- ^ Аветисян, АА; Ванян Э. V .; Дангян М.Т. (1980). «Синтез функционально замещенных кумаринов». Chem. Гетероцикл. Соединения . 15 (9): 959–960. DOI : 10.1007 / BF00473834 .
- ↑ Харальд Стритматтер, Стефан Хильдбранд и Питер Поллак «Малоновая кислота и производные» в Энциклопедии промышленной химии Ульмана 2007, Wiley-VCH, Weinheim. DOI : 10.1002 / 14356007.a16_063.pub2
