Гран участок (также известный как Gran титрование или метод Gran ) является распространенным способом стандартизации в титруете или титрант путем оценки объема эквивалентности или конечной точку в сильных кислотах -сильный базовое титрования или в потенциометрическом титровании . Такие графики также использовались для калибровки стеклянных электродов, для оценки содержания карбоната в водных растворах и для оценки значений K a ( константы кислотной диссоциации ) слабых кислот и оснований по данным титрования.
На графиках Gran используются линейные аппроксимации априорных нелинейных соотношений между измеренной величиной, pH или электродвижущим потенциалом (ЭДС) и объемом титранта. Другие типы измерений концентрации, такие как спектрофотометрические измерения поглощения или химические сдвиги ЯМР , в принципе могут быть обработаны аналогичным образом. Эти приближения действительны только вблизи конечной точки, но не в ней, поэтому метод отличается от оценок конечной точки с помощью первой и второй производной.графики, которые требуют данных в конечной точке. Графики Gran изначально были разработаны для графических определений в докомпьютерные времена, при этом график xy на бумаге будет вручную экстраполироваться для оценки пересечения с x. Графическое представление и визуальная оценка конечной точки были заменены более точным анализом методом наименьших квадратов с появлением современных компьютеров и программных пакетов, особенно программ электронных таблиц со встроенными функциями наименьших квадратов.
Основа расчетов [ править ]
График Гран основан на уравнении Нернста, которое можно записать как
где E - измеренный потенциал электрода, E 0 - стандартный потенциал электрода, s - наклон, идеально равный RT / nF, а {H + } - активность иона водорода. Выражение перестраивается на
в зависимости от того, калиброван ли электрод в милливольтах или pH. Для удобства вместо активности используется концентрация [H + ]. При титровании сильной кислоты сильной щелочью аналитическая концентрация иона водорода получается из начальной концентрации кислоты C i и количества щелочи, добавленной во время титрования.
где v i - начальный объем раствора, c OH - концентрация щелочи в бюретке, v - объем титра. Приравнивая два выражения для [H + ] и упрощая, получаем следующее выражение
Заговор против v будет прямой линией. Если Е 0 и s известны из электрода калибровки, где линия пересекает ось абсцисс показывает громкость в точке эквивалентности, . В качестве альтернативы этот график можно использовать для калибровки электрода, найдя значения E 0 и s, которые дают наилучшую прямую линию.
Титрование сильной кислоты сильным основанием [ править ]
Для титрования сильной кислоты и сильного основания, контролируемого по pH, в любой i- й точке титрования
где K w - константа автопротолиза воды .
Если титрование кислоты первоначального объема и концентрации с основанием концентрации , то в любом I» я точки в титровании объема титранта ,
В точке эквивалентности , то объем эквивалентности .
Таким образом,
- участок будет иметь линейную область до эквивалентности, с наклоном
- и график будет иметь линейную область после эквивалентности с наклоном
- оба участка будут иметь перехват
Объем эквивалентности используются для вычисления зависимости от того , из или неизвестно.
PH-метр обычно калибруется с помощью буферных растворов при известных значениях pH перед началом титрования. Ионная сила может поддерживаться постоянной при разумном выборе кислоты и основания. Например, HCl, титрованный NaOH примерно такой же концентрации, заменит H + на ион (Na + ) с таким же зарядом и той же концентрацией, чтобы ионная сила оставалась довольно постоянной. В противном случае можно использовать относительно высокую концентрацию фонового электролита или вычислить коэффициент активности . [1]
Титрование сильного основания сильной кислотой [ править ]
Зеркальные графики получаются при титровании основания кислотой, причем знаки наклонов меняются на противоположные.

Рисунок 1. Примеры графиков Гран с использованием данных Батлера (1998). Обратите внимание, что закрашенные кружки указывают точки данных, включенные в вычисления методом наименьших квадратов, чтобы получить аппроксимированные пунктирные линии.
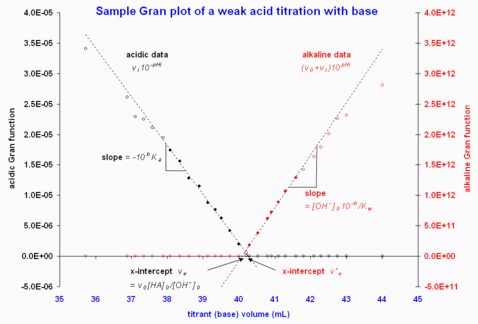
Рис. 2. Примеры графиков Гран с использованием данных из «интерактивного источника» . Проверено 18 февраля 2008 .Показана только область, близкая к эквивалентности, поскольку данные, далекие от эквивалентности, сильно отклоняются от линейности. Обратите внимание, что закрашенные кружки обозначают точки данных, включенные в вычисления методом наименьших квадратов, чтобы получить аппроксимированные пунктирные линии.
Следовательно,
- участок будет иметь линейную область до эквивалентности с наклоном
- и график будет иметь линейную область после эквивалентности с наклоном
- оба графика будут иметь пересечение по оси x
На рис. 1 представлены образцы графиков Gran при титровании сильным основанием и сильной кислотой.
Концентрации и константы диссоциации слабых кислот [ править ]
Метод может быть использован для оценки констант диссоциации слабых кислот, а также их концентраций (Gran, 1952). С кислотой, представленной HA, где
- ,
мы имеем в любой i- й точке титрования объема кислоты при концентрации по основанию концентрации . В линейных областях, отличных от эквивалентности,
- и
являются допустимыми приближениями, откуда
- , или же
- или, потому что ,
- .
График зависимости будет иметь наклон по линейной кислотной области и экстраполированный отрезок x , на основании которого может быть вычислено либо, либо . [1] Щелочная область обрабатывается так же, как и при титровании сильной кислоты . На рис. 2 приведен пример; в этом примере два отсекаемых по оси x отличаются примерно на 0,2 мл, но это небольшое расхождение, учитывая большой эквивалентный объем (ошибка 0,5%).
Аналогичные уравнения можно написать для титрования слабого основания сильной кислотой (Gran, 1952; Harris, 1998).
Карбонатное содержание [ править ]
Мартелл и Мотекайтис (1992) используют наиболее линейные области и используют разницу в объемах эквивалентности между графиками на кислотной и основной сторонах во время кислотно-основного титрования для оценки дополнительного содержания CO 2 в растворе основания. Это проиллюстрировано на образцах графиков Gran на фиг.1. В этой ситуации дополнительная кислота, используемая для нейтрализации карбоната путем двойного протонирования, в объеме титрата составляет . В противоположном случае титрования кислоты основанием содержание карбоната рассчитывается аналогичным образом из , где - эквивалентный объем со стороны основания (от Martell и Motekaitis).
Когда общее содержание CO 2 является значительным, как в природных водах и щелочных стоках, на кривых pH-объема можно увидеть два или три перегиба из-за буферизации более высокими концентрациями бикарбоната и карбоната. Как обсуждали Штум и Морган (1981), при анализе таких вод можно использовать до шести графиков Гран из одного титрования для оценки нескольких конечных точек и измерения общей щелочности и содержания карбонатов и / или бикарбонатов.
Потенциометрический мониторинг H + [ править ]
Чтобы использовать потенциометрические (ЭДС) измерения для контроля концентрации вместо показаний, можно тривиально задать и применить те же уравнения, что и выше, где - поправка смещения , а - поправка наклона (1 / 59,2 единиц pH / мВ при 25 ° C), такой, что заменяет .
Таким образом, как и раньше при титровании сильной кислоты сильным основанием,
- график vs. будет иметь линейную область до эквивалентности, с наклоном
- а график зависимости после эквивалентности будет иметь линейную область с наклоном
- оба графика будут иметь пересечение, и, как и раньше, эквивалентный объем на кислотной стороне можно использовать для стандартизации той концентрации, которая неизвестна, а разница между эквивалентными объемами на кислотной и основной сторонах может быть использована для оценки содержания карбонатов.
Аналогичные графики можно построить, используя данные титрования основания кислотой.
Калибровка электрода [ править ]
Обратите внимание, что приведенный выше анализ требует предварительного знания и .
Если pH-электрод плохо откалиброван, поправка смещения может быть вычислена на месте по кислотной стороне градиента Gran:
- Для титрования кислоты основанием наклон кислотной стороны ( ) может использоваться для вычисления с использованием известного значения или значения, полученного посредством эквивалентного объема. затем можно рассчитать по наклону со стороны основания.
- Для титрования основания кислотой, как показано на образцах графиков, наклон кислотной стороны ( ) аналогичным образом используется для вычисления, а наклон стороны основания ( ) используется для вычисления с использованием известного значения или значения, заданного формулой эквивалентный объем кислотной стороны.
В образце данных, показанном на рисунке 1, эта поправка смещения не была незначительной, при -0,054 единиц pH.
Однако значение может отличаться от теоретического значения и может быть оценено только путем надлежащей калибровки электрода. Калибровка электрода часто выполняется с использованием буферов с известным pH или путем титрования сильной кислоты сильным основанием. В этом случае можно поддерживать постоянную ионную силу, и она известна во всех точках титрования, если известны оба и (и должны иметь прямое отношение к первичным стандартам ). Например, Мартелл и Мотекайтис (1992) рассчитали значение pH, ожидаемое в начале титрования, предварительно оттитровав растворы кислоты и основания относительно первичных стандартов, а затем соответствующим образом скорректировав показания электрода pH, но это не дает поправки на наклон, если нужен один.
Основываясь на более ранних работах по Мак - Брайд (1969), Gans и O'Sullivan (2000) описывают итеративный подход , чтобы достигнуть как и значений в зависимости , от титровании сильной кислоты сильным основанием:
- сначала оценивается по кислотным данным согласно Россотти и Россотти (1965), и первоначально предполагается, что оно имеет теоретическое значение;
- модифицированные функциональные участки Gran рисуются, используя vs. на кислотной стороне эквивалентности и против прогноза на щелочную сторону, а объемы эквивалентности и вычисляются из нее, как и прежде;
- как и раньше, разница в эквивалентных объемах используется для расчета содержания карбоната, а также для расчета «эффективной основной концентрации» для щелочной стороны эквивалентности;
- приблизительные значения рассчитываются для кислотной стороны как и для щелочной стороны как ;
- исходное определение переписывается как , и данные наносятся на график с использованием значений, соответствующих значениям pH в диапазонах 2,5-4,5 и 10,7-11,5 (линейный диапазон отклика для стеклянного электрода, который позволяет избежать изменения потенциалов перехода и / или щелочной ошибка на экстремумах pH, что дополнительно позволяет избежать неопределенностей измерения вблизи точки эквивалентности, а также ошибок вычислений из-за пренебрежения на кислотной стороне и пренебрежения равновесием карбонат / бикарбонат на щелочной стороне); обработка методом наименьших квадратов дает как наклон, так и точку пересечения;
- Шаги 2 и 3 повторяются с новыми и значениями для большей точности в объемах эквивалентности и СО 2 содержания.
В принципе, процедура может быть модифицирована для титрования основания кислотой. Компьютерная программа под названием GLEE (от GLass Electrode Evaluation) реализует этот подход к титрованию кислоты основанием для калибровки электродов. Эта программа дополнительно может вычислить (с помощью отдельного нелинейного метода наименьших квадратов) «поправку» на базовую концентрацию. Преимущество этого метода калибровки электродов состоит в том, что его можно выполнять в той же среде с постоянной ионной силой, которая позже может быть использована для определения констант равновесия .
Обратите внимание, что обычные функции Гран обеспечат требуемые объемы эквивалентности и, как изначально задано теоретическое значение, начальная оценка дляна этапе 1 может быть получен из наклона регулярной кислотной функции Gran, как подробно описано ранее. Также обратите внимание, что эта процедура вычисляет содержание CO 2 и действительно может быть объединена с полной стандартизацией базы, используя определение для вычисления . Наконец, применимый диапазон pH может быть расширен путем решения квадратичного уравнения для .
Потенциометрический мониторинг других видов [ править ]
Рисунок 3. Образец графиков Gran с использованием данных потенциометрического титрования Cl - с помощью Ag + . Потенциалы были преобразованы в значения [Ag + ] для построения графика. Обратите внимание, что закрашенные кружки обозначают точки данных, включенные в вычисления методом наименьших квадратов, чтобы получить аппроксимированные пунктирные линии.
Потенциометрические данные также используются для мониторинга других видов, кроме . При мониторинге любых видов с помощью потенциометрии можно применить тот же формализм с . Таким образом, титрование раствора другого вида по видам аналогично рН-мониторингу титрования основания с помощью кислоты, откуда либо или графика зависимости будет иметь й-перехват . При обратном титровании by , эквивалентный объем будет. Значимость наклонов будет зависеть от взаимодействий между двумя видами, будь то соединение в растворе или выпадение вместе (Gran, 1952). Обычно интерес представляет только точка эквивалентности. Однако наклон до эквивалентности в принципе можно использовать для оценки произведения растворимости таким же образом, как это можно определить при кислотно-основном титровании, хотя также могут иметь место другие взаимодействия ионной пары. [2]
Чтобы проиллюстрировать это, рассмотрим титрование Cl - с помощью Ag +, контролируемое потенциометрически:
Следовательно,
- участок будет иметь линейную область до эквивалентности, с наклоном
- и график будет иметь линейную область после эквивалентности с наклоном
- на обоих графиках пересечение по оси x равно
На рис. 3 приведены примерные графики данных потенциометрического титрования.
Неидеальное поведение [ править ]
При любом титровании без компонентов буферизации графики как до эквивалентности, так и за пределами эквивалентности должны в идеале пересекать ось x в одной и той же точке. Неидеальное поведение может быть результатом ошибок измерения ( например, плохо откалиброванного электрода, недостаточного времени уравновешивания перед записью показаний электрода, дрейфа ионной силы), ошибок выборки ( например, низкой плотности данных в линейных областях) или неполной химической модели ( например, наличие титруемых примесей, таких как карбонат, в основе или неполное осаждение при потенциометрическом титровании разбавленных растворов, для чего Гран и др. (1981) предлагают альтернативные подходы). Buffle et al. (1972) обсуждают ряд источников ошибок.
Поскольку члены или в функциях Грана только асимптотически стремятся к оси x и никогда не достигают ее, во всех случаях следует ожидать приближения кривизны к точке эквивалентности. Тем не менее, среди практикующих специалистов существуют разногласия относительно того, какие данные отображать на графике, использовать ли данные только с одной стороны эквивалентности или с обеих сторон, и выбирать ли данные, наиболее близкие к эквивалентности, или наиболее линейные части: [3] [4] с использованием данные, ближайшие к точке эквивалентности, позволят двум точкам пересечения по оси x быть более совпадающими друг с другом и лучше совпадать с оценками по производным графикам, в то время как использование кислотных данных в кислотно-основном титровании, по-видимому, минимизирует помехи от титруемых (буферных) примесей , например, бикарбонат / карбонат в основе (см.Содержание карбоната ), и эффект дрейфующей ионной силы. На демонстрационных графиках, представленных на рисунках, наиболее линейные области (данные, представленные закрашенными кружками) были выбраны для вычислений наклонов и пересечений методом наименьших квадратов. Выбор данных всегда субъективен.
Ссылки [ править ]
- Баффл, Дж., Партасарати, Н. и Монье, Д. (1972): Ошибки в методе сложения Гран. Часть I. Теоретический расчет статистических ошибок; Анальный. Чим. Acta 59 , 427-438; Buffle, J. (1972): Anal. Чим. Акта 59 , 439.
- Батлер, Дж. Н. (1991): равновесия углекислого газа и их применения; CRC Press: Бока-Ратон, Флорида.
- Батлер, Дж. Н. (1998): Ионное равновесие: расчеты растворимости и pH; Wiley-Interscience. Глава. 3.
- Ганс, П. и О'Салливан, Б. (2000): GLEE, новая компьютерная программа для калибровки стеклянных электродов; Таланта , 51 , 33–37.
- Гран, Г. (1950): Определение точки эквивалентности при потенциометрическом титровании, Acta Chemica Scandinavica , 4 , 559-577.
- Гран, Г. (1952): Определение точки эквивалентности при потенциометрическом титровании - Часть II, Analyst , 77 , 661-671.
- Гран, Г., Йоханссон, А. и Йоханссон, С. (1981): Автоматическое титрование путем пошагового добавления равных объемов титранта. Часть VII. Потенциометрическое титрование осаждением, Analyst , 106 , 1109-1118.
- Харрис, округ Колумбия: количественный химический анализ, 5-е изд .; WH Freeman & Co., New. Йорк, Нью-Йорк, 1998.
- Мартелл, А.Е. и Мотекайтис, Р.Дж .: Определение и использование констант стабильности, Wiley-VCH, 1992.
- Макбрайд, Вашингтон (1969): Аналитик , 94 , 337.
- Rossotti, FJC и Rossotti, H. (1965): J. Chem. Изд ., 42 , 375
- Скуг, Д.А., Вест, Д.М., Холлер, Ф.Дж. и Крауч, С.Р. (2003): Основы аналитической химии: Введение, 8-е изд., Брукс и Коул, гл. 37.
- Штумм В. и Морган Дж. Дж. (1981): водная химия, 2-е изд .; John Wiley & Sons, Нью-Йорк.
Заметки [ править ]
- ^ a b Если ионная сила непостоянна, можно исправить это выражение для изменения коэффициента активности. См. Харрис (1998) или этот «он-лайн документ» (PDF) . Проверено 17 февраля 2008 .
- ^ Гран и др. (1981) дают более подробную трактовку, которая учитывает другие сложные частицы при титровании Cl - Ag + (особенно Ag 2 Cl + и AgCl 2 - ) и в других титрованиях осаждением, чтобы вычислить эквивалентные объемы разбавленного раствора. растворы, когда осаждение неполное.
- ^ «Он-лайн документ» (PDF) . Архивировано из оригинального (PDF) 17 декабря 2008 года . Проверено 17 февраля 2008 . ) И В. Wolbach ДеПол университета ( "Он-лайн документ" (PDF) . Источник 2008-02-17 . ) рекомендуют использовать последние 10-20% объемные данные перед точкой эквивалентности, и последняя признает, что графики Gran на стороне основания, полученные при титровании кислоты основанием ( то есть после точки эквивалентности), могут использоваться для оценки содержания CO 2 в основе. . Кроме того , мы Brewer и JL Ферри из Университета Южной Каролины рекомендуют использовать эти данные в пределах 10% перед эквивалентности ( «он-лайн» документ (PDF) . Извлекаться 2008-02-17 . ). К. Кувата из Macalester колледжа рекомендует студент выбрать любую область данных дает прямую линию до эквивалентности ( «Он-лайна документ» (PDF) . Источник 2008-02-17 . ). Д.Л. Зеллмер из Калифорнийского государственного университета во Фресно просит студентов построить график данных с обеих сторон эквивалентности, используя данные, наиболее далекие от эквивалентности, и оценить ошибки, чтобы определить, действительно ли две оценки объемов эквивалентности существенно различаются (pH данные: "Он-лайн документ" . Проверено 17 февраля 2008 .; потенциометрическое титрование хлорид-иона ионом серебра: «Электронный документ» . Проверено 17 февраля 2008 .).
- ^ Батлер (1991) обсуждает вопрос выбора данных, а также исследует влияние титруемых примесей, таких как борат и фосфат.

![{\ displaystyle [H ^ {+}] = 10 ^ {\ frac {EE ^ {0}} {s}} \ или \ [H ^ {+}] = 10 ^ {- pH}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/54cc2b0dad52a2a38d4eae5d61668859a598aff0)
![{\ displaystyle [H ^ {+}] = {\ frac {C_ {i} v_ {i} -c_ {OH} v} {v_ {i} + v}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4fa60de2bc0b02925c56225af1ad7af24904981e)



![{\ displaystyle K_ {w ^ {}} = [H ^ {+}] _ {i} [OH ^ {-}] _ {i}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1db0b94c20344944dea92ee4878afb135017aaef)

![{\ displaystyle [H ^ {+}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1ad86c50bb5c87cbc6ce8e6140089390b1797c64)
![{\ displaystyle [ОН ^ {-}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/349ebe8d364545dc81a278f8396263ae21b7c12b)

![{\ displaystyle {\ frac {v_ {0} [H ^ {+}] _ {0} -v_ {i} [OH ^ {-}] _ {0}} {v_ {0} + v_ {i}} } {\ begin {cases} \ приблизительно [H ^ {+}] _ {i} {\ text {или}} 10 ^ {- pH_ {i}} & {\ text {when}} v_ {0 ^ {} } [H ^ {+}] _ {0}> v_ {i} [OH ^ {-}] _ {0} {\ text {(кислотная область)}} \\ = 0 & {\ text {when}} v_ {0 ^ {}} [H ^ {+}] _ {0} = v_ {i} [OH ^ {-}] _ {0} {\ text {(точка эквивалентности)}} \\\ приблизительно - [OH ^ {-}] _ {i} {\ text {или}} - K_ {w} 10 ^ {pH_ {i}} & {\ text {when}} v_ {0 ^ {}} [H ^ {+} ] _ {0} <v_ {i} [OH ^ {-}] _ {0} {\ text {(щелочная область)}} \ end {cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dc9534301f6128c37f6a45e275d7beadb97a34bb)


![{\ displaystyle - [ОН ^ {-}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/30990190f192ab893969327d787e617348fe2441)

![{\ displaystyle [OH ^ {-}] _ {0} / K_ {w ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af930d58632586406096e06ab513b848df232ae7)
![{\ displaystyle v_ {e} = v_ {0} [H ^ {+}] _ {0} / [OH ^ {-}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f5699e3929db80c1d0387b0fa7ec845a08cc88c9)
![{\ displaystyle {\ frac {v_ {0} [OH ^ {-}] _ {0} -v_ {i} [H ^ {+}] _ {0}} {v_ {0} + v_ {i}} } {\ begin {cases} \ приблизительно [OH ^ {-}] _ {i} {\ text {или}} K_ {w} 10 ^ {pH_ {i}} & {\ text {when}} v_ {0 ^ {}} [OH ^ {-}] _ {0}> v_ {i} [H ^ {+}] _ {0} {\ text {(щелочная область)}} \\ = 0 & {\ text {когда }} v_ {0 ^ {}} [OH ^ {-}] _ {0} = v_ {i} [H ^ {+}] _ {0} {\ text {(точка эквивалентности)}} \\\ приблизительно - [H ^ {+}] _ {i} {\ text {or}} - 10 ^ {- pH_ {i}} & {\ text {when}} v_ {0 ^ {}} [OH ^ {-} ] _ {0} <v_ {i} [H ^ {+}] _ {0} {\ text {(кислотная область)}} \ end {cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/34d2024e286f5db906831a2e8c22a87571c2eb0a)
![{\ displaystyle - [H ^ {+}] _ {0} / K_ {w ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6fddfd232316e598f2b66875c068bc44460cdd77)
![{\ displaystyle v_ {e} = v_ {0} [OH ^ {-}] _ {0 ^ {}} / [H ^ {+}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6704c0ce6a65dc0dd1076e376c07a25074b0c56)
![{\ displaystyle K_ {a} = {\ frac {[H ^ {+}] _ {i} [A ^ {-}] _ {i}} {[HA] _ {i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cdf8a34c0247b6b88619d4d2668221637a258b99)

![{\ displaystyle [HA] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1756ca0b12a2f09e9ace6fefaf7667454ed186d2)
![{\ displaystyle [ОН ^ {-}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/528d40dd3e1f5de41850626c0b99d0a7f538f8ae)
![{\ displaystyle [HA] _ {i} \ приблизительно {\ frac {v_ {0} [HA] _ {0} -v_ {i} [OH ^ {-}] _ {0}} {v_ {0} + v_ {i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/19224a237e91bfe16ce79a2973ddb89dbba5f4c2)
![{\ displaystyle [A ^ {-}] _ {i} \ приблизительно {\ frac {v_ {i} [OH ^ {-}] _ {0}} {v_ {0} + v_ {i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f8ac0f9648acacf896ef1e36fb107d1eb9f6c4c2)
![{\ displaystyle K_ {a} \ приблизительно {\ frac {10 ^ {- pH_ {i}} v_ {i} [OH ^ {-}] _ {0}} {v_ {0} [HA] _ {0} -v_ {i} [ОН ^ {-}] _ {0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d9bc507e795dfea831b4012a9dcf742c91beed1c)
![{\ displaystyle K_ {a} (v_ {0} {\ frac {[HA] _ {0}} {[OH ^ {-}] _ {0}}} - v_ {i}) \ приблизительно 10 ^ {- pH_ {i}} v_ {i}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/77dc2909198804c04da9d24a259197c9d439d359)
![{\ displaystyle v_ {e} = v_ {0} {\ frac {[HA] _ {0}} {[OH ^ {-}] _ {0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a195a786d0c9400c36d1e1eaff9ddebfd7cb8c9e)




![{\ displaystyle [HA] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/01055bdd1d78a237b8c0bf09dd10fc8457520cdb)
![{\ displaystyle (v_ {e} -v_ {e} ^ {\ prime}) [H ^ {+}] _ {0 ^ {}} = 2v_ {0} [CO_ {2}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd551caef6ac3c109713851f5b6345c2fcaffeb2)
![{\ displaystyle (v_ {e} ^ {\ prime} -v_ {e}) [OH ^ {-}] _ {0 ^ {}} = 2v_ {e} ^ {\ prime} [CO_ {2}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb1956588a4c55722d610e836490ea8ea159e414)




![{\ displaystyle -log_ {10} [H ^ {+}] _ {i} = b_ {0} -b_ {1} E_ {i ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/70741e6ba1b626302187955e8b1d32ce102eba20)






![{\ displaystyle -10 ^ {b_ {0}} [ОН ^ {-}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d8a85a80049e3f6c5297bbf42f8deccbce01821c)

![{\ displaystyle 10 ^ {- b_ {0}} [OH ^ {-}] _ {0} / K_ {w ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/86b814278e54ca0355316067e831e769e5519e08)
![{\ displaystyle - [OH ^ {-}] _ {0 ^ {}} 10 ^ {b_ {0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c089bb758310a6f737e29853a0b075e980378b32)

![{\ displaystyle [H ^ {+}] _ {0 ^ {}} 10 ^ {b_ {0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fd321617413b9314c1a63743dfc2fdcf7b11eea1)
![{\ displaystyle - [H ^ {+}] _ {0 ^ {}} 10 ^ {- b_ {0}} / K_ {w}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0ead3ce9876a94a8bd46d7cfe73e707bc2e7707a)
![{\ displaystyle [H ^ {+ _ {}}] _ {я}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/becbf5d2e21654200c46fa31d0f2c3145403f992)
![{\ displaystyle [H _ {} ^ {+}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39338d2723e07adaecc434ec8d7e86fa6499f239)
![{\ displaystyle [ОН _ {} ^ {-}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/650afe4f973213f6c9c51c2c92009f87a08a4372)


![{\ displaystyle v_ {e} [OH ^ {-}] _ {0 ^ {}} / v_ {e} ^ {\ prime}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5a35c98ffe984a3ac4995bf249effd05b1fed3e)
![{\ displaystyle [H ^ {+}] _ {я ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bcac7a06f0f699d71340713329cd33e33c623abb)
![{\ displaystyle (v_ {0 ^ {}} [H ^ {+}] _ {0} -v_ {i} [OH ^ {-}] _ {0}) / (v_ {0} + v_ {i} )}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4dc107a833fc669533394df6901c516255bd6e46)
![{\ displaystyle (v_ {e} [H ^ {+}] _ {0} -v_ {i} v_ {e} [OH ^ {-}] _ {0} / v_ {e} ^ {\ prime}) / (v_ {0} + v_ {i})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/721aaf6302494a767750d0c7c4f176e14345f69e)
![{\ displaystyle E_ {я ^ {}} = b_ {0} / b_ {1} + (1 / b_ {1}) log_ {10} [H ^ {+}] _ {i}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81d60b752e3a97207ac1564c74b77021bb2b8748)
![{\ displaystyle log_ {10} [H ^ {+}] _ {я ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa262e87a4d416162b2e3ce1d9c18980afb6f1f8)
![{\ displaystyle [ОН ^ {-}] _ {я ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b550c62051cba4fe4c8b63f03fe0412520b5a78c)


![{\ displaystyle (v_ {0 {^ {}}} [H ^ {+}] _ {0} -v_ {i} [OH ^ {-}] _ {0}) / (v_ {0} + v_ { i}) = [H ^ {+}] _ {i} -K_ {w} / [H ^ {+}] _ {i}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0bb66cda334f6082deb14053a64f5dd26e3375ae)

![{\ displaystyle -log_ {10} [S ^ {1}] _ {i} = b_ {0} -b_ {1} E_ {i ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bdcdb2dbf4bb1e3adae9a8d420ee793d276f39b7)

![{\ displaystyle v_ {0} [S ^ {0}] _ {0} / [S ^ {1}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c7cb445111bc6469dc5c85492d9997f48d3ca1c9)
![{\ displaystyle v_ {0} [S ^ {1}] _ {0} / [S ^ {0}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8795d1a16a8e7bad358482bacee448b6cfd1f5c0)

![{\ displaystyle {\ frac {v_ {0} [Cl ^ {-}] _ {0} -v_ {i} [Ag ^ {+}] _ {0}} {v_ {0} + v_ {i}} } {\ begin {case} \ приблизительно [Cl ^ {-}] _ {i} {\ text {или}} K_ {sp} 10 ^ {- b_ {1} E_ {i} + b_ {0}} & {\ text {when}} v_ {0 ^ {}} [Cl ^ {-}] _ {0}> v_ {i} [Ag ^ {+}] _ {0} {\ text {(до эквивалентности)} } \\ = 0 & {\ text {когда}} v_ {0 ^ {}} [Cl ^ {-}] _ {0} = v_ {i} [Ag ^ {+}] _ {0} {\ text { (точка эквивалентности)}} \\\ приблизительно - [Ag ^ {+}] _ {i} {\ text {или}} - 10 ^ {b_ {1} E_ {i} -b_ {0}} & {\ текст {когда}} v_ {0 ^ {}} [Cl ^ {-}] _ {0} <v_ {i} [Ag ^ {+}] _ {0} {\ text {(после эквивалентности)}} \ конец {case}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/911677d9d43bd0d8faee7d987a44dde0c690a06e)

![{\ displaystyle - [Ag ^ {+}] _ {0} 10 ^ {- b_ {0}} / K_ {sp ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b9c5abe2ea483461e18a92ca2d2da8f1f748219)

![{\ displaystyle [Ag ^ {+}] _ {0 ^ {}} 10 ^ {b_ {0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b562cbcbc203994c58df2cd1d371fe06f3ed78b)
![{\ displaystyle v_ {e} = v_ {0} [Cl ^ {-}] _ {0 ^ {}} / [Ag ^ {+}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed8e4ff242b2d73b7c008d9ea7cee66599fa54a3)

