| Гемидесмосома | |
|---|---|
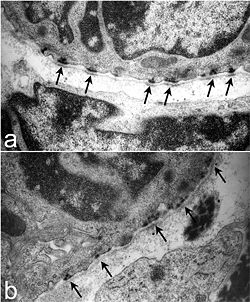 Ультраструктура гемидесмосом трахеи мышей. У нормальной мыши (а) имеются четко очерченные организованные гемидесмосомы с затемненными участками в плотной пластинке, примыкающей к гемидесмосоме (стрелки). Напротив, гемидесмосомы в Lamc2 - / - трахее (b) менее организованы, внутриклеточный компонент более диффузный, а плотная пластинка непосредственно под областями гемидесмосом не имеет электронной плотности, наблюдаемой в контроле у однопометников (стрелки). Из Nguyen et al., 2006. [1] | |
| Подробности | |
| Идентификаторы | |
| латинский | гемидесмосома |
| MeSH | D022002 |
| TH | H1.00.01.1.02029 |
| FMA | 67415 |
| Анатомическая терминология | |
Гемидесмосома очень малы шпилька-подобных структур , найденных в кератиноциты этих эпидермис кожи , которые прикрепляются к внеклеточного матрикса . Они похожи по форме на десмосомы при визуализации с помощью электронной микроскопии , однако десмосомы прикрепляются к соседним клеткам. Гемидесмосомы также сопоставимы с фокальными адгезиями, поскольку они обе прикрепляют клетки к внеклеточному матриксу. Вместо десмоглеинов и десмоколлинов во внеклеточном пространстве гемидесмосомы используют интегрины . Гемидесмосомы обнаруживаются в эпителиальных клетках, соединяющих базальные эпителиальные клетки с lamina lucida., которая является частью базальной пластинки . [2] Гемидесмосомы также участвуют в сигнальных путях, таких как миграция кератиноцитов или проникновение клеток карциномы . [3]
Структура [ править ]
Гемидесмосомы можно разделить на два типа в зависимости от их белковых компонентов. Гемидесмосомы 1 типа обнаруживаются в стратифицированном и псевдослоистом эпителии . Гемидесмосомы типа 1 имеют пять основных элементов: интегрин α6β4, плектин в его изоформе 1a, то есть P1a, белок тетраспанина CD151, BPAG1e или изоформа e буллезного пемфигоидного антигена и BPAG2 (также известный как BP180 или коллаген 17 типа). [2] Гемидесмосомы типа 1 обнаруживаются в стратифицированной и псевдостратифицированной эпителиальной ткани. Гемидесмосомы типа 2 содержат интегрин α6β4 и плектин без антигенов BP. [4]
Гемидесмосомы имеют два трансмембранных компонента: интегрин α6β4 и плектин 1a. Интегрин α6β4 действует как рецептор ламинина-332 . Интегрин α6β4 состоит из двух димеров субъединиц α и β. Более крупная субъединица β4 имеет домены, которые связываются с фибронектином III и кальцием. Субъединица α6 связывается с внеклеточным BP180, CD151 и ламинином-322. Когда интегрин α6β4 связывается с плектином 1a и BPAG1, он связывается с кератиновыми промежуточными филаментами в цитоскелете. [2]
Гемидесмосомы связаны с кератином изоформой 1a плектина из семейства белков плакина . Плектин представляет собой белок 500 кДа с длинным стержневидным доменом и доменом на конце, который содержит промежуточный сайт связывания филаментов. BPAG2, или (буллезный пемфигоидный антиген 2), представляет собой трансмембранный белок, который существует рядом с интегринами, BPAG2 имеет домены, которые связываются с плектином, субъединицей интегрина β4 в цитоплазме и интегрином α6 и ламинином-332 во внеклеточном пространстве. CD151, белок суперсемейства тетраспанинов , находится на поверхности клеток кератиноцитов и эндотелия сосудов . CD151 помогает в образовании гемидесмосом. BPAG1e - это антиген с множеством изоформ, который связывается с интегрином α6β4, BPAG2 икератин 5 и 14 . Основная роль BPAG1e заключается в стабильности гемидесмосом. [2]
Заболевания [ править ]
Сохранение базальных эпидермальных кератиноцитов прикрепленными к базальной пластинке жизненно важно для гомеостаза кожи . Генетические или приобретенные заболевания, вызывающие нарушение работы компонентов гемидесмосом, могут приводить к образованию пузырей между различными слоями кожи. Это буллезный эпидермолиз , или БЭ. Типичные симптомы включают хрупкую кожу, образование волдырей и эрозию от незначительных физических нагрузок. [2] Однако болезнь также может проявляться в виде эрозий на роговице, трахее, желудочно-кишечном тракте, пищеводе, мышечной дистрофии и мышечной деформации. [5]
Мутации в 12 различных генах, которые кодируют части гемидесмосомы, привели к буллезному эпидермолизу. [6] Существует три типа БЭ: симплекс БЭ (ЭБС), дистрофический БЭ (ДЭБ) и узловой БЭ (JEB). При простом буллезном эпидермолизе слои эпидермиса разделяются. EBS вызывается мутациями, кодирующими кератин, плектин и BPAG1e. При соединительном буллезном эпидермолизе слои lamina lucida (часть базальной пластинки) разделяются. Это вызвано мутациями интегрина α6β4, ламинина 322 и BPAG2. При дистрофическом буллезном эпидермолизе слои папиллярной дермы отделяются от закрепляющих фибрилл . Это вызвано мутациями в коллагене 7. ген.
См. Также [ править ]
- Десмосома
- Буллезный эпидермолиз
- Очаговая адгезия
Ссылки [ править ]
- ^ Нгуен Н.М., Pulkkinen L, Schlueter JA, Meneguzzi G, J Uitto, старший RM (2006). «Развитие легких при дефиците ламинина γ2: аномальные трахеальные гемидесмосомы с нормальным морфогенезом ветвления и дифференцировкой эпителия» . Респир. Res. 7 (1): 28. DOI : 10,1186 / 1465-9921-7-28 . PMC 1386662 . PMID 16483354 .
- ^ a b c d e Уолко, Гернот; Кастаньон, Мария Дж .; Виче, Герхард (май 2015 г.). «Молекулярная архитектура и функция гемидесмосомы» . Исследования клеток и тканей . 360 (2): 363–378. DOI : 10.1007 / s00441-014-2061-z . ISSN 1432-0878 . PMC 4544487 . PMID 25487405 .
- ^ Вильгельмсен, Кевин; Litjens, Sandy HM; Зонненберг, Арно (апрель 2006 г.). «Множественные функции интегрина alpha6beta4 в эпидермальном гомеостазе и туморогенезе» . Молекулярная и клеточная биология . 26 (8): 2877–2886. DOI : 10.1128 / MCB.26.8.2877-2886.2006 . ISSN 0270-7306 . PMC 1446957 . PMID 16581764 .
- ^ Fontao, L .; Stutzmann, J .; Джендри, П .; Лоне, Дж. Ф. (1 августа 1999 г.). «Регуляция сборки гемидесмосомных бляшек типа II в эпителиальных клетках кишечника». Экспериментальные исследования клеток . 250 (2): 298–312. DOI : 10.1006 / excr.1999.4549 . ISSN 0014-4827 . PMID 10413585 .
- ^ Сабир, Ajoy; Брукнер-Тудерман, Лина; Чаппл, Иэн LC; Хорошо, Джо-Дэвид; Харпер, Наташа; Имеет, Кристина; Magin, Thomas M .; Маринкович, М. Петр; Маршалл, Джон Ф .; McGrath, John A .; Меллерио, Джемайма Э. (24 сентября 2020 г.). «Буллезный эпидермолиз» . Nature Reviews Праймеры для болезней . 6 (1): 78. DOI : 10.1038 / s41572-020-0210-0 . ISSN 2056-676X . PMID 32973163 . S2CID 221861310 .
- ^ Хорошо, Джо-Дэвид; Брукнер-Тудерман, Лина; Иди, Робин А.Дж.; Bauer, Eugene A .; Бауэр, Иоганн В .; Имеет, Кристина; Хегерти, Адриан; Хинтнер, Гельмут; Овнанян, Ален (июнь 2014 г.). «Унаследованный буллезный эпидермолиз: обновленные рекомендации по диагностике и классификации». Журнал Американской академии дерматологии . 70 (6): 1103–1126. DOI : 10.1016 / j.jaad.2014.01.903 . ISSN 1097-6787 . PMID 24690439 .
| Викискладе есть медиафайлы, связанные с гемидесмосомами . |