В биохимии модель Monod-Wyman-Changeux ( модель MWC , также известная как модель симметрии ) описывает аллостерические переходы белков, состоящих из идентичных субъединиц. Он был предложен Жан-Пьером Ченжё в его докторской диссертации и описан Жаком Моно , Джеффрисом Вайманом и Жан-Пьером Чангу . [1] [2] Это контрастирует с последовательной моделью . [3]
Концепция двух различных симметричных состояний является центральным постулатом модели MWC. Основная идея состоит в том, что регулируемые белки , такие как многие ферменты и рецепторы , существуют в различных взаимопревращаемых состояниях в отсутствие какого-либо регулятора . Соотношение различных конформационных состояний определяется тепловым равновесием . Эта модель определяется следующими правилами:
- Аллостерический белок представляет собой олигомер протомеров, которые симметрично связаны (для гемоглобина мы будем предполагать, ради алгебраической простоты, что все четыре субъединицы функционально идентичны).
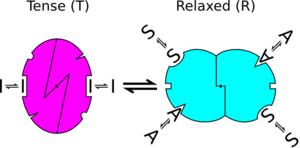
- Каждый протомер может существовать (по крайней мере) в двух конформационных состояниях, обозначенных T и R; эти состояния находятся в равновесии независимо от того, связан лиганд с олигомером или нет.
- Лиганд может связываться с протомером в любой конформации. Только конформационное изменение изменяет сродство протомера к лиганду. Регуляторы просто сдвигают равновесие в сторону того или иного состояния. Например, агонист стабилизирует активную форму фармакологического рецептора . Феноменологически похоже, что агонист провоцирует конформационный переход. Одной из важнейших особенностей модели является диссоциация между функцией связывания (доля белка, связанного с регулятором) и функцией состояния (доля белка в активированном состоянии), см. Ниже. В моделях, называемых «индуцированной подгонкой», эти функции идентичны.
В исторической модели каждая аллостерическая единица, называемая протомером (обычно считается субъединицей), может существовать в двух разных конформационных состояниях - обозначенных «R» (расслабленное) или «T» (напряженное) состояния. В любой молекуле все протомеры должны находиться в одном и том же состоянии. То есть все субъединицы должны находиться либо в состоянии R, либо в состоянии T. В этой модели не допускаются белки с субъединицами в разных состояниях. Состояние R имеет более высокое сродство к лиганду, чем состояние T. Из-за этого, хотя лиганд может связываться с субъединицей, когда она находится в любом состоянии, связывание лиганда будет увеличивать равновесие в пользу состояния R.
Можно вывести два уравнения, которые выражают фракционную занятость сайта связывания лиганда (Y) и долю белков в состоянии R (R):
Где - аллостерическая константа, то есть отношение белков в состояниях T и R в отсутствие лиганда, - это отношение аффинностей состояний R и T к лиганду, и нормализованная концентрация лиганда. Не сразу очевидно, что выражение для является формой уравнения Адаира , но на самом деле это так, как можно увидеть, перемножив выражения в скобках и сравнив коэффициенты при степенях с соответствующими коэффициентами в уравнении Адаира. [4]
Эта модель объясняет сигмоидальные связывающие свойства (то есть положительную кооперативность ), поскольку изменение концентрации лиганда в небольшом диапазоне приведет к значительному увеличению доли молекул в состоянии R и, таким образом, приведет к высокой ассоциации лиганда с белок. Это не может объяснить отрицательное сотрудничество.
Модель MWC оказалась очень популярной в энзимологии и фармакологии , хотя в некоторых случаях была признана неуместной. Лучший пример успешного применения модели - регуляция функции гемоглобина . Различные авторы предлагали расширения модели для решеток белков. [5] [6] [7] Эдельштейн утверждал, что модель MWC лучше объясняет данные для гемоглобина, чем последовательная модель [3] . [8] Он и Changeux [9] применили эту модель к передаче сигналов. Changeux [10] обсудил статус модели по прошествии 50 лет.
См. Также [ править ]
Ссылки [ править ]
- ^ Monod, J; Wyman, J; Changeux, J.-P. (1965). «О природе аллостерических переходов - правдоподобная модель». J. Mol. Биол . 12 (1): 88–118. DOI : 10.1016 / S0022-2836 (65) 80285-6 .
- ^ Changeux, J.-P. (1964). «Аллостерические взаимодействия интерпретируются в терминах четвертичной структуры». Brookhaven Symp. Биол . 17 : 232–249.
- ^ a b Koshland, DE, Jr .; Némethy, G .; Филмер, Д. (1966). «Сравнение экспериментальных данных связывания и теоретических моделей в белках, содержащих субъединицы». Биохимия . 5 (1): 365–385. DOI : 10.1021 / Bi00865A047 .
- ^ Корниш-Боуден, А. Основы ферментной кинетики (4-е изд.). Вайнхайм, Германия: Wiley-Blackwell. С. 306–310.
- ^ Changeux, J.-P .; Thiery, J .; Tung, Y .; Киттель, К. (1967). «О кооперативности биологических мембран» . Proc. Natl. Акад. Sci. США . 57 (2): 335–341. DOI : 10.1073 / Pnas.57.2.335 .
- Перейти ↑ Wyman, J / (1969). «Возможные аллостерические эффекты в расширенных биологических системах». J. Mol. Биол . 39 (3): 523–538. DOI : 10.1016 / 0022-2836 (69) 90142-9 .
- ^ Герцог, TAJ; Le Novère, N .; Брей, Д. (2001). «Конформационное распространение в кольце белков: стохастический подход к аллостерии». J. Mol. Биол . 308 (3): 541–553. DOI : 10.1006 / jmbi.2001.4610 .
- Перейти ↑ Edelstein, SJ (1971). «Расширения аллостерической модели гемоглобина». Природа . 230 (5291): 224–227. DOI : 10.1038 / 230224A0 .
- ^ Changeux, J.-P .; Эдельштейн, SJ (2005). «Аллостерические механизмы передачи сигналов». Наука . 308 (5727): 1424–1428. DOI : 10.1126 / science.1108595 .
- ^ Changeux, Жан-Пьер (2012). «Аллостерия и модель Моно-Ваймана-Чангуа через 50 лет» (PDF) . Ежегодный обзор биофизики . 41 (1): 103–133. DOI : 10,1146 / annurev-Biophys-050511-102222 . PMID 22224598 . S2CID 25909068 .


![{\ displaystyle L = [T] _ {0} / [R] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cbdf99ea76d9218c4968cba84fdd370e6ccb320)

![{\ Displaystyle \ альфа = [X] / K_ {R}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dfd3d31314605c0a461cd25d07413918b75dee9a)


