| |
| Идентификаторы | |
|---|---|
3D модель ( JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| N 4 O | |
| Молярная масса | 72,027 г · моль -1 |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Нитрозилазид представляет собой высоколабильный оксид азота с химической формулой N 4 O.
Синтез [ править ]
Нитрозилазид можно синтезировать с помощью следующей реакции азида натрия и нитрозилхлорида при низких температурах:
Свойства [ править ]
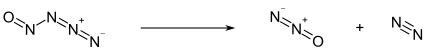
Ниже -50 ° C нитрозилазид существует в виде бледно-желтого твердого вещества. Выше этой температуры он разлагается на закись азота (N 2 O) и молекулярный азот (N 2 ): [1]
Характеристика соединения с помощью ИК- и Рамановской спектроскопии показывает полосы поглощения, которые хорошо согласуются с расчетными значениями для транс-структуры . [1] [2] Квантово-химические расчеты показывают, что энергия цис-формы выше на 4,2 кДж · моль -1, а ароматическая кольцевая форма более устойчива на 205 кДж · моль -1 . Однако циклизация в кольцевую форму должна была бы преодолеть энергетический барьер активации 205 кДж · моль -1, необходимый для изгиба азидной группы, что может объяснить, почему нитрозилазид достаточно стабилен для выделения при низкой температуре. [1]
Ссылки [ править ]
- ^ a b c Шульц, Аксель; Tornieporth-Oetting, Inis C .; Клапётке, Томас М. (1993). «Нитрозилазид, N4O, нестабильный по своей природе оксид азота». Angewandte Chemie International Edition на английском языке . 32 (11): 1610–1612. DOI : 10.1002 / anie.199316101 . ISSN 0570-0833 .
- ^ Люсьен, Гарольд В. (1958). «Получение и свойства нитрозилазида». Журнал Американского химического общества . 80 (17): 4458–4460. DOI : 10.1021 / ja01550a004 . ISSN 0002-7863 .
- Коттон, Ф. Альберт и Джеффри Уилкинсон (1999). Высшая неорганическая химия (6-е изд.). Нью-Йорк: Джон Вили и сыновья. п. 331. ISBN. 0-471-19957-5.