| Немелкоклеточный рак легкого | |
|---|---|
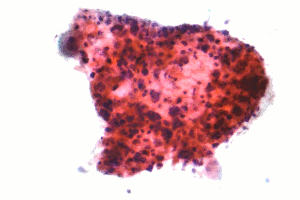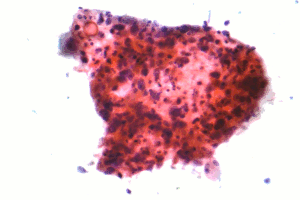 | |
| Микрофотография из плоскоклеточной карциномы , типа карциномы немелкоклеточных-клеток легкого, FNA образца , Pap пятна . | |
| Специальность | Онкология |
Немелкоклеточная карцинома легкого ( NSCLC ) - это любой тип эпителиального рака легкого, кроме мелкоклеточной карциномы легкого (SCLC). На НМРЛ приходится около 85% всех случаев рака легких. [1] [2] Как класс, НМРЛ относительно нечувствительны к химиотерапии по сравнению с мелкоклеточной карциномой. По возможности их в первую очередь лечат хирургической резекцией с лечебной целью, хотя химиотерапия все чаще используется как до операции ( неоадъювантная химиотерапия ), так и после операции ( адъювантная химиотерапия ).
Типы [ править ]

Наиболее распространенными типами НМРЛ являются плоскоклеточная карцинома , крупноклеточная карцинома и аденокарцинома , но несколько других типов встречаются реже. Некоторые из менее распространенных типов - плеоморфная, карциноидная опухоль, карцинома слюнных желез и неклассифицированная карцинома. [4] Все типы могут встречаться в необычных гистологических вариантах и в виде комбинаций смешанных типов клеток. [5] Плоскоклеточный рак занимает почти половину НМРЛ. [ сомнительно ] [ необходима цитата ] В классификации тканей центральный тип содержит около одной девятой. [ необходима цитата ]
Иногда фраза «не указано иное» (БДУ) используется в общем, обычно когда более точный диагноз не может быть поставлен. Чаще всего это происходит, когда патолог исследует небольшое количество злокачественных клеток или тканей в цитологическом или биопсийном образце. [5]
Рак легких у людей, которые никогда не курили, почти всегда является НМРЛ, причем значительным большинством является аденокарцинома. [6]
В относительно редких случаях обнаруживается, что злокачественные опухоли легких содержат компоненты как SCLC, так и NSCLC. В этих случаях опухоли классифицируются как комбинированная мелкоклеточная карцинома легких (c-SCLC) [7] и (обычно) рассматриваются как «чистые» SCLC. [8]
Аденокарцинома легкого [ править ]
Аденокарцинома легких в настоящее время является наиболее распространенным типом рака легких у «никогда не куривших» (некурящих на протяжении всей жизни). [9] Аденокарциномы составляют около 40% случаев рака легких. Исторически сложилось так, что аденокарцинома чаще выявлялась периферически в легких, чем SCLC и плоскоклеточный рак легкого, оба из которых, как правило, чаще располагались в центре. [10] [11] Недавние исследования, однако, предполагают, что «соотношение центральных и периферических поражений» может сходиться к единице как для аденокарциномы, так и для плоскоклеточного рака. [ необходима цитата ]
Плоскоклеточный рак легкого [ править ]
Плоскоклеточный рак легкого чаще встречается у мужчин, чем у женщин. Это тесно связано с историей курения табака , в большей степени, чем с большинством других типов рака легких. Согласно исследованию здоровья медсестер , относительный риск SCC составляет около 5,5, как среди тех, кто ранее курил от 1 до 20 лет, так и среди тех, кто от 20 до 30 лет, по сравнению с «никогда не курившими» (некурящими на протяжении всей жизни). . [12] Относительный риск увеличивается примерно до 16 при предыдущем курении от 30 до 40 лет и примерно до 22 при более чем 40 годах. [12]
Крупноклеточный рак легкого [ править ]
Крупноклеточная карцинома легкого (LCLC) представляет собой гетерогенную группу недифференцированных злокачественных новообразований, происходящих из трансформированных эпителиальных клеток легкого. В прошлом LCLC обычно составляли около 10% всех NSCLC, хотя новые диагностические методы, по-видимому, снижают частоту диагностики «классических» LCLC в пользу более плохо дифференцированных SCC и аденокарцином. [13] LCLC, по сути, является «диагнозом исключения», поскольку опухолевым клеткам недостает световых микроскопических характеристик, которые могли бы классифицировать новообразование как мелкоклеточную карциному, плоскоклеточную карциному, аденокарциному или другой более специфический гистологический тип. рака легких. LCLC отличается от SCLC, прежде всего, большим размером анапластической оболочки.клетки, более высокое соотношение размеров цитоплазмы и ядра и отсутствие хроматина «соль и перец». [ необходима цитата ]
Симптомы [ править ]
Многие симптомы НМРЛ могут быть признаками других заболеваний, но наличие хронических или частично совпадающих симптомов может быть сигналом о наличии заболевания. Некоторые симптомы указывают на менее запущенные случаи заболевания, а некоторые могут сигнализировать о распространении рака. Некоторые из симптомов менее запущенного рака включают хронический кашель, кашель с кровью, охриплость голоса, одышку, хрипы, боль в груди, потерю веса и потерю аппетита. [14] Еще несколько симптомов, связанных с ранним прогрессированием заболевания: слабость, сильная усталость, проблемы с глотанием, отек лица или шеи, а также постоянные или повторяющиеся инфекции, такие как бронхит или пневмония. [4] [14] [15]Признаки более запущенных случаев включают боль в костях, изменения нервной системы (головная боль, слабость, головокружение, проблемы с равновесием, судороги), желтуха, припухлости у поверхности тела, онемение конечностей из-за синдрома Панкоста , а также тошноту, рвоту и т. запор, вызванный гиперкальциемией . [14] [15] Еще несколько симптомов, указывающих на дальнейшее прогрессирование рака, включают одышку, синдром верхней полой вены , проблемы с глотанием, большое количество слизи, слабость, утомляемость и охриплость голоса. [15]
Причина [ править ]
Курение, безусловно, является ведущим фактором риска рака легких. [16] Сигаретный дым содержит более 6000 компонентов, многие из которых приводят к повреждению ДНК [17] (см. Таблицу повреждений ДНК, связанных с табаком, при курении табака ).
Другие причины включают радон , пассивное курение, воздействие таких веществ, как асбест, хром, никель, бериллий, сажа или смола, семейный анамнез рака легких и загрязнение воздуха. [4] [16]
В общем, повреждение ДНК, по-видимому, является основной причиной рака. [18] Хотя большинство повреждений ДНК поддаются восстановлению , [17] оставшиеся невосстановленные повреждения ДНК из-за сигаретного дыма являются вероятной причиной НМРЛ.
Репликация ДНК после непоправленного повреждения может привести к мутации из-за неточного синтеза трансфузии . Кроме того, во время репарации двухцепочечных разрывов ДНК или репарации других повреждений ДНК не полностью очищенные участки репарации могут приводить к эпигенетическому подавлению генов. [19] [20]
Дефицит репарации ДНК при НМРЛ [ править ]
Нарушения репарации ДНК лежат в основе многих форм рака. [21] Если репарация ДНК недостаточна, частота не восстановленных повреждений ДНК увеличивается, и они, как правило, вызывают неточный синтез трансформации, ведущий к мутации. Кроме того, увеличенные повреждения могут усилить неполное восстановление, что приведет к эпигенетическим изменениям. [ необходима цитата ]
Как указано в статье « Канцерогенез» , мутации в генах репарации ДНК иногда возникают при раке, но недостаточность репарации ДНК из-за эпигенетических изменений, которые снижают или заглушают экспрессию генов репарации ДНК, встречаются гораздо чаще при раке. [ необходима цитата ]
Эпигенетическое подавление генов репарации ДНК часто происходит при НМРЛ. По крайней мере девять генов репарации ДНК, которые обычно функционируют в относительно точных путях репарации ДНК, часто репрессируются гиперметилированием промотора при НМРЛ. Один ген репарации ДНК, FEN1 , который функционирует в неправильном пути репарации ДНК, экспрессируется на повышенном уровне из-за гипо-, а не гипер- метилирования его промоторной области (дефицит метилирования промотора) в NSCLC. [ необходима цитата ]
| Ген | Частота гипер- (или гипо-) метилирования | Путь репарации ДНК | Ref. |
|---|---|---|---|
| NEIL1 | 42% | базовая эксцизионная пластика | [22] |
| WRN | 38% | гомологичная рекомбинационная репарация, негомологичное соединение концов , эксцизионная репарация оснований | [23] |
| MGMT | 13% - 64% | прямой разворот | [22] [24] [25] |
| Банкомат | 47% | гомологичная рекомбинационная репарация | [26] |
| MLH1 | 48% - 73% | ремонт несоответствия | [26] [27] |
| MSH2 | 42% - 63% | ремонт несоответствия | [26] [27] |
| BRCA2 | 42% | гомологичная рекомбинационная репарация | [28] |
| BRCA1 | 30% | гомологичная рекомбинационная репарация | [28] |
| XRCC5 ( Ku80 ) | 20% | негомологичное соединение концов | [28] |
| FEN1 | 100% гипометилирован (повышенная экспрессия) | соединение концов, опосредованное микрогомологией | [29] |
Частые недостатки точной репарации ДНК и увеличение неточной репарации, вероятно, вызывают высокий уровень мутаций в клетках рака легких, составляющий более 100 000 мутаций на геном (см. Секвенирование всего генома ).
Постановка [ править ]
Стадия - это формальная процедура определения степени развития рака, определяющая варианты лечения.
Объединенный Американский комитет по раке и Международный союз по борьбе с раком рекомендуют TNM постановку , используя единую схему НМРЛ, МРЛА и бронхолегочные карциноидные опухоли. [30] С помощью TNM рак классифицируется в зависимости от размера опухоли и распространяется на лимфатические узлы и другие органы. По мере того, как опухоль увеличивается в размерах и пораженные области становятся больше, стадия рака также становится более сложной.
Затем несколько компонентов стадирования НМРЛ влияют на стратегию лечения врачей. [31] Сама опухоль легкого обычно оценивается как рентгенологически на предмет общего размера, так и патологом под микроскопом, чтобы определить конкретные генетические маркеры или увидеть, произошло ли вторжение в важные структуры грудной клетки (например, бронх или плевральную полость ). Затем соседние лимфатические узлы пациента в грудной полости, известные как средостение , проверяются на предмет поражения. Наконец, пациента обследуют на предмет наличия более отдаленных участков метастатического поражения, чаще всего с помощью визуализации головного мозга и / или сканирования костей. [32]
Пятилетняя выживаемость [ править ]
Показатели выживаемости на стадиях с I по IV значительно снижаются из-за развития болезни. Для стадии I пятилетняя выживаемость составляет 47%, стадия II - 30%, стадия III - 10% и стадия IV - 1%. [33]
Лечение [ править ]
Часто используется более одного вида лечения, в зависимости от стадии рака, общего состояния здоровья человека, возраста, реакции на химиотерапию и других факторов, таких как вероятные побочные эффекты лечения. После полной стадийности пациента с НМРЛ обычно можно разделить на одну из трех различных категорий: пациенты с ранним неметастатическим заболеванием (стадии I и II и отдельные опухоли типа III), пациенты с местнораспространенным заболеванием, ограниченным грудной полостью (например, большие опухоли, опухоли с участием критических структур грудной клетки или пациенты с положительными лимфатическими узлами средостения) или пациенты с отдаленными метастазами за пределами грудной полости.
Ранний / неметастатический НМРЛ [ править ]
НМРЛ обычно не очень чувствительны к химиотерапии [34] и / или облучению, поэтому хирургическое вмешательство ( резекция легкого для удаления опухоли) остается лечением выбора, если у пациентов диагностирован диагноз на ранней стадии. [35]
Если у людей есть небольшая, но неоперабельная опухоль, они могут пройти целенаправленную высокоинтенсивную лучевую терапию . Новые методы лучевой терапии позволяют врачам точнее лечить рак легких. Это означает, что меньше радиации влияет на близлежащие здоровые ткани. Новые методы включают кибернож и стереотаксическую лучевую терапию тела . Некоторые люди, относящиеся к группе повышенного риска, также могут получать адъювантную (вспомогательную) химиотерапию после первоначальной операции или лучевой терапии. Можно выбрать ряд возможных химиотерапевтических агентов, но большинство из них включают химиотерапевтический препарат на основе платины, называемый цисплатином .
Другие методы лечения включают чрескожную абляцию и химиоэмболизацию . [36] Наиболее широко используемыми методами абляции при раке легких являются радиочастотная абляция (РЧА), криоабляция и микроволновая абляция . [37] Абляция может быть вариантом для пациентов, опухоли которых расположены вблизи внешнего края легких. Узлы менее 1 см от трахеи, главных бронхов, пищевода и центральных сосудов следует исключить из РЧА из-за высокого риска осложнений и частой неполной абляции. Кроме того, следует исключить поражения более 5 см, а поражения 3-5 см следует рассматривать с осторожностью, учитывая высокий риск рецидива. [38]Как минимально инвазивная процедура, она может быть более безопасной альтернативой для пациентов, которые не подходят для операции из-за сопутствующих заболеваний или ограниченной функции легких. Исследование, сравнивающее термическую абляцию с субдолевой резекцией в качестве лечения ранней стадии НМРЛ у пожилых людей, не обнаружило разницы в общей выживаемости пациентов. [39] Возможно, что РЧА с последующей лучевой терапией имеет преимущество в выживаемости из-за синергизма двух механизмов разрушения клеток. [40]
Расширенный / метастатический НМРЛ [ править ]
Подход к лечению людей с запущенным НМРЛ в первую очередь направлен на облегчение боли и стресса (паллиативное лечение), но существует множество вариантов химиотерапии. [41] [42] [ требуется обновление ] Эти агенты включают как традиционные химиотерапевтические препараты, такие как цисплатин, которые без разбора нацелены на все быстро делящиеся клетки, так и новые целевые агенты, которые больше приспособлены к конкретным генетическим аберрациям, обнаруженным в опухоли человека. При выборе подходящего подхода к химиотерапии следует учитывать профиль токсичности (побочные эффекты препарата) и уравновешивать его с сопутствующими заболеваниями человека (другими состояниями или побочными эффектами, которые испытывает человек). [42] Карбоплатинпредставляет собой химиотерапевтическое средство, которое оказывает аналогичное влияние на выживаемость человека по сравнению с цисплатином и имеет профиль токсичности, отличный от цисплатина. [42]
В настоящее время в опухолях НМРЛ обычно формируются два генетических маркера, которые определяют дальнейшее лечение - мутации в эпидермальном факторе роста (EGFR) и киназе анапластической лимфомы . [43] Кроме того, известно, что ряд дополнительных генетических маркеров мутировали в пределах NSCLC и могут повлиять на лечение в будущем, включая BRAF , HER2 / neu и KRAS . Для распространенного НМРЛ комбинированный подход к лечению химиотерапией, включающий цетуксимаб , антитело, нацеленное на сигнальный путь EGFR, более эффективен для улучшения общей выживаемости человека по сравнению с одной стандартной химиотерапией. [44]
Термическая абляция, то есть РЧА, криоабляция и микроволновая абляция, подходят для паллиативного лечения связанных с опухолью симптомов или рецидивов в областях лечения. Людей с тяжелым фиброзом легких и тяжелой эмфиземой с ожидаемой продолжительностью жизни менее года следует считать плохими кандидатами для этого лечения. [45]
Мутации EGFR [ править ]
Примерно 10–35% людей с НМРЛ будут иметь лекарственные сенсибилизирующие мутации EGFR. [43] Было обнаружено, что распределение этих мутаций зависит от расы, при этом в одном исследовании было установлено, что такие опухолевые маркеры будут иметь 10% европеоидов, но 50% азиатов. [46] Был обнаружен ряд различных мутаций EGFR, но определенные аберрации приводят к гиперактивным формам белка. Люди с этими мутациями с большей вероятностью будут иметь гистологию аденокарциномы и будут некурящими или заядлыми курильщиками. Эти люди , как были показаны быть чувствительными к некоторым лекарственным препаратам , которые блокируют белка , известные как EGFR тирозин киназы ингибиторов конкретно, эрлотиниб , гефитиниб , afatinib, или осимертиниб . [47] Надежная идентификация мутаций при раке легких требует тщательного рассмотрения из-за различной чувствительности диагностических методов. [48]
Перестройки гена ALK [ править ]
До 7% пациентов с НМРЛ имеют транслокации EML4-ALK или мутации в гене ROS1 ; этим пациентам могут быть полезны ингибиторы ALK , которые в настоящее время одобрены для этой группы пациентов. [49] Кризотиниб , получивший одобрение FDA в августе 2011 года, является ингибитором нескольких киназ, в частности ALK, ROS1 и MET . Клинические исследования показали, что эффективность кризотиниба составляет около 60%, если у пациентов выявлено ALK-положительное заболевание. [35] Несколько исследований также показали, что мутации ALK и мутации, активирующие EGFR, обычно исключают друг друга. Таким образом, пациентам, у которых кризотиниб неэффективен, не рекомендуется переводить на препараты, нацеленные на EGFR, такие какэрлотиниб . [35]
Другие варианты лечения [ править ]
Пациенты с НМРЛ с запущенным заболеванием, у которых не обнаружено мутаций EGFR или ALK, могут получать бевацизумаб , который представляет собой лекарство с моноклональными антителами, направленным против фактора роста эндотелия сосудов (VEGF). Это основано на исследовании Восточной совместной онкологической группы, которое показало, что добавление бевацизумаба к химиотерапии карбоплатином и паклитакселом для некоторых пациентов с рецидивирующим или распространенным НМРЛ (стадия IIIB или IV) может увеличить как общую выживаемость, так и выживаемость без прогрессирования. [50]
Клетки NSCLC, экспрессирующие лиганд запрограммированной смерти 1 (PD-L1), могут взаимодействовать с рецептором запрограммированной смерти 1 (PD-1), экспрессируемым на поверхности Т-клеток, и приводить к уменьшению уничтожения опухолевых клеток иммунной системой. Атезолизумаб представляет собой моноклональное антитело против PD-L1. Ниволумаб и пембролизумаб представляют собой моноклональные антитела против PD-1. Ипилимумаб представляет собой моноклональное антитело, которое нацелено на цитотоксический Т-лимфоцит-ассоциированный белок 4 (CTLA-4) на поверхности Т-клеток. Бевацизумаб представляет собой моноклональное антитело, которое нацелено на фактор роста эндотелия сосудов (VEGF) в кровотоке и действует как ингибитор ангиогенеза. Были опубликованы многочисленные клинические испытания фазы 3 с использованием иммунотерапии в первой линии для лечения НМРЛ, включая пембролизумаб в KEYNOTE-024, KEYNOTE-042, KEYNOTE-189 и KEYNOTE-407;Ниволумаб и ипилимумаб в CHECKMATE-227 и CHECKMATE 9LA; и атезолизумаб в IMpower110, IMpower130 и IMpower150.[51]
В 2015 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило анти-PD-1 средство ниволумаб для лечения прогрессирующего или метастатического SCC.
2 октября 2015 г. FDA одобрило пембролизумаб для лечения метастатического НМРЛ у пациентов, в опухолях которых экспрессируется PD-L1, и которые не прошли лечение другими химиотерапевтическими агентами.
Октябрь 2016 г., пембролизумаб стал первой иммунотерапией, которая использовалась в качестве первой линии в лечении НМРЛ, если рак сверхэкспрессирует PDL1 и рак не имеет мутаций в EGFR или ALK ; если химиотерапия уже проводилась, то пембролизумаб можно использовать в качестве лечения второй линии, но если рак имеет мутации EGFR или ALK, сначала следует использовать агенты, направленные на эти мутации. Оценка PDL1 должна проводиться с помощью проверенной и одобренной сопутствующей диагностики .
Прогноз для пациентов с немелкоклеточным раком легкого значительно улучшился в последние годы с введением иммунотерапии. [51] Пациенты с опухолевым PDL-1, экспрессирующим более половины или более опухолевых клеток, достигли средней общей выживаемости 30 месяцев с пембролизумабом. [52] [53] Были опубликованы многочисленные исследования фазы 3, обеспечивающие иммунотерапию первой линии для пациентов с немелкоклеточным раком легкого. [51]
Ссылки [ править ]
- ^ Немелкоклеточный рак легкого в eMedicine
- ^ "Что такое немелкоклеточный рак легкого?" . www.cancer.org .
- ^ Курильщиками считаются нынешние или бывшие курильщики со стажем более 1 года. См. Страницу изображений в Commons, где указаны проценты в цифрах. Ссылка: Таблица 2 в: Kenfield SA, Wei EK, Stampfer MJ, Rosner BA, Colditz GA (июнь 2008 г.). «Сравнение аспектов курения среди четырех гистологических типов рака легких» . Контроль над табаком . 17 (3): 198–204. DOI : 10.1136 / tc.2007.022582 . PMC 3044470 . PMID 18390646 .
- ^ a b c «Лечение немелкоклеточного рака легких» . Национальный институт рака . 1 января 1980 . Проверено 4 декабря 2017 года .
- ^ a b «Лечение немелкоклеточного рака легкого - Национальный институт рака» . 1 января 1980 . Проверено 19 октября 2008 года .
- Перейти ↑ Hanna N (2007). «Рак легких у никогда не курильщиков» . Гематология-онкология . Medscape.
- ^ Трэвис У.Д., Брамбилла Э, Мюллер-Хермелинк HK и др., Ред. (2004). Патология и генетика опухолей легкого, плевры, тимуса и сердца (PDF) . Классификация опухолей Всемирной организации здравоохранения. Лион: IARC Press. ISBN 978-92-832-2418-1. Архивировано из оригинального (PDF) 23 августа 2009 года . Проверено 27 марта 2010 года .
- ^ Simon GR, Turrisi A (сентябрь 2007). «Управление мелкоклеточным раком легкого: клинические рекомендации ACCP, основанные на доказательствах (2-е издание)» . Сундук . 132 (3 приложения): 324S – 339S. DOI : 10.1378 / chest.07-1385 . PMID 17873178 . Архивировано из оригинального 12 января 2013 года .
- ^ Субраманян J, Говиндан R (февраль 2007). «Рак легких у никогда не куривших: обзор». Журнал клинической онкологии . 25 (5): 561–70. DOI : 10.1200 / JCO.2006.06.8015 . PMID 17290066 .
- Перейти ↑ Mitchell RS, Kumar V, Abbas AK, Fausto N (2007). «морфология аденокарциномы». Базовая патология Роббинса (8-е изд.). Филадельфия: Сондерс. ISBN 978-1-4160-2973-1.[ требуется страница ]
- ^ Travis WD, Travis LB, Девеса SS (январь 1995). "Рак легких". Рак . 75 (1 приложение): 191–202. DOI : 10.1002 / 1097-0142 (19950101) 75: 1+ <191 :: АИД-CNCR2820751307> 3.0.CO; 2-Y . PMID 8000996 .
- ^ a b Kenfield SA, Wei EK, Stampfer MJ, Rosner BA, Colditz GA (июнь 2008 г.). «Сравнение аспектов курения среди четырех гистологических типов рака легких» . Контроль над табаком . 17 (3): 198–204. DOI : 10.1136 / tc.2007.022582 . PMC 3044470 . PMID 18390646 .
- ^ Поппер HH (2011). «Крупноклеточный рак легкого - исчезающая сущность?». Памятка - журнал европейской медицинской онкологии . 4 : 4–9. DOI : 10.1007 / s12254-011-0245-8 . S2CID 71238993 .
- ^ a b c «Признаки и симптомы немелкоклеточного рака легких» . www.cancer.org . Проверено 4 декабря 2017 года .
- ^ a b c «Немелкоклеточный рак легкого» . Медицинский центр Университета Мэриленда . Проверено 4 декабря 2017 года .
- ^ a b «Факторы риска немелкоклеточного рака легких» . www.cancer.org .
- ^ а б Лю Х, Коннер Х, Кобаяши Т., Ким Х, Вен Ф, Абэ С. и др. (Август 2005 г.). «Экстракт сигаретного дыма вызывает повреждение ДНК, но не апоптоз в эпителиальных клетках бронхов человека». Американский журнал респираторной клетки и молекулярной биологии . 33 (2): 121–9. DOI : 10,1165 / rcmb.2003-0341OC . PMID 15845867 .
- ^ Kastan MB (апрель 2008). «Реакции на повреждение ДНК: механизмы и роли в человеческих болезнях: Лекция 2007 ГСГ Мемориала Клоуза» . Молекулярные исследования рака . 6 (4): 517–24. DOI : 10.1158 / 1541-7786.MCR-08-0020 . PMID 18403632 .
- ^ О'Хаган HM, Mohammad HP, Baylin SB (август 2008). Ли JT (ред.). «Двухцепочечные разрывы могут инициировать сайленсинг генов и SIRT1-зависимое начало метилирования ДНК в экзогенном промоторном островке CpG» . PLOS Genetics . 4 (8): e1000155. DOI : 10.1371 / journal.pgen.1000155 . PMC 2491723 . PMID 18704159 .
- ^ Куоззо С, Porcellini А, Angrisano Т, Морано А, Ли В, Ди Пардо А, и др. (Июль 2007 г.). «Повреждение ДНК, гомологически направленная репарация и метилирование ДНК» . PLOS Genetics . 3 (7): e110. DOI : 10.1371 / journal.pgen.0030110 . PMC 1913100 . PMID 17616978 .
- ^ Harper JW, Elledge SJ (декабрь 2007). «Реакция на повреждение ДНК: десять лет спустя». Молекулярная клетка . 28 (5): 739–45. DOI : 10.1016 / j.molcel.2007.11.015 . PMID 18082599 .
- ^ а б До Х, Вонг NC, Мурон С., Джон Т., Соломон Б., Митчелл П.Л., Добрович А. (февраль 2014 г.). «Критическая переоценка метилирования промотора гена репарации ДНК в немелкоклеточной карциноме легкого» . Научные отчеты . 4 : 4186. Bibcode : 2014NatSR ... 4E4186D . DOI : 10.1038 / srep04186 . PMC 3935198 . PMID 24569633 .
- ^ Agrelo R, Ченг WH, Setien F, Ропер S, Эспада Дж, Фраг М.Ф. и др. (Июнь 2006 г.). «Эпигенетическая инактивация гена синдрома Вернера преждевременного старения при раке человека» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (23): 8822–7. Bibcode : 2006PNAS..103.8822A . DOI : 10.1073 / pnas.0600645103 . PMC 1466544 . PMID 16723399 .
- ^ Wolf P, Ху YC, Doffek K, Sidransky D, Ahrendt SA (ноябрь 2001). «Гиперметилирование промотора O (6) -метилгуанин-ДНК-метилтрансферазы сдвигает спектр мутаций р53 при немелкоклеточном раке легкого». Исследования рака . 61 (22): 8113–7. PMID 11719438 .
- ^ Эким М, Джанер В, Büyükpınarbaşılı Н, Tepeli Е, Элмас л, Багчи G (май 2011). «Определение метилирования промотора O⁶-метилгуанин ДНК-метилтрансферазы при немелкоклеточном раке легкого». Генетическое тестирование и молекулярные биомаркеры . 15 (5): 357–60. DOI : 10,1089 / gtmb.2010.0211 . PMID 21288129 .
- ^ а б в Сафар А.М., Спенсер Х., Су Х, Коффи М., Куни К.А., Ратнасингхе Л.Д. и др. (Июнь 2005 г.). «Профилирование метилирования заархивированного немелкоклеточного рака легкого: многообещающая прогностическая система» . Клинические исследования рака . 11 (12): 4400–5. DOI : 10.1158 / 1078-0432.CCR-04-2378 . PMID 15958624 .
- ^ а б Гомес А., Рейс-Сильва М., Аларкао А., Коусейро П., Соуза В., Карвалью Л. (2014). «Промотор гиперметилирования генов репарации ДНК MLH1 и MSH2 в аденокарциномах и плоскоклеточных карциномах легких» . Revista Portuguesa de Pneumologia . 20 (1): 20–30. DOI : 10.1016 / j.rppneu.2013.07.003 . PMID 24360395 .
- ^ a b c Ли MN, Tseng RC, Hsu HS, Chen JY, Tzao C, Ho WL, Wang YC (февраль 2007 г.). «Эпигенетическая инактивация генов контроля хромосомной стабильности BRCA1, BRCA2 и XRCC5 при немелкоклеточном раке легкого» . Клинические исследования рака . 13 (3): 832–8. DOI : 10.1158 / 1078-0432.CCR-05-2694 . PMID 17289874 .
- Перейти ↑ Nikolova T, Christmann M, Kaina B (июль 2009 г.). «FEN1 сверхэкспрессируется в опухолях яичек, легких и головного мозга». Противораковые исследования . 29 (7): 2453–9. PMID 19596913 .
- ^ «Плакаты с постановкой рака: легкое» (PDF) . Стадия рака AJCC (7-е изд.). 2009. Архивировано из оригинального (PDF) 28 сентября 2011 года.
- ^ "Лечение немелкоклеточного рака легкого Национального института рака (PDQ®)" . 1 января 1980 . Дата обращения 12 мая 2015 .
- ^ Чавла М, Kumar R, S Agarwala, бахши S, Гупта DK, Малхотра A (октябрь 2010). «Роль позитронно-эмиссионной томографии-компьютерной томографии в определении стадии и ранней оценке ответа на химиотерапию у детей с нейробластомой» . Индийский журнал ядерной медицины . 25 (4): 147–55. DOI : 10,4103 / 0972-3919.78249 (неактивный 17 января 2021). PMC 3109821 . PMID 21713223 . CS1 maint: DOI неактивен с января 2021 г. ( ссылка )
- ^ "Показатели выживаемости при немелкоклеточном раке легких, по стадиям" . www.cancer.org . Проверено 4 декабря 2017 года .
- ^ Cotran RS, Кумар V, Фаусто N, Роббинс SL, Аббас АК (2005). Патологические основы болезни Роббинса и Котрана . Сент-Луис, штат Миссури: Эльзевьер Сондерс. п. 759. ISBN. 978-0-7216-0187-8.
- ^ a b c «NCCN Clinical Practice Guidelines for NSCLC» (PDF) . Дата обращения 12 мая 2015 .
- ^ «Химиоэмболизация» . Cancer Research UK. 30 августа 2017. Архивировано из оригинала 9 октября 2007 года.
- Перейти ↑ Dupuy DE, Shulman M (сентябрь 2010 г.). «Современное состояние методов термической абляции злокачественных новообразований легких» . Семинары по интервенционной радиологии . 27 (3): 268–75. DOI : 10,1055 / с-0030-1261785 . PMC 3324195 . PMID 22550366 .
- ^ Bargellini I, Bozzi E, Cioni R, Parentini B, C Bartolozzi (октябрь 2011). «Радиочастотная абляция опухолей легких» . Взгляд на визуализацию . 2 (5): 567–576. DOI : 10.1007 / s13244-011-0110-7 . PMC 3259330 . PMID 22347976 .
- ^ Kwan SW, Mortell KE, Talenfeld AD, Brunner MC (январь 2014). «Термическая абляция соответствует результатам субдолевой резекции у пожилых пациентов с немелкоклеточным раком легкого на ранней стадии». Журнал сосудистой и интервенционной радиологии . 25 (1): 1–9.e1. DOI : 10.1016 / j.jvir.2013.10.018 . PMID 24365502 .
- ^ Грико CA, Саймон CJ, Mayo-Smith WW, DiPetrillo TA, Ready NE, Дюпюи DE (июль 2006). «Чрескожная термоабляция под визуальным контролем и лучевая терапия: результаты комбинированного лечения 41 пациента с неоперабельным немелкоклеточным раком легкого I / II стадии». Журнал сосудистой и интервенционной радиологии . 17 (7): 1117–24. DOI : 10.1097 / 01.RVI.0000228373.58498.6E . PMID 16868164 .
- ^ "Рак легкого онлайн" . lightcanceronline.org . Архивировано из оригинала 17 июня 2008 года . Проверено 13 декабря 2008 года .
- ^ Б с де Castria ТБ, да Силва Е.М., Gois А.Ф., Риера R (август 2013 г. ). «Цисплатин против карбоплатина в комбинации с препаратами третьего поколения для лечения запущенного немелкоклеточного рака легкого». Кокрановская база данных систематических обзоров (8): CD009256. DOI : 10.1002 / 14651858.CD009256.pub2 . PMID 23949842 .
- ^ a b «Молекулярное профилирование рака легких» . Дата обращения 12 мая 2015 .
- ^ Ян Зи, Ль L, Мао С, В XY, Хуанг Ю.Ф., Х XF, Тан ДЛ (ноябрь 2014). «Химиотерапия цетуксимабом по сравнению с химиотерапией только при не полученном химиотерапии прогрессирующем немелкоклеточном раке легкого». Кокрановская база данных систематических обзоров (11): CD009948. DOI : 10.1002 / 14651858.CD009948.pub2 . PMID 25400254 .
- Перейти ↑ Dupuy DE, Shulman M (сентябрь 2010 г.). «Современное состояние методов термической абляции злокачественных новообразований легких» . Семинары по интервенционной радиологии . 27 (3): 268–75. DOI : 10,1055 / с-0030-1261785 . PMC 3324195 . PMID 22550366 .
- ^ Hirsch FR, Bunn PA (май 2009). «Тестирование EGFR при раке легких готово к прайм-тайм». Ланцет. Онкология . 10 (5): 432–3. DOI : 10.1016 / s1470-2045 (09) 70110-X . PMID 19410185 .
- Перейти ↑ Kris MG (октябрь 2005 г.). «Как сегодняшние разработки в лечении немелкоклеточного рака легких изменят завтрашние стандарты лечения» . Онколог . 10 Дополнение 2 (Дополнение 2): 23–9. DOI : 10.1634 / теонколог.10-90002-23 . PMID 16272456 . Архивировано из оригинального 22 августа 2009 года.
- ^ Шервуда Дж, Дирден S, Ратклифф М, Уокер J (сентябрь 2015). «Соответствие статуса мутации между первичными поражениями и метастатическими участками распространенного немелкоклеточного рака легкого и влияние методологий тестирования мутаций: обзор литературы» . Журнал экспериментальных и клинических исследований рака . 34 (1): 92. DOI : 10,1186 / s13046-015-0207-9 . PMC 4559261 . PMID 26338018 .
- ^ Фермер (2010). «Стандарты лечения немелкоклеточного рака легких, оспариваемые изобилием новых лекарств» .
- ^ Сандлер А., Грей Р., Перри М.С., Брамер Дж., Шиллер Дж. Х., Даулати А. и др. (Декабрь 2006 г.). «Паклитаксел-карбоплатин отдельно или с бевацизумабом для лечения немелкоклеточного рака легкого». Медицинский журнал Новой Англии . 355 (24): 2542–50. DOI : 10.1056 / nejmoa061884 . PMID 17167137 .
- ^ a b c d e Насер, Никола Дж .; Горенберг, Мигель; Агбаря, Абед (2020). «Первая линия иммунотерапии немелкоклеточного рака легких» . Фармацевтика . 13 (11): 373. DOI : 10,3390 / ph13110373 . PMC 7695295 . PMID 33171686 . Текст был скопирован из этого источника, доступного по международной лицензии Creative Commons Attribution 4.0 .
- ↑ Рек М, Родригес-Абреу Д., Робинсон А.Г., Хуэй Р., Чёси Т., Фюлоп А. и др. (Ноябрь 2016 г.). «Пембролизумаб против химиотерапии для PD-L1-положительного немелкоклеточного рака легкого» . Медицинский журнал Новой Англии . 375 (19): 1823–1833. DOI : 10.1056 / NEJMoa1606774 . PMID 27718847 .
- ↑ Рек М, Родригес-Абреу Д., Робинсон А.Г., Хуэй Р., Чёси Т., Фюлоп А. и др. (Март 2019 г.). «Обновленный анализ KEYNOTE-024: пембролизумаб по сравнению с химиотерапией на основе платины для позднего немелкоклеточного рака легкого с долей опухоли PD-L1 50% или выше» . Журнал клинической онкологии . 37 (7): 537–546. DOI : 10.1200 / JCO.18.00149 . PMID 30620668 .
Внешние ссылки [ править ]
| Классификация | D
|
|---|---|
| Внешние ресурсы |
|
- Энциклопедия MedlinePlus : немелкоклеточный рак легкого