В химии ортосиликат - это анион SiO.4-
4или любые его соли и сложные эфиры . Это один из силикатных анионов. Иногда его называют анионом или группой тетроксида кремния . [1]
Ортосиликатные соли, такие как ортосиликат натрия , стабильны и широко встречаются в природе в виде силикатных минералов , что является определяющим признаком несиликатов . [2] Оливин , ортосиликат магния или железа (II), является наиболее распространенным минералом в верхней мантии .
Ортосиликатный анион представляет собой сильное основание , сопряженное основание чрезвычайно слабой ортокремниевой кислоты H
4SiO
4(p K a2 = 13,2 при 25 ° C). Это равновесие трудно изучить, поскольку кислота имеет тенденцию разлагаться на конденсат гидратированного кремнезема . [3]
Структура [ править ]
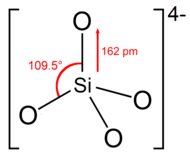
Ортосиликатный ион или группа имеют тетраэдрическую форму с одним атомом кремния, окруженным четырьмя атомами кислорода.
В анионе каждый кислород несет единичный отрицательный заряд. [4] Длина связи Si – O составляет 162 пм. [5]
В органических соединениях, таких как тетраметилортосиликат , каждый кислород формально нейтрален и связан с остальной частью молекулы одной ковалентной связью .
Использует [ редактировать ]
Европий легированного барий ортосиликат (Ba 2 SiO 4 ) является общим люминофором используется в зеленых светоизлучающих диодах (СИД). Люминофор для синих светодиодов может быть изготовлен из ортосиликата бария, легированного стронцием . [6] Барий ортосиликат является основной причиной отравления катода в вакуумных трубках . [7]
Органическая химия [ править ]
Хотя ортосиликатный ион очень важен в неорганической химии и геохимии, он редко встречается в органической химии. Однако в органическом синтезе используются два силикатных соединения : тетраэтилортосиликат или ТЭОС используется для связывания полимеров и особенно важен при производстве аэрогелей. Тетраметилортосиликат или TMOS используется в качестве альтернативы TEOS, а также имеет ряд других применений в качестве реагента. TEOS предпочтительнее TMOS, поскольку TMOS разлагается с образованием высоких концентраций токсичного метанола . Вдыхание TMOS может привести к токсическому накоплению кремнезема в легких.
Ссылки [ править ]
- ^ CA Kumins и AE Gessler (1953), "Короткоцикловые синтезы ультрамаринового синего". Промышленная и инженерная химия , том 45, выпуск 3, страницы 567–572. DOI : 10.1021 / ie50519a031
- ^ Университет Западного Орегона
- ^ Jurkič, Лела Munjas; Чепанец, Ивица; Павелич, Сандра Кралевич; Павелич, Крешимир (2013). «Биологические и терапевтические эффекты ортокремниевой кислоты и некоторых соединений, выделяющих орто-кремниевую кислоту: новые перспективы терапии» . Питание и обмен веществ . 10 (1): 2. DOI : 10,1186 / 1743-7075-10-2 . ISSN 1743-7075 . PMC 3546016 .
- ^ Баларам Саху; Наяк Нимая Чаран; Самантарай Асутош; Пуджапанда Прафулла Кумар. Неорганическая химия . PHI Learning Pvt. ООО п. 306. ISBN. 978-81-203-4308-5.
- ^ Орасио Э. Бергна; Уильям О. Робертс (19 декабря 2005 г.). Коллоидный кремнезем: основы и приложения . CRC Press. п. 10. ISBN 978-1-4200-2870-6.
- ^ Huayna Cerqueira Streit, Jennifer Kramer, Markus Suta, Claudia Wickleder, "Красная, зеленая и синяя фотолюминесценция нанофосфоров Ba₂SiO 4 : M (M = Eu 3+ , Eu 2+ , Sr 2+ )" , Материалы (Базель) , т. 6, вып. 8, pp. 3079–3093, 24 июля 2013 г. doi : 10.3390 / ma6083079 .
- ^ Джонс, Морган (инженер-электронщик) (2011). Клапанные усилители (4-е изд.). Оксфорд: Newnes. п. 301. ISBN. 978-0-08-096640-3. OCLC 760157359 .