| |||
| Имена | |||
|---|---|---|---|
| Произношение | / М ɛ & thetas ; ə п ɒ л / | ||
| Предпочтительное название IUPAC Метанол [1] | |||
| Другие имена Карбинол Columbian духи Hydroxymethane МеОН Метиловый спирт Гидроксид Метил Methylic спирта метилоловых метиленовый гидрата Pyroligneous спирт древесный спирт Вуд нафты Вуд дух | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| 3DMet | |||
| 1098229 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.599 | ||
| Номер ЕС |
| ||
| 449 | |||
| КЕГГ | |||
| MeSH | Метанол | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1230 | ||
Панель управления CompTox ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| CH 3ОН или СН 4О | |||
| Молярная масса | 32,04 г моль -1 | ||
| Внешность | Бесцветная жидкость | ||
| Запах | Сладкий и острый | ||
| Плотность | 0,792 г / см 3 [2] | ||
| Температура плавления | -97,6 ° С (-143,7 ° F, 175,6 К) | ||
| Точка кипения | 64,7 ° С (148,5 ° F, 337,8 К) | ||
Растворимость в воде | смешивающийся | ||
| журнал P | -0,69 | ||
| Давление газа | 13,02 кПа (при 20 ° C) | ||
| Кислотность (p K a ) | 15.5 [3] | ||
| Конъюгированная кислота | Метилоксоний [4] | ||
| Основание конъюгата | Метанолат [5] | ||
Магнитная восприимчивость (χ) | −21,40 · 10 −6 см 3 / моль | ||
Показатель преломления ( n D ) | 1,33141 [6] | ||
| Вязкость | 0,545 мПа · с (при 25 ° C) [7] | ||
Дипольный момент | 1,69 Д | ||
| Опасности [12] [13] | |||
| Основные опасности | Метанол и его пары легко воспламеняются. Умеренно токсичен для мелких животных - Высоко токсичен для крупных животных и людей - Может быть смертельным / смертельным или вызывать слепоту и повреждение печени , почек и сердца при проглатывании - Токсические эффекты от многократного чрезмерного воздействия имеют кумулятивный эффект на центральную нервную систему , особенно зрительный нерв - Симптомы могут проявляться позже, становиться серьезными через 12–18 часов и сохраняться в течение нескольких дней после воздействия [9] | ||
| Паспорт безопасности | См. Страницу данных [1] | ||
| Пиктограммы GHS | [8] | ||
| Сигнальное слово GHS | Опасность [8] | ||
Положения об опасности GHS | H225 , H301 , H311 , H331 , H370 [8] | ||
Меры предосторожности GHS | Р210 , Р233 , Р240 , Р241 , P242 , P243 , P260 , P264 , P270 , P271 , P280 , P301 + 330 + 331 , Р310 , Р302 + 352 , P312 , P303 + 361 + 353 , Р304 + 340 , P311 , P305 + 351 + 338 , P307 + 311 , P337 + 313 , P361 , P363 , P370 + 378 , P403 + 233 [8] | ||
| NFPA 704 (огненный алмаз) | [12] [14]  1 3 0 | ||
| точка возгорания | От 11 до 12 ° C (от 52 до 54 ° F, от 284 до 285 K) | ||
самовоспламенения температуру | 470 ° С (878 ° F, 743 К) [15] 385 ° С (725 ° F, 658 К) [16] | ||
| Пределы взрываемости | 6–36% [10] | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD 50 ( средняя доза ) | 5628 мг / кг (крыса, перорально) 7300 мг / кг (мышь, перорально) 12880 мг / кг (крыса, перорально) 14200 мг / кг (кролик, перорально) [11] | ||
ЛК 50 ( средняя концентрация ) | 64000 частей на миллион (крыса, 4 ч) [11] | ||
LC Lo ( самый низкий опубликованный ) | 33 082 частей на миллион (кошка, 6 часов) 37 594 частей на миллион (мышь, 2 часа) [11] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 200 частей на миллион (260 мг / м 3 ) [10] | ||
REL (рекомендуется) | TWA 200 частей на миллион (260 мг / м 3 ) ST 250 частей на миллион (325 мг / м 3 ) [кожа] [10] | ||
IDLH (Непосредственная опасность) | 6000 частей на миллион [10] | ||
| Родственные соединения | |||
Родственные соединения | Метантиол Силанол Этанол | ||
| Страница дополнительных данных | |||
Структура и свойства | Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т. Д. | ||
Термодинамические данные | Фазовое поведение твердое тело – жидкость – газ | ||
Спектральные данные | УФ , ИК , ЯМР , МС | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
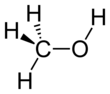
Метанол , также известный как метиловый спирт среди других названий, представляет собой химическое вещество с формулой C H 3 O H ( метильная группа, связанная с гидроксильной группой , часто сокращенно MeOH). Это легкая, летучая , бесцветная, легковоспламеняющаяся жидкость с характерным алкогольным запахом, похожим на запах этанола . [17] полярный растворитель, метанол приобрел название древесного спирта , потому что он был когда - то производится , главным образом, деструктивной перегонки из древесины. На сегодняшний день, метанол получают главным образом в промышленности путем гидрирования из окиси углерода . [18]
Метанол состоит из метильной группы, связанной с полярной гидроксильной группой. Поскольку ежегодно производится более 20 миллионов тонн, он используется в качестве прекурсора для других товарных химикатов , включая формальдегид , уксусную кислоту , метил-трет-бутиловый эфир , метилбензоат, анизол, пероксикислоты, а также множество более специализированных химикатов. [18]
Происшествие [ править ]
Небольшие количества метанола присутствуют у нормальных здоровых людей. Одно исследование показало, что средний показатель выдыхаемого воздуха у испытуемых составляет 4,5 промилле . [19] Среднее эндогенное содержание метанола у людей 0,45 г / день может метаболизироваться из пектина, содержащегося во фруктах; из одного килограмма яблока получается до 1,4 г метанола. [20]
Метанол вырабатывается анаэробными бактериями и фитопланктоном . [21] [22]
Межзвездная среда [ править ]
Метанол также содержится в больших количествах в областях звездообразования в космосе и используется в астрономии в качестве маркера для таких регионов. Он обнаруживается по его спектральным эмиссионным линиям. [23]
В 2006 году астрономы с помощью радиотелескопов MERLIN в обсерватории Джодрелл-Бэнк обнаружили в космосе большое облако метанола, диаметром 288 миллиардов миль (463 миллиарда км). [24] [25] В 2016 году с помощью радиотелескопа ALMA астрономы обнаружили метанол в планетообразующем диске вокруг молодой звезды TW Hydrae . [26]
Токсичность [ править ]
Употребление всего 10 мл чистого метанола может вызвать необратимую слепоту из-за разрушения зрительного нерва . 30 мл (1,0 жидких унций США) потенциально смертельны. [27] Средняя летальная доза составляет 100 мл (3,4 жидких унций США), то есть 1-2 мл / кг массы тела чистого метанола. [28] референсная доза для метанола составляет 0,5 мг / кг в день. [29] [30] Токсические эффекты начинаются через несколько часов после приема внутрь, и антидоты часто могут предотвратить необратимое повреждение. [27] Из-за его сходства как по внешнему виду, так и по запаху с этанолом (спирт в напитках), их трудно различить; так же обстоит дело и сденатурированный спирт , фальсифицированные спиртные напитки или алкогольные напитки очень низкого качества.
Метанол токсичен по двум причинам. Во-первых, метанол может быть фатальным из-за воздействия на центральную нервную систему, действуя как депрессант центральной нервной системы так же, как отравление этанолом . Во-вторых, в процессе отравления он метаболизируется до муравьиной кислоты (которая присутствует в виде формиат-иона) через формальдегид в процессе, инициированном ферментом алкогольдегидрогеназой в печени . [31] Метанол превращается в формальдегид с помощью алкогольдегидрогеназы (ADH), а формальдегид превращается в муравьиную кислоту (формиат) с помощью альдегиддегидрогеназы.(ALDH). Преобразование в формиат с помощью ALDH происходит полностью, без обнаруживаемого формальдегида. [32] Формиат токсичен, потому что он ингибирует митохондриальную цитохром с оксидазу , вызывая гипоксию на клеточном уровне и метаболический ацидоз , среди множества других метаболических нарушений. [33]
Вспышки отравления метанолом произошли в основном из-за заражения употребляемого алкоголя . Это чаще встречается в развивающихся странах . [34] В 2013 году, тем не менее, в США произошло более 1700 случаев. Пострадавшие часто бывают взрослыми мужчинами. [35] Результаты могут быть хорошими при раннем лечении. [36] Токсичность по отношению к метанолу была описана еще в 1856 году. [37]
Из-за своих токсичных свойств метанол часто используется в качестве денатурирующей добавки для этанола, производимого для промышленного использования. Это добавление метанола освобождает промышленный этанол (широко известный как « денатурированный спирт » или «метилированный спирт») от акцизного налогообложения спиртных напитков в США и некоторых других странах.
В ходе COVID-19 пандемии , то за продуктами и лекарствами США обнаружили ряд дезинфицирующее продуктов , продаваемых , которые были помечены как содержащие этанол , но имели положительную реакцию на загрязнение метанола. [38] Из-за токсического воздействия метанола при всасывании через кожу или проглатывании, в отличие от относительно более безопасного этанола, FDA распорядилось отозвать такие дезинфицирующие средства для рук, содержащие метанол, и выпустило предупреждение об импорте, чтобы предотвратить незаконный ввоз этих продуктов. рынок США. [39]
Приложения [ править ]
Формальдегид, уксусная кислота, метил- трет- бутиловый эфир [ править ]
Метанол в первую очередь превращается в формальдегид , который широко используется во многих областях, особенно в полимерах. Конверсия влечет за собой окисление:
Уксусную кислоту можно производить из метанола.
Метанол и изобутен объединяют с получением метил- трет- бутилового эфира (МТВЕ). МТБЭ является основным усилителем октанового числа бензина.
Метанол в углеводороды, олефины, бензин [ править ]
Конденсация метанола с получением углеводородов и даже ароматических систем лежит в основе нескольких технологий, связанных с преобразованием газа в жидкости . К ним относятся превращение метанола в углеводороды (MTH), из метанола в бензин (MTG), из метанола в олефины (MTO) и из метанола в пропилен (MTP). Эти превращения катализируются цеолитами как гетерогенными катализаторами . Когда-то процесс MTG был коммерциализирован на Motunui в Новой Зеландии. [41] [42]
Присадка к бензину [ править ]
Европейская директива качества топлива позволяет производитель топлива смешать до 3% метанола, с равным количеством сорастворителя, с бензином , продаваемым в Европе. Китай использует более 4,5 миллиардов литров метанола в год в качестве транспортного топлива в смесях с низким уровнем содержания для обычных транспортных средств и смесях с высоким содержанием метанола в автомобилях, предназначенных для использования в качестве топлива на метаноле. [ необходима цитата ]
Другие химические вещества [ править ]
Метанол является предшественником большинства простых метиламинов , метилгалогенидов и метиловых эфиров. [18] Метиловые эфиры производятся из метанола, включая переэтерификацию жиров и производство биодизеля путем переэтерификации . [43] [44]
Ниша и потенциальное использование [ править ]
Энергоноситель [ править ]
Метанол является многообещающим энергоносителем , поскольку в жидком виде его легче хранить, чем водород и природный газ. Однако его плотность энергии низкая, что отражает тот факт, что он представляет собой частично сгоревший метан . Его удельная энергия составляет 15,6 МДж / л , у этанола - 24, а у бензина - 33 МДж / л.
Еще одним преимуществом метанола является его способность к биологическому разложению и низкая токсичность. Он не сохраняется ни в аэробной (в присутствии кислорода), ни в анаэробной (без кислорода) среде. Период полураспада метанола в грунтовых водах составляет всего от одного до семи дней, в то время как многие обычные компоненты бензина имеют период полураспада в сотни дней (например, бензол - 10-730 дней). Поскольку метанол смешивается с водой и поддается биологическому разложению, маловероятно, что он будет накапливаться в грунтовых водах, поверхностных водах, воздухе или почве. [45]
Топливо [ править ]
Иногда метанол используется в качестве топлива для двигателей внутреннего сгорания . Горит с образованием углекислого газа и воды:
Одна из проблем, связанных с высокими концентрациями метанола в топливе, заключается в том, что спирты вызывают коррозию некоторых металлов, особенно алюминия . Топливо метанол предложено для наземного транспорта. Главное преимущество экономии метанола заключается в том, что его можно адаптировать к бензиновым двигателям внутреннего сгорания с минимальными изменениями двигателей и инфраструктуры, которая доставляет и хранит жидкое топливо. Однако его удельная энергия вдвое меньше, чем у бензина, а это означает, что потребуется вдвое больший объем метанола. [ необходима цитата ]
Метанол является альтернативным топливом для судов, которое помогает судоходной отрасли соблюдать все более строгие нормы выбросов. Это значительно снижает выбросы оксидов серы (SOx), оксидов азота (NOx) и твердых частиц. Метанол может использоваться с высокой эффективностью в судовых дизельных двигателях после незначительных модификаций с использованием небольшого количества пилотного топлива (Dual fuel). [46] [47]
В КНР метанол используется в качестве топлива для промышленных котлов, которые широко используются для выработки тепла и пара для различных промышленных применений и отопления жилых помещений. Его используют для вытеснения угля, на который оказывают давление все более строгие экологические нормы. Он предлагает конкурентоспособную стоимость топлива, а в качестве жидкого топлива требует лишь умеренных инвестиций в инфраструктуру. [48]
Топливные элементы с прямым использованием метанола уникальны своей работой при низких температурах и атмосферном давлении, что позволяет значительно уменьшить их размеры. [49] [50] Это, в сочетании с относительно простым и безопасным хранением и обращением с метанолом, может открыть возможность создания бытовой электроники на топливных элементах , такой как портативные компьютеры и мобильные телефоны. [51]
Метанол также широко используется в качестве топлива в походных и лодочных печах. Метанол хорошо горит в горелке без давления, поэтому спиртовые печи часто бывают очень простыми, иногда чуть больше чашки для топлива. Отсутствие сложности делает их излюбленными туристами, которые проводят много времени в дикой природе. Точно так же спирт может быть превращен в гель, чтобы уменьшить риск утечки или разлива, как и в случае с торговой маркой « Sterno ».
Метанол смешивается с водой и впрыскивается в высокоэффективные дизельные и бензиновые двигатели для увеличения мощности и снижения температуры всасываемого воздуха в процессе, известном как впрыск водного метанола .
Другие приложения [ править ]
Метанол использовался в качестве денатурирующего агента (преднамеренного токсина) для этанола, продукт был известен как « денатурированный спирт » или «метилированный спирт». Это обычно использовалось во времена Сухого закона, чтобы препятствовать употреблению контрабандных спиртных напитков, и в конечном итоге привело к нескольким смертельным случаям. [52] Подобные действия в настоящее время являются незаконными в Соединенных Штатах и считаются убийством. [53]
Метанол используется в качестве растворителя и антифриза в трубопроводах и жидкости для омывания лобового стекла . Метанол использовался в качестве антифриза для охлаждающей жидкости в автомобилях в начале 1900-х годов. [54] С мая 2018 года метанол был запрещен в ЕС для использования для мытья или размораживания ветрового стекла из-за риска употребления в пищу человеком [55] [56] в результате отравления метанолом в Чешской Республике в 2012 году . [57]
На некоторых очистных сооружениях в сточные воды добавляют небольшое количество метанола, чтобы обеспечить источник углерода для денитрифицирующих бактерий , которые превращают нитраты в газообразный азот и уменьшают нитрификацию чувствительных водоносных горизонтов .
Метанол используется как обесцвечивающий агент при электрофорезе в полиакриламидном геле .
Производство [ править ]
Из синтез-газа [ править ]
Окись углерода и водород взаимодействуют над катализатором с образованием метанола. Сегодня наиболее широко используемым катализатором является смесь оксидов меди и цинка , нанесенная на оксид алюминия, которая впервые была использована ICI в 1966 году. При 5–10 МПа (50–100 атм) и 250 ° C (482 ° F) температура реакция характеризуется высокой селективностью (> 99,8%):
Производство синтез-газа из метана дает три моля водорода на каждый моль окиси углерода, тогда как синтез потребляет только два моля газообразного водорода на моль окиси углерода. Один из способов справиться с избыточным водородом - это ввести диоксид углерода в реактор синтеза метанола, где он также реагирует с образованием метанола в соответствии с уравнением:
С точки зрения механизма, процесс происходит путем первоначального превращения CO в CO 2 , который затем гидрируется : [58]
где побочный продукт H 2 O рециркулируется посредством реакции конверсии водяного газа.
Это дает общую реакцию, аналогичную приведенной выше.
Биосинтез [ править ]
Каталитическое превращение метана в метанол осуществляется ферментами, включая метанмонооксигеназы . Эти ферменты представляют собой оксигеназы со смешанными функциями, т.е. оксигенация сочетается с образованием воды [59] и NAD + . [60]
Были охарактеризованы как Fe-, так и Cu-зависимые ферменты. [60] Были предприняты интенсивные, но в основном бесплодные попытки подражать этой реактивности. [61] [62] Метанол окисляется легче, чем исходный метан, поэтому реакции, как правило, не являются селективными. Существуют некоторые стратегии, позволяющие обойти эту проблему. Примеры включают системы Шилова и цеолиты, содержащие Fe и Cu. [63] Эти системы не обязательно имитируют механизмы, используемые металлоферментами , но черпают в них определенное вдохновение. Активные центры могут существенно отличаться от тех, что известны в ферментах. Например, биядерный активный центр предлагается в ферменте sMMO , тогда как моноядерное железо (альфа-кислород ) предлагается в Fe-цеолите. [64]
Безопасность [ править ]
Метанол легко воспламеняется. Его пары немного тяжелее воздуха, могут перемещаться и воспламеняться. Пожары метанола следует тушить с помощью сухих химикатов , двуокиси углерода , водной струи или спиртоустойчивой пены. [12]
Спецификации качества и анализ [ править ]
Метанол коммерчески доступен с различной степенью чистоты. Коммерческий метанол обычно классифицируется в соответствии со степенью чистоты A и AA ASTM. Чистота как класса A, так и степени чистоты AA составляет 99,85% по весу метанола. Метанол марки «AA» также содержит следовые количества этанола [9] .
Метанол для химического использования обычно соответствует классу AA. Помимо воды, типичные примеси включают ацетон и этанол (которые очень трудно отделить перегонкой). УФ-видимая спектроскопия - удобный метод обнаружения ароматических примесей. Содержание воды можно определить титрованием по Карлу-Фишеру .
История [ править ]
В процессе бальзамирования древние египтяне использовали смесь веществ, в том числе метанол, которые они получали при пиролизе древесины. Однако чистый метанол был впервые выделен в 1661 году Робертом Бойлем , когда он получил его путем дистилляции самшита (самшита). [65] Позже он стал известен как «пироксилиновый спирт». В 1834 году французские химики Жан-Батист Дюма и Эжен Пелиго определили его элементный состав. [66] Они также ввели слово «метилен» в органическую химию, образовав его от греческого слова methy = «спиртовая жидкость» + hȳlē.= «лес, дерево, древесина, материал». «Метилен» обозначает «радикал», который содержит около 14% водорода по массе и содержит один атом углерода. Это был бы CH 2 , но в то время считалось, что углерод имеет атомную массу всего в шесть раз больше, чем водород, поэтому они дали формулу как CH. [66] Затем они назвали древесный спирт (l'esprit de bois) «бигидрат метилена» (бигидрат, потому что они думали, что формула была C 4 H 8 O 4 = (CH) 4 (H 2 O) 2 ). Термин «метил» был получен примерно в 1840 году путем обратного образования.от «метилена», а затем был применен для описания «метилового спирта». Это было сокращено до «метанола» в 1892 году Международной конференцией по химической номенклатуре . [67] суффикса -ил , который, в органической химии , образует имена углеродных групп, от слова метил .
Французский химик Поль Сабатье представил первый процесс, который можно было использовать для синтетического производства метанола в 1905 году. Этот процесс предполагал, что диоксид углерода и водород могут реагировать с образованием метанола [9] . Немецкие химики Альвин Митташ и Матиас Пьер, работающие на Badische-Anilin & Soda-Fabrik (BASF), разработали средство для преобразования синтез-газа (смесь монооксида углерода , диоксида углерода и водорода ) в метанол и получили патент. По словам Боццано и Маненти, процесс BASF впервые был использован в Леуне., Германия в 1923 году. Рабочие условия включали «высокие» температуры (от 300 до 400 ° C) и давления (от 250 до 350 атм) с катализатором цинк / оксид хрома [9] .
Патент США 1569775 ( US 1569775 ) был подан 4 сентября 1924 г. и выдан 12 января 1926 г. компании BASF; В процессе использовался катализатор на основе оксида хрома и марганца в чрезвычайно жестких условиях: давление в диапазоне от 50 до 220 атм и температура до 450 ° C. Современное производство метанола стало более эффективным за счет использования катализаторов (обычно медных), способных работать при более низких давлениях. Современный процесс метанола низкого давления (LPM) был разработан ICI в конце 1960-х годов в патенте США № 3326956, срок действия технологического патента истек.
Во время Второй мировой войны метанол использовался в качестве топлива в нескольких конструкциях немецких военных ракет под названием M-Stoff и в смеси примерно 50/50 с гидразином , известной как C-Stoff .
Использование метанола в качестве моторного топлива привлекло внимание во время нефтяного кризиса 1970-х годов . К середине 1990-х в США было введено более 20 000 метанольных « гибких топливных транспортных средств » (FFV), способных работать на метаноле или бензине. Кроме того, низкие уровни метанола смешивались с бензиновым топливом, продаваемым в Европе в течение большей части 1980-х и начало 1990-х гг. К концу 1990-х автопроизводители прекратили производство метанольных FFV, переключив свое внимание на автомобили, работающие на этаноле. Хотя программа FFV метанола имела технический успех, рост цен на метанол в середине-конце 1990-х годов в период падения цен на бензиновые насосы снизил интерес к метанольному топливу. [68]
В начале 1970-х годов процесс был разработан Mobil для получения бензина топливо из метанола. [69]
Между 1960-ми и 1980-ми годами метанол появился в качестве предшественника исходных химических веществ уксусной кислоты и уксусного ангидрида . Эти процессы включают в себя синтез Монсанто уксусной кислоты , процесс Cativa , и процесс уксусного ангидрида Теннесси Eastman .
См. Также [ править ]
- Алкоголь
- Аминометанол
- Метанол (страница данных)
- Триметил карбинол
Ссылки [ править ]
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 692. DOI : 10.1039 / 9781849733069-00648 . ISBN 978-0-85404-182-4.
- ^ Лида, DR, изд. (2005). CRC Справочник по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5.
- ^ Ballinger, P .; Лонг, Ф.А. (1960). «Константы кислотной ионизации спиртов. II. Кислотности некоторых замещенных метанолов и родственных соединений». Варенье. Chem. Soc . 82 (4): 795–798. DOI : 10.1021 / ja01489a008 .
- ^ "Метилоксоний" . pubchem.ncbi.nlm.nih.gov . Проверено 21 декабря 2018 .
- ^ «Метанолят» . pubchem.ncbi.nlm.nih.gov . Проверено 21 декабря 2018 .
Метоксид - это органический анион, являющийся сопряженным основанием метанола.
… Это сопряженное основание метанола.
- ^ "RefractiveIndex.INFO - База данных индекса преломления" .
- ^ Гонсалеса, Бегония (2007). «Плотность, динамическая вязкость и производные свойства бинарных смесей метанола или этанола с водой, этилацетатом и метилацетатом при T = (293,15, 298,15 и 303,15) K». Журнал химической термодинамики . 39 (12): 1578–1588. DOI : 10.1016 / j.jct.2007.05.004 .
- ^ a b c d "Метанол" (PDF) . Lab Chem . Валтех . Проверено 10 марта 2016 .
- ^ a b c d Токсичность при ошибке PubChem Cite: указанная ссылка ": 1" была определена несколько раз с разным содержанием (см. страницу справки ).
- ^ a b c d Карманный справочник NIOSH по химической опасности. «# 0397» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ a b c «Метанол» . Немедленно опасная для жизни или здоровья концентрация (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ a b c «База данных по безопасности и охране здоровья при чрезвычайных ситуациях: систематический агент: МЕТАНОЛ» . Центры по контролю и профилактике заболеваний . Проверено 3 августа 2018 .
- ^ «PubChem: Безопасность и опасности - Классификация GHS» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Руководство по безопасному обращению с метанолом" (PDF) . Институт метанола . 2017. с. 253 . Проверено 3 августа 2018 .
- ^ «Техническая информация и руководство по безопасному обращению с метанолом» . Methanex Corporation. Архивировано из оригинального 11 -го марта 2012 года.
- ^ "Руководство по безопасному обращению с метанолом" (PDF) . Институт метанола . 2017. с. 243 . Проверено 3 августа 2018 .
- ↑ Национальный институт охраны труда и здоровья (22 августа 2008 г.). «База данных по безопасности и охране здоровья при чрезвычайных ситуациях: метанол» . Проверено 17 марта 2009 года .
- ^ a b c Fiedler, E .; Grossmann, G .; Burkhard Kersebohm, D .; Вайс, Г. и Витте, К. (2005). «Метанол». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a16_465 . ISBN 978-3527306732.CS1 maint: использует параметр авторов ( ссылка )
- ^ Тернер C (2006). «Продольное исследование метанола в выдыхаемом воздухе 30 здоровых добровольцев с использованием выбранной масс-спектрометрии с ионной проточной трубкой, SIFT-MS». Физиологические измерения . 27 (7): 637–48. Bibcode : 2006PhyM ... 27..637T . DOI : 10.1088 / 0967-3334 / 27/7/007 . PMID 16705261 .
- ^ Lindinger W (1997). «Эндогенное производство метанола после употребления фруктов». Алкоголизм, клинические и экспериментальные исследования . 21 (5): 939–43. DOI : 10.1111 / j.1530-0277.1997.tb03862.x . PMID 9267548 .
- ^ «Выявлен основной источник метанола в океане» . Океанографическое учреждение Вудс-Хоул . 10 марта 2016 . Проверено 30 марта 2016 .
- ^ Минсер, Трейси Дж .; Айчер, Афина К. (2016). «Производство метанола широким филогенетическим массивом морского фитопланктона» . PLOS ONE . 11 (3): e0150820. Bibcode : 2016PLoSO..1150820M . DOI : 10.1371 / journal.pone.0150820 . PMC 4786210 . PMID 26963515 .
- ^ Брукс Хейс (17 апреля 2015 г.). «Почему астрономы ненавидят робот-пылесос Roomba» . Space Daily.
- ^ «Модернизированное шпионское облако алкоголя MERLIN, охватывающее 288 миллиардов миль» (пресс-релиз). Центр астрофизики Джодрелл Бэнк . 19 апреля 2006 Архивировано из оригинала 20 июля 2011 года.
- ↑ Амос, Джонатан (5 апреля 2006 г.). «Мерлин видит безбрежный поток алкоголя» . BBC News .
- ^ «Первое обнаружение метилового спирта в планетообразующем диске» . Проверено 22 июня +2016 .
- ^ а б Вале А (2007). «Метанол». Медицина . 35 (12): 633–4. DOI : 10.1016 / j.mpmed.2007.09.014 .
- ^ «Обзор отравления метанолом» . Антизол. Архивировано из оригинала 5 октября 2011 года.
- ^ «Интегрированная система информации о рисках» . Агентство по охране окружающей среды США, ORD, NCEA, IRISD. 15 марта 2013 г.
- ^ «Токсикологический обзор метанола (без рака) (CAS № 67-56-1) в поддержку сводной информации об Интегрированной системе информации о рисках (IRIS)» (PDF) . EPA . Сентябрь 2013 г. EPA / 635 / R-11 / 001Fa . Проверено 4 сентября 2017 года . Cite journal requires
|journal=(help) - ^ ЗсЬер LJ, RJ Slaughter, Vale JA, Бизли DM (2009). «Моряк со слепотой и растерянностью» . BMJ . 339 : b3929. DOI : 10.1136 / bmj.b3929 . PMID 19793790 . S2CID 6367081 .
- ^ McMartin KE, Martin-Амат G, Noker PE, Tephly TR (1979). «Отсутствие роли формальдегида в отравлении метанолом у обезьяны». Биохим. Pharmacol . 28 (5): 645–9. DOI : 10.1016 / 0006-2952 (79) 90149-7 . PMID 109089 .
- ^ Liesivuori J, Savolainen H (сентябрь 1991). «Токсичность метанола и муравьиной кислоты: биохимические механизмы». Pharmacol. Toxicol . 69 (3): 157–63. DOI : 10.1111 / j.1600-0773.1991.tb01290.x . PMID 1665561 .
- ^ Beauchamp, Джорджия; Валенто, М. (сентябрь 2016 г.). «Проглатывание токсичного алкоголя: быстрое распознавание и лечение в отделении неотложной помощи». Практика неотложной медицинской помощи . 18 (9): 1–20. PMID 27538060 .
- ^ Ферри, Фред Ф. (2016). Клинический консультант Ферри 2017: 5 книг в 1 . Elsevier Health Sciences. п. 794. ISBN 9780323448383.
- Перейти ↑ Kruse, JA (октябрь 2012 г.). «Отравление метанолом и этиленгликолем». Клиники интенсивной терапии . 28 (4): 661–711. DOI : 10.1016 / j.ccc.2012.07.002 . PMID 22998995 .
- ^ Клэри, Джон Дж. (2013). Токсикология метанола . Джон Вили и сыновья. п. 3.4.1. ISBN 9781118353103.
- ^ «Дезинфицирующие средства для рук COVID-19» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США . 9 июля 2020. Архивировано из оригинала 9 июля 2020 года.
- ^ «FDA обновляет дезинфицирующие средства для рук, которые потребители не должны использовать» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 31 июля 2020. Архивировано из оригинала на 1 августа 2020 года.
- ^ Санли, GJ; Уотсон, ди-джей (2000). «Высокопроизводительный катализ карбонилирования метанола с использованием иридия - процесс Cativa для производства уксусной кислоты». Катализ сегодня . 58 (4): 293–307. DOI : 10.1016 / S0920-5861 (00) 00263-7 .
- ^ Olsbye, U .; Svelle, S .; Bjorgen, M .; Beato, P .; Янссенс, TVW; Joensen, F .; Bordiga, S .; Лиллеруд, КП (2012). «Превращение метанола в углеводороды: как полость и размер пор цеолита контролируют селективность продукта». Энгью. Chem. Int. Эд . 51 (24): 5810–5831. DOI : 10.1002 / anie.201103657 . PMID 22511469 . CS1 maint: uses authors parameter (link)
- ^ Tian, P .; Wei, Y .; Е, М .; Лю, З. (2015). «Метанол в олефины (MTO): от основ до коммерциализации» . ACS Catal . 5 (3): 1922–1938. DOI : 10.1021 / acscatal.5b00007 .CS1 maint: uses authors parameter (link)
- ^ "Биодизель - МЕТАНОЛОВЫЙ ИНСТИТУТ" . МЕТАНОЛОВЫЙ ИНСТИТУТ . Проверено 24 марта 2018 года .
- ^ "Принципы и процессы производства биодизеля - расширение" . Проверено 24 марта 2018 года .
- ↑ Оценка судьбы и переноса метанола в окружающей среде. Архивировано 16 мая 2016 г. в Португальском веб-архиве, Malcolm Pirnie, Inc., январь 1999 г.
- ^ https://www.methanex.com/about-methanol/methanol-marine-fuel
- ^ https://eu-ems.com/event_images/presentations/Prof.%20Karin%20Andersson%20presentation.pdf
- ^ https://www.methanex.com/about-methanol/methanol-industrial-boiler-fuel
- ^ Kamitani, A .; Morishita, S .; Kotaki, H .; Арскотт, С. (2008). «Миниатюрный microDMFC с использованием кремниевых микросистем: характеристики при низких расходах топлива». Журнал микромеханики и микротехники . 18 (12): 125019. Bibcode : 2008JMiMi..18l5019K . DOI : 10.1088 / 0960-1317 / 18/12/125019 .
- ^ Kamitani, A .; Morishita, S .; Kotaki, H .; Арскотт, С. (2011). «Микрожидкостные топливные элементы». Датчики и исполнительные механизмы B: химические . 154 (2): 174. DOI : 10.1016 / j.snb.2009.11.014 .
- ↑ Бергер, Сэнди (30 сентября 2006 г.). «Топливо для ноутбуков на метаноле» . Compu · Поцелуй . Проверено 22 мая 2007 года .
- ↑ Блюм, Дебора (19 февраля 2010 г.). «Немного рассказанная история о том, как правительство США отравляло алкоголь во время сухого закона» . Журнал Slate . Проверено 10 июня 2010 года .
- ^ https://uscode.house.gov/view.xhtml?path=/prelim@title22/chapter75&edition=prelim
- ^ Янт, WP; Шренк, HH; Сэйерс, Р.Р. (1931). «Метанольный антифриз и отравление метанолом». Промышленная и инженерная химия . 23 (5): 551. DOI : 10.1021 / ie50257a020 .
- ^ "EUR-Lex - 32018R0589 - EN - EUR-Lex" . eur-lex.europa.eu . Проверено 28 ноября 2018 .
- ^ Исправление к Регламенту Комиссии (ЕС) 2018/589 от 18 апреля 2018 г. о внесении поправок в Приложение XVII к Регламенту (ЕС) № 1907/2006 Европейского парламента и Совета о регистрации, оценке, разрешении и ограничении химических веществ (REACH) как в отношении метанола (OJ L 99, 19.4.2018) , 23 апреля 2018 г. , получено 7 июля 2020 г.
- ↑ Приложение XV Отчет об ограничениях: Предложение по наименованию вещества ограничения: Метанол - таблица D.1-4 стр. 79 , 16 января 2015 г.
- ^ Дойчманн, Олаф; Knözinger, Helmut; Кохлофл, Карл и Турек, Томас (2012) «Гетерогенный катализ и твердые катализаторы, 3. Промышленное применение» в Энциклопедии промышленной химии Ульмана . Wiley-VCH, Weinheim. DOI : 10.1002 / 14356007.o05_o03
- Перейти ↑ Mu-Hyun Baik, Martin Newcomb, Richard A. Friesner, Stephen J. Lippard (2003). «Механистические исследования гидроксилирования метана метаномонооксигеназой». Chem. Ред . 103 (6): 2385–2420. DOI : 10.1021 / cr950244f . PMID 12797835 . CS1 maint: uses authors parameter (link)
- ^ а б Лоутон, TJ; Розенцвейг, AC (2016). «Биокатализаторы конверсии метана: большой прогресс в разрушении небольшого субстрата» . Curr. Opin. Chem. Биол . 35 : 142–149. DOI : 10.1016 / j.cbpa.2016.10.001 . PMC 5161620 . PMID 27768948 . CS1 maint: uses authors parameter (link)
- ^ Алайон, EMC; Nachtegaal, M .; Ranocchiari, M .; Ван Боховен, Дж. А. (2012). «Каталитическое превращение метана в метанол с использованием Cu-цеолитов». Международный химический журнал CHIMIA . 66 (9): 668–674. DOI : 10,2533 / chimia.2012.668 . PMID 23211724 .
- ^ Хаммонд, C .; Jenkins, RL; Dimitratos, N .; Lopez-Sanchez, JA; Аб Рахим, MH; Форд, ММ; Thetford, A .; Мерфи, DM; Hagen, H .; Стэнгленд, Э. Moulijn, JM; Тейлор, SH; Уиллок, диджей; Хатчингс, GJ (2012). "Каталитические и механические исследования низкотемпературного селективного окисления метана над Fe-ZSM-5, промотированным медью". Химия: Европейский журнал . 18 (49): 15735–45. DOI : 10.1002 / chem.201202802 . PMID 23150452 .
- ^ Снайдер, Бенджамин ER; Bols, Max L .; Schoonheydt, Robert A .; Sels, Bert F .; Соломон, Эдвард I. (19 декабря 2017 г.). «Активные центры железа и меди в цеолитах и их корреляция с металлоферментами». Химические обзоры . 118 (5): 2718–2768. DOI : 10.1021 / acs.chemrev.7b00344 . PMID 29256242 .
- ^ Снайдер, Бенджамин ER; Vanelderen, Питер; Bols, Max L .; Hallaert, Simon D .; Böttger, Lars H .; Унгур, Ливиу; Пьерло, Кристина; Schoonheydt, Robert A .; Сельс, Берт Ф. (2016). «Активный центр низкотемпературного гидроксилирования метана в железосодержащих цеолитах». Природа . 536 (7616): 317–321. Bibcode : 2016Natur.536..317S . DOI : 10,1038 / природа19059 . PMID 27535535 . S2CID 4467834 .
- ↑ Бойль обсуждает перегонку жидкостей из древесины самшита в: Роберт Бойл, Скептический химик (Лондон, Англия: Дж. Кэдвелл, 1661), стр. 192–195 .
- ^ a b Отчет Ж. Дюма и Э. Пелиго о метаноле для Французской академии наук начался во время собрания Академии 27 октября 1834 г. и завершился во время собрания 3 ноября 1834 г. См .: Procès-verbaux des séances de l ' Académie , 10 : 600–601. Доступно на: Gallica . Полный отчет опубликован в: J. Dumas and E. Péligot (1835) «Mémoire sur l'espirit de bois et sur les divers composés ethérés qui en proviennent» (Воспоминания о духе дерева и различных эфирных соединениях, происходящих из него) , Анналы химии и тела , 58 : 5–74; со страницы 9 : Nous donnerons le nom deметилен (1) без радикала… (1) εθυ, vin, et υλη, bois; c'est-à-dire vin или ликер spiritueuse du bois. (Мы дадим название метилен (1) радикалу… (1) метил , вино и hulē , дерево; то есть вино или древесный спирт.)
- ↑ Отчет о Международной конференции по химической номенклатуре, состоявшейся в апреле 1892 года в Женеве, Швейцария, см .:
- Армстронг, Генри Э (1892). «Международная конференция по химической номенклатуре» . Природа . 46 (1177): 56–9. Bibcode : 1892Natur..46 ... 56А . DOI : 10.1038 / 046056c0 .
- Отчет Армстронга перепечатан с резолюциями на английском языке в: Armstrong, Henry (1892). «Международная конференция по химической номенклатуре» . Журнал аналитической и прикладной химии . 6 (1177): 390–400. Bibcode : 1892Natur..46 ... 56А . DOI : 10.1038 / 046056c0 .
п.
398: 15. Спирты и фенолы названы в честь углеводорода, из которого они получены, и оканчиваются суффиксом
ол
(например, пентанол, пентенол и т. Д.).
- ^ Halderman, Джеймс Д .; Мартин, Тони (2009). Гибридные автомобили и автомобили на альтернативном топливе . Пирсон / Прентис Холл. ISBN 978-0-13-504414-8.
- ↑ Рональд Смит (1 декабря 2011 г.). «Метанол в бензин: частный отчет программы экономики процесса» (PDF) . Проверено 4 декабря 2019 .
Дальнейшее чтение [ править ]
- Роберт Бойль , Скептический химик (1661 г.) - содержит описание перегонки древесного спирта.
Внешние ссылки [ править ]
- Международная карта химической безопасности 0057
- Метиловый спирт (метанол) CDC / NIOSH, ссылки на информацию по безопасности
- CDC - Карманное руководство NIOSH по химической опасности - метиловый спирт
- Информационный бюллетень по метанолу - Национальный реестр загрязнителей