 | |
| Имена | |
|---|---|
| Другие имена Пиовердин | |
| Идентификаторы | |
3D модель ( JSmol ) | |
PubChem CID | |
| |
| |
| Характеристики | |
| С 56 H 88 N 18 O 22 | |
| Молярная масса | 1 365 0,424 г · моль -1 |
| Внешность | Твердый |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Пиовердины [1] (альтернативно и реже пишутся как пиовердины ) представляют собой флуоресцентные сидерофоры, продуцируемые определенными псевдомонадами . [2] [3] Пиовердины являются важными факторами вирулентности и необходимы для патогенеза многих биологических моделей инфекции . Их вклад в бактериальный патогенез включает обеспечение жизненно важным питательным веществом (например, железом ), регулирование других факторов вирулентности (включая экзотоксин А и протеазу PrpL) [4], поддержку образования биопленок ,[5] и все чаще признаны токсичными . [6] [7] [8]
Pyoverdines также были исследованы как « троянский конь молекул» для доставки антимикробных в противном случае устойчивых бактериальных штаммов , как энтеросорбенты , которые могут быть использованы для биоремедиации из тяжелых металлов , а также флуоресцентные репортеры , используемых для анализа на присутствие железа и потенциально других металлов . [9]
Из-за того, что они устраняют разрыв между патогенностью , метаболизмом железа и флуоресценцией, пиовердины вызывают любопытство ученых всего мира более 100 лет.
Биологические функции [ править ]
Как и большинство сидерофоров, пиовердин синтезируется и выделяется в окружающую среду, когда продуцирующий его микроорганизм обнаруживает, что внутриклеточные концентрации железа упали ниже заданного порогового значения. Хотя железо является четвертым по распространенности элементом в земной коре , растворимость биологически значимых соединений железа чрезвычайно низка и, как правило, недостаточна для нужд большинства (но не всех) микроорганизмов. Сидерофоры, которые обычно достаточно растворимы и имеют исключительно высокую авидность по отношению к железу (III) (авидность некоторых сидерофоров по железу превышает 10 40 М -1.и многие из самых сильных алчностей, когда-либо наблюдавшихся в природе, проявляются сидерофорами по отношению к железу), помогают увеличить биодоступность железа, переводя его в водный раствор.
В дополнение к этой роли пиовердин выполняет ряд других функций, включая регулирование вирулентности, [4] [5] ограничение роста других видов бактерий (и служение своего рода противомикробным средством) за счет ограничения доступности железа и связывания других металлов и предотвращение их токсичности.
Структура и характеристики [ править ]
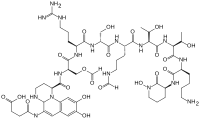
Хотя многие (> 100) форм пиовердина были выделены и изучены, все они имеют определенные общие характеристики. Каждая молекула пиовердина состоит из трех частей: дигидроксихинолинового ядра, пептида из 6-14 аминокислот, который варьируется в зависимости от штамма , и боковой цепи (обычно состоящей из 4-5 углеродной α- кетокислоты из цикла Кребса / лимонная кислота ). Ядро пиовердина отвечает за несколько его свойств, включая хорошо известный желтоватый цвет и флуоресценцию.
Структура [ править ]
Ядро дигидроксихинолина состоит из (1S) -5-амино-2,3-дигидро-8,9-дигидрокси-1H-пиримидо [1,2-a] хинолин- 1-карбоновой кислоты. Эта часть молекулы инвариантна среди всех наблюдаемых молекул пиовердина.
Ядро модифицировано добавлением аминокислотной цепи пиовердина, состоящей из 6-14 аминокислот. Цепочка аминокислот встроена в ядро хромофора и синтезируется с помощью нерибосомного пептидного синтеза . [10] [11] Как обычно для пептидов, синтезированных не рибзосомами, пиовердин часто включает аминокислоты в D-форме и нестандартные аминокислоты, такие как N- 5-формил- N- 5-гидроксиорнитин . Пептидная цепь также может быть частично (или полностью) циклизована. Эта пептидная цепь обеспечивает четыре других аспекта гексадентатного взаимодействия, обычно через гидроксамат и / илигидроксикарбоксилатные группы. Эта часть молекулы также имеет решающее значение для взаимодействия с рецептором феррипиовердина (FpvA), который позволяет феррипиовердину импортироваться в клетку. Пептидная цепь, продуцируемая данным штаммом Pseudomonas, в настоящее время считается инвариантной.
Мало что известно о конкретной функции или важности боковой цепи кетокислоты, но хорошо известно [12], что молекулы пиовердина сосуществуют с различными кетокислотами ( конгенерами ). Наблюдаемые кетокислоты включают сукцинат / сукцинамид , глутамат , глутарат , малат / маламид и α-кетоглутарат .
| Виды псевдомонад | Напряжение | Структура пептидной цепи пиовердина |
|---|---|---|
| P. aeruginosa | ATCC15692 (PAO1) | Q-DSer-Arg-DSer-FoOHOrn-c (Lys-FoOHOrn-Thr-Thr) |
| P. aeruginosa | ATCC27853 | Q-DSer-FoOHDOrn-Orn-Gly-aDThr-Ser-cOHOrn |
| P. aeruginosa | Pa6 | Q-DSer-Dab-FoOHOrn-Gln-DGln-FoOHDOrn-Gly |
| P. chlororaphis | ATCC9446 | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.I | ATCC13525 | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.I | 9AW | Q-DSer-Lys-OHHis-aDThr-Ser-cOHOrn |
| P. fluorescens bv.III | ATCC17400 | Q-DAla-DLys-Gly-Gly-OHAsp-DGln / Dab-Ser-DAla-cOHOrn |
| P. fluorescens bv.V | 51 Вт | Q-DAla-DLys-Gly-Gly-OHDAsp-DGln-DSer-Ala-Gly-aDThr-cOHOrn |
| P. fluorescens bv.V | 1 Вт | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.V | 10CW | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.VI | PL7 | Q-DSer-AcOHDOrn-Ala-Gly-aDThr-Ala-cOHOrn |
| P. fluorescens bv.VI | PL8 | Q-DLys-AcOHDOrn-Ala-Gly-aDThr-Ser-cOHOrn |
| P. fluorescens | 1.3 | Q-DAla-DLys-Gly-Gly-OHAsp-DGln / Dab-Gly-Ser-cOHOrn |
| P. fluorescens | 18,1 | Q-DSer-Lys-Gly-FoOHOrn-Ser-DSer-Gly-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens | CCM 2798 | Q-Ser-Dab-Gly-Ser-OHDAsp-Ala-Gly-DAla-Gly-cOHOrn |
| P. fluorescens | CFBP 2392 | Q-DLys-AcOHDOrn-Gly-aDThr-Thr-Gln-Gly-DSer-cOHOrn |
| P. fluorescens | CHA0 | Q-Asp-FoOHDOrn-Lys-c (Thr-Ala-Ala-FoOHDOrn-Lys) |
| P. putida bv. B | 9BW | Q-DSer-Lys-OHHis-aDThr-Ser-cOHOrn |
| P. putida | CFBP 2461 | Q-Asp-Lys-OHDAsp-Ser-aDThr-Ala-Thr-DLys-cOHOrn |
| P. tolaasii | НЦППБ 2192 | Q-DSer-Lys-Ser-DSer-Thr-Ser-AcOHOrn-Thr-DSer-cOHDOrn |
Характеристики [ править ]
Среди других примечательных характеристик пиовердины проявляют яркую, относительно фотостабильную флуоресценцию с характерными спектрами возбуждения и испускания , которые быстро и сильно гасятся при связывании их естественного лиганда , железа. Возбуждение и молярная абсорбционная способность показывают умеренную зависимость от pH , но флуоресценция обычно не зависит от изменений pH . В отличие от флуоресценции, спектроскопическое поглощение мало угасает при связывании железа , что позволяет предположить, что механизм молекулярной релаксации является колебательным, а не электромагнитным излучением .
Пиовердин координирует гексадентатное (т.е. шестичастное) хелатирование железа, которое включает шесть различных атомов кислорода (2 из ядра дигидроксихинолина и по 2 из каждой из 2 различных аминокислот в основной цепи). Это приводит к очень тесно скоординированному октаэдрическому комплексу, который эффективно предотвращает проникновение воды или других материалов, которые могут нарушить связывание. Как правило, трехвалентное железо удаляется из пиовердина путем восстановления до двухвалентного состояния, для которого пиовердин имеет гораздо более низкую (т. Е. 10 9 M -1) жадность. Это позволяет осуществлять неразрушающее удаление железа из пиовердина. После восстановления железо «передается» другим носителям, которые имеют повышенное сродство к двухвалентному железу, в то время как апопиовердин реэкспортируется для дальнейшего использования.
Пиовердин структурно похож на азобактин из Azotobacter vinelandii , за исключением того, что последний обладает дополнительным кольцом мочевины. [13]
Синтез [ править ]
Биосинтез [ править ]
В Pseudomonas aeruginosa PAO1 14 генов pvd участвуют в биосинтезе пиовердина. [14]
Биосинтез пиовердина, по-видимому, в значительной степени регулируется посредством активности альтернативного сигма-фактора PvdS, который, в свою очередь, регулируется как системой Fur, так и внутриклеточной секвестрацией PvdS на плазматической мембране и вдали от нуклеоида репрессором FpvI.
Несмотря на обширные исследования, относительно мало известно о биосинтезе пиовердина. Например, остается неясным, происходит ли биосинтез пиовердина в виде отдельных компонентов (т. Е. Ядра, пептидной цепи и кетокислоты) или если ядро и другие части конденсируются в качестве начальной молекулы (возможно, белком PvdL. ), а затем модифицируется другими ферментами. По причинам , которые остаются неясными, биосинтез pyoverdine сильно ингибируется противоракового терапевтического фторурацила , [15] в частности , благодаря своей способности нарушать метаболизм РНК. [16]Хотя продукция пиовердинов варьируется от штамма к штамму, было показано, что флуоресцентные виды Pseudomonas производят от 200 до 500 мг / л при выращивании в условиях обеднения железа. [17] [18]
Ядро [ править ]
Есть некоторые споры о происхождении ядра флуоресцентного хромофора. Первоначально считалось, что он синтезируется опероном pvcABCD , поскольку делеция частей генов pvcC и pvcD нарушает продукцию пиовердина. [19] Как и другие аспекты биосинтеза пиовердина, регуляция pvcABCD зависит от железа, и потеря активности этих генов приводит к нарушению пиовердина.
В отдельном отчете предполагается, что вместо этого pvcABCD может быть ответственным за синтез паэрукумарина (молекулы, связанной с псевдовердином), и утверждается, что потеря активности в локусе не влияет на продукцию пиовердина. [20] Кроме того, у некоторых флуоресцентных псевдомонад отсутствуют явные гомологи этих генов, что дополнительно ставит под сомнение, является ли это функцией этих генов.
Это согласуется с сообщениями о том, что pvdL объединяет кофермент А с фрагментом миристиновой кислоты, а затем добавляет глутамат, D-тирозин и L-2,4-диаминомасляную кислоту (DAB). [21] Альтернативный путь биосинтеза предполагает, что pvdL вместо этого включает глутамат, 2,4,5-тригидроксифенилаланин и L-2,4-даминомасляную кислоту. [22] Последнее подтверждается идентификацией включения радиоактивно меченного тирозина либо в пиовердин, либо в псевдовердин.
Это несоответствие остается нерешенным.
Пептидная цепь [ править ]
Некоторые из генов, ответственных за биосинтез пиовердина (например, pvdH, pvdA и pvdF ), участвуют в генерации предшественников и альтернативных аминокислот, необходимых для различных частей молекулы. [23] Некоторые другие (например, pvdI и pvdJ ) непосредственно несут ответственность за «сшивание» пептидной цепи. [23] pvdD завершает цепь и высвобождает предшественник в цитоплазму , что согласуется с идентификацией пиовердин-подобных молекул в цитоплазме с не полностью созревшими хромофорами. [23]
Кетокислота [ править ]
В настоящее время наиболее достоверные данные свидетельствуют о том, что кетокислота изначально присоединяется к ядру хромофора (как L-глутамат), когда она синтезируется из D-тирозина, L-2,4-диаминомасляной кислоты и L-глутамата. Неясно, как это позже преобразуется в другие конгенерированные (например, α -кетоглутарат , сукцинат / сукцинамид и т. Д.) Формы.
Созревание и экспорт [ править ]
Локализация некоторых белков Pvd в периплазме и внешней мембране (таких как PvdN, PvdO, PvdP и PvdQ) была интерпретирована как предположение, что части созревания пиовердина происходят в этом месте, возможно, после того, как он был доставлен в периплазмы по PvdE, который является гомологичным экспортерами типа ABC . Насколько полностью созревший пиовердин выводится из клетки, остается неясным. После того, как полностью созрели, pyoverdine экспортируется из периплазмы по PvdRT-OpmQ оттока насоса.
Полный химический синтез [ править ]
Сообщается о полном пути органического синтеза пиовердина, продуцируемого штаммом PAO1 P. aeruginosa [24], с использованием твердофазного пептидного синтеза . Этот протокол дал пиовердин с высоким выходом (~ 48%) и, как ожидается, существенно увеличит способность ученых генерировать целевые производные на каркасе пиовердина и будет способствовать созданию сидерофоров с антимикробными боеголовками.
Механизмы вирулентности [ править ]
Сообщалось, что пиовердин необходим для вирулентности в различных моделях болезней , включая C. elegans и различные модели инфекции у мышей (например, модели ожогов, модели пневмонии и т. Д.). [6] [15] [25]
Как отмечалось выше, пиовердин несколькими способами способствует общей вирулентности, в том числе регулирует выработку самого экзотоксина А (который останавливает трансляцию) и протеазы PrpL. [4] Есть также свидетельства того, что пиовердин, хотя и не является необходимым для его образования, способствует образованию и развитию биопленок, важных для вирулентности. [5]
Наконец, пиовердин сам по себе ассоциируется с несколькими типами токсичности. В 2001 году Альбеса и его коллеги сообщили, что пиовердин, очищенный из штамма P. fluorescens, проявляет сильную цитотоксичность по отношению к макрофагам млекопитающих и что этот эффект, по крайней мере, частично зависит от активных форм кислорода . [26] Позже Кириенко и его коллеги определили, что пиовердин необходим и достаточен для уничтожения C. elegans , которая проникает в клетки-хозяева, дестабилизирует митохондриальную динамику и вызывает гипоксический ответ . [6] [7]Воздействие вызывает реакцию, которая согласуется с гипоксией, которая зависит от белка HIF-1 , предполагая, что хозяин воспринимает состояние, при котором ему не хватает молекулярных инструментов для выработки АТФ (как правило, железа, кислорода и клеточных восстанавливающих эквивалентов) . [6] [7]
Роль в микробиологическом сотрудничестве [ править ]
Как только пиовердин секретируется, он свободно распространяется в окружающей среде. Связанный с железом пиовердин (также известный как феррипиовердин) может поглощаться любой бактериальной клеткой с соответствующим рецептором , хотя это зависит от штамма. [27] Важно отметить, что это создает общее благо, которым могут воспользоваться «мошенники», сохранившие способность использовать пиовердин, но прекратившие его производить. Поскольку производство пиовердина является энергетически затратным, это может создать преимущество в пригодности клеток, которые его не синтезируют. [28] [29] [30] [31] Следовательно, пиовердин стал модельным признаком для изучения сотрудничества и использования микробов . [32] [33]
В P.aeruginosa , , pyoverdine непродуктивных «обмануть» бактерии , как было показано, I) легко превратиться из продуктивного предка; [34] и ii) побеждать взаимодействующие штаммы в смешанной культуре в зависимости от плотности и частоты. [35] [36] Поскольку использование пиовердина основано на пассивной диффузиипроизводство пиовердина является метаболически затратным, известно, что условия окружающей среды влияют на вероятность успешной эксплуатации. Было показано, что конкурентное преимущество непродуцентов пиовердина перед продуцентами в смешанной культуре максимизируется, когда окружающая среда хорошо перемешана и молекулы легко диффундируют (низкая пространственная структура), а также когда затраты и выгоды от производства пиовердина высоки, т.е. ограничено. [30] [37] Большинство исследований взаимодействия пиовердина и обмана было проведено с использованием клинических изолятов, но недавно было продемонстрировано использование сидерофоров в природных изолятах Pseudomonas из неклинических образцов. [38] [39]
Номенклатура [ править ]
В настоящее время не используется широко распространенная систематическая номенклатура для дифференциации структур пиовердина. Система была предложена в 1989 г. [40], состоящая из пиовердина типа I, типа IIa, типа IIb и типа III. В то время было известно только несколько структур пиовердина, и ожидалось, что будет происходить гораздо меньше вариаций, чем было замечено. Вследствие огромной неоднородности, наблюдаемой в основе пептида, и наблюдения конгенеров (пиовердинов из одного штамма, различающихся только их кетокислотными частями), номенклатура пиовердинов остается довольно незначительной, и ни одна отдельная система не получила всеобщего признания.
История [ править ]
- 1850-е: Седийо отмечает сине-зеленые выделения из перевязок хирургических ран.
- 1860: Пиовердин (хотя и не названный так) был извлечен Фордосом из перевязочного материала для ран .
- 1862: Лакке связывает пиовердин с бациллами, наблюдаемыми под микроскопом.
- 1882: Pseudomonas aeruginosa, впервые выращенная Карлом Гессаром в чистой культуре, сообщается в «О синем и зеленом окрашивании бинтов». Гессар назвал этот организм Bacillus aeruginosa после «aerugo», латинского слова, обозначающего verdigris .
- 1889: Бушар отмечает, что инъекция кролика, инфицированного Bacillus anthracis (возбудитель сибирской язвы ) с P. aeruginosa, предотвращает образование сибирской язвы.
- 1889: Бушар обнаруживает, что пиовердин флуоресцирует в ультрафиолетовом свете .
- 1948, 1952: Первые наблюдения, что концентрации железа и пиовердина взаимны.
- 1978: Мейер и его коллеги впервые продемонстрировали роль пиовердина в приобретении железа.
- 1980–1990-е: Разработаны первые структуры и регламент провердина.
- 1999: Первое определение того, что pyoverdine флуоресценции гасили путем связывания железа.
Другое использование [ править ]
Этот раздел пуст. Вы можете помочь, добавив к нему . ( Октябрь 2016 г. ) |
Псевдовердин [ править ]
Соединение, родственное пиовердину, называемое псевдовердином (формально известное как 3-формиламино-6,7-дигидроксикумарин), также вырабатывается некоторыми флуоресцентными псевдомонадами. [41] Считается, что псевдовердин и пиовердин могут возникать из общего предшественника, 2,4,5-тригидроксифенилаланина, который может конденсироваться с L-2,4-диаминомасляной кислотой, чтобы инициировать производство пиовердина. [41]
Псевдовердин относительно похож на пиовердин по своей флуоресценции и другим спектроскопическим свойствам, а также по способности хелатировать трехвалентное железо, хотя и с гораздо более низким сродством . [41] В отличие от пиовердина, он не способен транспортировать железо в клетки , вероятно, из-за отсутствия пептидной цепи. [41] Еще одно отличие состоит в том, что псевдовердин, по-видимому, не регулируется теми же процессами, что и пиовердин. [41]
Ссылки [ править ]
- ^ В целях данной страницы под пиовердином, как правило, понимается (если не указано иное) пиовердин, продуцируемыйштаммом Pseudomonas aeruginosa PAO1. Он подвергся наиболее обширным исследованиям и может считаться прототипом сидерофоров.
- ^ С. Венденбаум; П. Деманж; А. Делл; Дж. М. Мейер; М.А. Абдалла (1983). «Структура пиовердина Ра, сидерофор синегнойной палочки». Буквы тетраэдра . 24 (44): 4877–4880. DOI : 10.1016 / S0040-4039 (00) 94031-0 .
- ^ Menhart, N .; Thariath, A .; Вишваната, Т. (1991). «Характеристика пиовердинов Azotobacter vinelandii ATCC 12837 в отношении гетерогенности». Биология металлов . 4 (4): 223–32. DOI : 10.1007 / bf01141185 . PMID 1838001 . S2CID 8712926 .
- ^ a b c Ламонт, Иэн Л .; Beare, Paul A .; Охснер, Урс; Василь, Адриана I .; Василь, Михаил Л. (2002-05-14). «Сидерофор-опосредованная передача сигналов регулирует продукцию фактора вирулентности у Pseudomonasaeruginosa» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (10): 7072–7077. Bibcode : 2002PNAS ... 99.7072L . DOI : 10.1073 / pnas.092016999 . ISSN 0027-8424 . PMC 124530 . PMID 11997446 .
- ^ a b c Банин, Эхуд; Василь, Михаил Л .; Гринберг, Э. Питер (2005-08-02). «Формирование биопленок железа и синегнойной палочки» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (31): 11076–11081. Bibcode : 2005PNAS..10211076B . DOI : 10.1073 / pnas.0504266102 . ISSN 0027-8424 . PMC 1182440 . PMID 16043697 .
- ^ a b c d Кириенко, Наталья В .; Кириенко, Даниил Р .; Ларкинс-Форд, Иона; Уэлби, Каролина; Рувкун, Гэри; Осубель, Фредерик М. (17 апреля 2013 г.). «Pseudomonas aeruginosa нарушает гомеостаз железа Caenorhabditis elegans, вызывая гипоксический ответ и смерть» . Клеточный хозяин и микроб . 13 (4): 406–416. DOI : 10.1016 / j.chom.2013.03.003 . ISSN 1934-6069 . PMC 3641844 . PMID 23601103 .
- ^ a b c Кириенко, Наталья В .; Ausubel, Frederick M .; Рувкун, Гэри (10.02.2015). «Митофагия придает устойчивость к опосредованному сидерофором уничтожению Pseudomonas aeruginosa» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (6): 1821–1826. Bibcode : 2015PNAS..112.1821K . DOI : 10.1073 / pnas.1424954112 . ISSN 1091-6490 . PMC 4330731 . PMID 25624506 .
- ^ Минандри, Фабриция; Импери, Франческо; Франжипани, Эмануэла; Бончи, Карло; Визаджио, Даниэла; Факкини, Марселла; Паскуали, Паоло; Брагонзи, Алессандра; Виска, Паоло (1 августа 2016 г.). «Роль систем захвата железа в вирулентности синегнойной палочки и инфекции дыхательных путей» . Инфекция и иммунитет . 84 (8): 2324–2335. DOI : 10.1128 / IAI.00098-16 . ISSN 1098-5522 . PMC 4962624 . PMID 27271740 .
- ^ Йодер, Майкл Ф .; Кисаалита, Уильям С. (01.01.2011). «Железоспецифичность биосенсора на основе флуоресцентного пиовердина, иммобилизованного в золь-гель стекле» . Журнал биологической инженерии . 5 : 4. DOI : 10,1186 / 1754-1611-5-4 . ISSN 1754-1611 . PMC 3114707 . PMID 21554740 .
- ^ Hohlneicher, U .; Schäfer, M .; Fuchs, R .; Будзикевич, Х. (11.10.2016). «Феррибактины как биосинтетические предшественники пиовердинов Pseudomonas siderophores» . Zeitschrift für Naturforschung С . 56 (3–4): 308–310. DOI : 10.1515 / ZNC-2001-3-423 . ISSN 0939-5075 . PMID 11371026 .
- ^ Виска, Паоло; Импери, Франческо; Ламонт, Иэн Л. (01.01.2007). «Пиовердин сидерофоры: от биогенеза к биозначению». Тенденции в микробиологии . 15 (1): 22–30. DOI : 10.1016 / j.tim.2006.11.004 . ISSN 0966-842X . PMID 17118662 .
- ^ Budzikiewicz, Н (1997). «Сидерофоры флуоресцентных псевдомонад». Zeitschrift für Naturforschung С . 52 (11–12): 713–720. DOI : 10.1515 / ZNC-1997-11-1201 . PMID 9463934 . S2CID 26196277 .
- ^ а б Мейер, JM (2000). «Пиовердины: пигменты, сидерофоры и потенциальные таксономические маркеры флуоресцентных видов Pseudomonas». Архив микробиологии . 174 (3): 135–142. DOI : 10.1007 / s002030000188 . PMID 11041343 . S2CID 13283224 .
- ^ Ламонт, Иллинойс; Мартин, LW (2003). «Идентификация и характеристика новых генов синтеза пиовердина у Pseudomonas aeruginosa». Микробиология . 149 (4): 833–842. DOI : 10.1099 / mic.0.26085-0 . PMID 12686626 .
- ^ a b Импери, Франческо; Масаи, Франческо; Факкини, Марселла; Франжипани, Эмануэла; Визаджио, Даниэла; Леони, Ливия; Брагонзи, Алессандра; Виска, Паоло (30 апреля 2013 г.). «Переназначение антимикотического препарата флуцитозина для подавления патогенности синегнойной палочки» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (18): 7458–7463. Bibcode : 2013PNAS..110.7458I . DOI : 10.1073 / pnas.1222706110 . ISSN 1091-6490 . PMC 3645532 . PMID 23569238 .
- ^ Кириенко, Даниил Р .; Ревтович, Алексей В .; Кириенко, Наталья В. (2016-08-01). «Фенотипический скрининг с высоким содержанием идентифицирует фторуридин как ингибитор биосинтеза пиовердина и вирулентности Pseudomonas aeruginosa» . мСфера . 1 (4): e00217–16. DOI : 10,1128 / mSphere.00217-16 . ISSN 2379-5042 . PMC 4999921 . PMID 27579370 .
- ^ Корнелис, П; Hohnadel, D; Мейер, JM (1989). «Доказательства различных систем захвата железа, опосредованных пиовердином, среди штаммов Pseudomonas aeruginosa» . Заражение иммунной . 57 (11): 3491–3497. DOI : 10.1128 / IAI.57.11.3491-3497.1989 . PMC 259858 . PMID 2509364 .
- ^ Hohnadel, Дэни; Хаас, Дитер; Мейер, Жан-Мари (1986-09-01). «Картирование мутаций, влияющих на продукцию пиовердина в Pseudomonas aeruginosa» . Письма о микробиологии FEMS . 36 (2–3): 195–199. DOI : 10.1111 / j.1574-6968.1986.tb01695.x . ISSN 0378-1097 .
- ^ Stintzi, A .; Johnson, Z .; Stonehouse, M .; Ochsner, U .; Мейер, JM; Василь, М.Л .; Пул, К. (1999-07-01). «Кластер pvc генов Pseudomonas aeruginosa: роль в синтезе хромофора пиовердина и регуляция с помощью PtxR и PvdS» . Журнал бактериологии . 181 (13): 4118–4124. DOI : 10.1128 / JB.181.13.4118-4124.1999 . ISSN 0021-9193 . PMC 93907 . PMID 10383985 .
- ^ Кларк-Пирсон, Майкл Ф .; Брэди, Шон Ф. (2008-10-01). «Паэрукумарин, новый метаболит, продуцируемый кластером генов pvc из Pseudomonas aeruginosa» . Журнал бактериологии . 190 (20): 6927–6930. DOI : 10.1128 / JB.00801-08 . ISSN 1098-5530 . PMC 2566218 . PMID 18689486 .
- ^ Budzikiewicz, Н (1993). «Вторичные метаболиты флуоресцентных псевдомонад». FEMS Microbiol Rev . 10 (3–4): 209–228. DOI : 10.1111 / j.1574-6968.1993.tb05868.x . PMID 8318257 .
- ^ Стинци, А; Корнелис, П; Hohnadel, D; Мейер, JM; Дин, C; Пул, К; Курамбас, S; Кришнапиллаи, V (1996). «Новый ген (ы) биосинтеза пиовердина Pseudomonas aeruginosa PAO» . Микробиология . 142 (5): 1181–1190. DOI : 10.1099 / 13500872-142-5-1181 . PMID 8704959 .
- ^ a b c Cézard, C .; Farvacques, N .; Сонет, П. (01.01.2015). «Химия и биология пиовердинов, первичных сидерофоров Pseudomonas». Современная лекарственная химия . 22 (2): 165–186. DOI : 10.2174 / 0929867321666141011194624 . ISSN 1875-533X . PMID 25312210 .
- ^ Машиах, Рой; Мейлер, Майкл М. (2013-04-05). «Полный синтез пиовердина D». Органические буквы . 15 (7): 1702–1705. DOI : 10.1021 / ol400490s . ISSN 1523-7052 . PMID 23530778 .
- ^ Takase, H .; Nitanai, H .; Хосино, К .; Отани, Т. (2000-04-01). «Влияние производства сидерофоров на инфекции Pseudomonas aeruginosa у мышей с ослабленным иммунитетом» . Инфекция и иммунитет . 68 (4): 1834–1839. DOI : 10.1128 / iai.68.4.1834-1839.2000 . ISSN 0019-9567 . PMC 97355 . PMID 10722571 .
- ^ Becerra, C .; Albesa, I .; Эрасо, Эй Джей (13 июля 2001 г.). «Лейкотоксичность пиовердина, продукция активных форм кислорода и влияние УФ-излучения». Сообщения о биохимических и биофизических исследованиях . 285 (2): 414–418. DOI : 10.1006 / bbrc.2001.5188 . PMID 11444858 .
- ^ Бодилис, Жосселин; Гизель, Барт; Осаянде, Джули; Маттис, Сандра; Пирне, Жан-Поль; Денайер, Сара; Де Вос, Даниэль; Корнелис, Пьер (2009-08-01). «Распределение и эволюция рецепторов феррипиовердина у синегнойной палочки». Экологическая микробиология . 11 (8): 2123–2135. DOI : 10.1111 / j.1462-2920.2009.01932.x . ISSN 1462-2920 . PMID 19397675 .
- ^ Вейгерт, Майкл; Кюммерли, Рольф (12.07.2017). «Физические границы сотрудничества общественных благ между прикрепленными к поверхности бактериальными клетками» . Proc. R. Soc. B . 284 (1858): 20170631. DOI : 10.1098 / rspb.2017.0631 . ISSN 0962-8452 . PMC 5524494 . PMID 28701557 .
- ^ Баклинг, Ангус; Харрисон, Фрейя; Вос, Михиэль; Брокхерст, Майкл А .; Гарднер, Энди; West, Stuart A .; Гриффин, Эшли (2007-11-01). «Сидерофор-опосредованное сотрудничество и вирулентность в синегнойной палочке» . FEMS Microbiology Ecology . 62 (2): 135–141. DOI : 10.1111 / j.1574-6941.2007.00388.x . ISSN 0168-6496 . PMID 17919300 .
- ^ а б Кюммерли, Рольф; Браун, Сэм П. (2010-11-02). «Молекулярные и регуляторные свойства общественного блага определяют эволюцию сотрудничества» . Труды Национальной академии наук . 107 (44): 18921–18926. Bibcode : 2010PNAS..10718921K . DOI : 10.1073 / pnas.1011154107 . ISSN 0027-8424 . PMC 2973908 . PMID 20944065 .
- ^ Гриффин, Эшли С .; West, Stuart A .; Баклинг, Ангус (2004). «Сотрудничество и конкуренция в патогенных бактериях». Природа . 430 (7003): 1024–1027. Bibcode : 2004Natur.430.1024G . DOI : 10,1038 / природа02744 . hdl : 1842/698 . ISSN 1476-4687 . PMID 15329720 . S2CID 4429250 .
- ^ Запад, Стюарт A .; Гриффин, Эшли С .; Гарднер, Энди; Диггл, Стивен П. (2006). «Теория социальной эволюции микроорганизмов». Обзоры природы микробиологии . 4 (8): 597–607. DOI : 10.1038 / nrmicro1461 . ISSN 1740-1534 . PMID 16845430 . S2CID 18451640 .
- ^ Kümmerli, R .; Санторелли, штат Луизиана; Granato, ET; Dumas, Z .; Добай, А .; Гриффин, А.С.; Запад, SA (2015-12-01). «Коэволюционная динамика между производителями общественных благ и мошенниками в бактерии Pseudomonas aeruginosa» (PDF) . Журнал эволюционной биологии . 28 (12): 2264–2274. DOI : 10.1111 / jeb.12751 . ISSN 1420-9101 . PMID 26348785 . S2CID 826683 .
- ^ Dumas, Z .; Кюммерли, Р. (2012-03-01). «Стоимость подбора правил сотрудничества для читов в бактериальных метапопуляциях» . Журнал эволюционной биологии . 25 (3): 473–484. DOI : 10.1111 / j.1420-9101.2011.02437.x . ISSN 1420-9101 . PMID 22168669 . S2CID 19132153 .
- ^ Росс-Гиллеспи, Адин; Гарднер, Энди; West, Stuart A .; Гриффин, Эшли С. (01.09.2007). «Частотная зависимость и сотрудничество: теория и тест с бактериями» . Американский натуралист . 170 (3): 331–342. DOI : 10.1086 / 519860 . ISSN 0003-0147 . PMID 17879185 . S2CID 14248496 .
- ^ Росс-Гиллеспи, Адин; Гарднер, Энди; Buckling, Ангус; West, Stuart A .; Гриффин, Эшли С. (01.09.2009). «Зависимость плотности и сотрудничество: теория и тест с бактериями» . Эволюция . 63 (9): 2315–2325. DOI : 10.1111 / j.1558-5646.2009.00723.x . ISSN 1558-5646 . PMID 19453724 . S2CID 5699402 .
- ^ Кюммерли, Рольф; Гриффин, Эшли С .; West, Stuart A .; Buckling, Ангус; Харрисон, Фрейя (2007-10-07). «Вязкая среда способствует сотрудничеству патогенной бактерии Pseudomonas aeruginosa» . Труды Лондонского королевского общества B: биологические науки . 276 (1672): 3531–3538. DOI : 10.1098 / rspb.2009.0861 . ISSN 0962-8452 . PMC 2817189 . PMID 19605393 .
- ^ Брюс, Джон Б .; Купер, Гай А .; Шабас, Элен; West, Stuart A .; Гриффин, Эшли С. (2017-10-01). «Обман и устойчивость к обману в естественных популяциях бактерии Pseudomonas fluorescens» . Эволюция . 71 (10): 2484–2495. DOI : 10.1111 / evo.13328 . ISSN 1558-5646 . PMID 28833073 . S2CID 3485902 .
- ^ Бутайте, Елена; Баумгартнер, Майкл; Уайдер, Стефан; Кюммерли, Рольф (04.09.2017). «Обман сидерофоров и устойчивость к обману формируют конкуренцию за железо в почвенных и пресноводных сообществах Pseudomonas» . Nature Communications . 8 (1): 414. Bibcode : 2017NatCo ... 8..414B . DOI : 10.1038 / s41467-017-00509-4 . ISSN 2041-1723 . PMC 5583256 . PMID 28871205 .
- ^ Briskot, G .; Тараз, К .; Будзикевич, Х. (1989). «Бактериальные компоненты, XXXVII. Сидерофоры пиовердинового типа из Pseudomonas aeruginosa». Liebigs Ann Chem . 1989 (4): 375–384. DOI : 10.1002 / jlac.198919890164 .
- ^ a b c d e Longerich, I; Тараз, К; Budzikiewicz, H; Цай, L; Мейер, JM (1993). «Псевдовердин, соединение, родственное хромофору пиовердина из штамма Pseudomonas aeruginosa, неспособного продуцировать пиовердин». Z Naturforsch С . 48 (5–6): 425–429. DOI : 10.1515 / ZNC-1993-5-605 . PMID 8363709 . S2CID 29269780 .