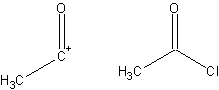Ретросинтетический анализ - это метод решения проблем при планировании органического синтеза . Это достигается путем преобразования целевой молекулы в более простые структуры-предшественники независимо от любой потенциальной реакционной способности / взаимодействия с реагентами. Каждый материал-прекурсор исследуют одним и тем же методом. Эта процедура повторяется до тех пор, пока не будут получены простые или коммерчески доступные структуры. Эти более простые / коммерчески доступные соединения можно использовать для синтеза целевой молекулы. Э. Дж. Кори формализовал эту концепцию в своей книге «Логика химического синтеза» . [1] [2] [3]
Сила ретросинтетического анализа становится очевидной при разработке синтеза. Целью ретросинтетического анализа является структурное упрощение. Часто синтез будет иметь более одного возможного пути синтеза. Ретросинтез хорошо подходит для открытия различных синтетических маршрутов и их логического и простого сравнения. [4] С базой данных можно обращаться на каждом этапе анализа, чтобы определить, существует ли уже компонент в литературе. В этом случае дальнейшее исследование этого комплекса не потребуется. Если это соединение существует, это может быть отправной точкой для дальнейших шагов по достижению синтеза.
Определения [ править ]
- Отключение
- Этап ретросинтеза, включающий разрыв связи с образованием двух (или более) синтонов .
- Ретрон
- Минимальная молекулярная субструктура, допускающая определенные преобразования.
- Ретросинтетическое дерево
- Ориентированный ациклический граф нескольких (или всех) можно retrosyntheses из одной цели.
- Synthon
- Фрагмент соединения, которое способствует синтезу, полученный из этой целевой молекулы. Синтон и соответствующий коммерчески доступный синтетический эквивалент показаны ниже:
- Цель
- Желаемое конечное соединение.
- Преобразовать
- Обратная синтетическая реакция; формирование исходных материалов из единого продукта.
Пример [ править ]
Пример позволит легко понять концепцию ретросинтетического анализа.
При планировании синтеза фенилуксусной кислоты выделяют два синтона. Нуклеофильная группа «-COOH» и электрофильная группа «PhCH 2 + ». Конечно, оба синтона как таковые не существуют; синтетические эквиваленты, соответствующие синтонам, реагируют с получением желаемого продукта. В этом случае цианид - анион представляет собой синтетический эквивалент для - СООН синтона, в то время как бензилбромид это синтетический эквивалент для бензилового синтона.
Таким образом, синтез фенилуксусной кислоты, определенный ретросинтетическим анализом:
- PhCH 2 Br + NaCN → PhCH 2 CN + NaBr
- PhCH 2 CN + 2 H 2 O → PhCH 2 COOH + NH 3
На самом деле, фенилуксусная кислота была синтезирована из цианистого бензила , [5] сами по себе , подготовленной аналогичной реакции бензилхлорида с цианидом натрия . [6]
Стратегии [ править ]
Функциональные групповые стратегии [ править ]
Манипуляции с функциональными группами могут привести к значительному снижению молекулярной сложности.
Стереохимические стратегии [ править ]
Многочисленные химические мишени предъявляют определенные стереохимические требования. Стереохимические преобразования (такие как перегруппировка Клайзена и реакция Мицунобу ) могут удалить или передать желаемую хиральность, что упрощает цель.
Стратегии "структура-цель" [ править ]
Направление синтеза к желаемому промежуточному звену может значительно сузить фокус анализа. Это позволяет использовать методы двунаправленного поиска.
Стратегии на основе преобразований [ править ]
Применение преобразований к ретросинтетическому анализу может привести к значительному снижению молекулярной сложности. К сожалению, мощные ретроны, основанные на трансформации, редко присутствуют в сложных молекулах, и часто требуются дополнительные этапы синтеза, чтобы установить их присутствие.
Топологические стратегии [ править ]
Идентификация одного или нескольких разрывов ключевых связей может привести к идентификации ключевых подструктур или затруднить идентификацию преобразований перегруппировки, чтобы идентифицировать ключевые структуры.
- Приветствуются отключения, сохраняющие кольцевые структуры.
- Отключения, которые создают кольца, состоящие из более чем 7 элементов, не приветствуются.
- Отключение требует творчества.
См. Также [ править ]
Ссылки [ править ]
- ^ EJ Кори, XM. Ченг (1995). Логика химического синтеза . Нью-Йорк: Вили. ISBN 978-0-471-11594-6.
- ^ EJ Кори (1988). «Ретросинтетическое мышление - основы и примеры». Chem. Soc. Откр. 17 : 111–133. DOI : 10.1039 / CS9881700111 .
- ^ EJ Corey (1991). «Логика химического синтеза: многоступенчатый синтез сложных карбогенных молекул (Нобелевская лекция)» (Перепечатка) . Angewandte Chemie International Edition на английском языке . 30 (5): 455–465. DOI : 10.1002 / anie.199104553 .
- ^ Джеймс Лоу и др.: «Дизайнер маршрутов: инструмент ретросинтетического анализа, использующий автоматическое создание ретросинтетических правил», Журнал химической информации и моделирования (ACS JCIM) Дата публикации (Интернет): 6 февраля 2009 г .; DOI : 10.1021 / ci800228y , http://pubs.acs.org/doi/abs/10.1021/ci800228y
- ^ Вильгельм Веннер (1963). «Фенилацетамид» . Органический синтез .; Сборник , 4 , с. 760
- ^ Роджер Адамс; А.Ф. Таль (1941). «Цианид бензила» . Органический синтез .CS1 maint: несколько имен: список авторов ( ссылка ); Сборник , 1 , стр. 107
Внешние ссылки [ править ]
| В Викицитаторе есть цитаты, связанные с: ретросинтетическим анализом |
- Центр молекулярной и биомолекулярной информатики
- Презентация ARChem Route Designer, ACS, Филадельфия, сентябрь 2008 г. Для получения дополнительной информации об ARChem см. Страницы SimBioSys .
- Инструмент планирования ретросинтеза: ICSynth от InfoChem
- Spaya, Бесплатное программное обеспечение, предложенное Iktos