| Субталамическое ядро | |
|---|---|
 Корональные срезы головного мозга человека, показывающие базальные ганглии (внешний бледный шар (GPe) и внутренний бледный шар (GPi)), субталамическое ядро (STN) и черную субстанцию (SN). | |
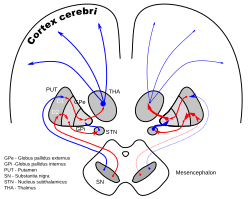 DA-петли при болезни Паркинсона | |
| Подробности | |
| Часть | Базальный ганглий |
| Идентификаторы | |
| латинский | ядро subthalamicus |
| MeSH | D020531 |
| NeuroNames | 435 |
| НейроЛекс ID | nlx_anat_1010002 |
| TA98 | A14.1.08.702 |
| TA2 | 5709 |
| FMA | 62035 |
| Анатомические термины нейроанатомии | |
Гипоталамическое ядро представляет собой небольшое линзообразное ядро в головном мозге , где она, с функциональной точки зрения, часть базальных ганглиев системы. С точки зрения анатомии, это основная часть подталамуса . Судя по названию, субталамическое ядро расположено вентральнее от таламуса . Он также расположен дорсальнее черной субстанции и медиальнее внутренней капсулы . Она была впервые описана Жюль Бернард Луйсом в 1865 году, [1] , а термин Corpus Luysi или тело ЛУЙСА до сих пор иногда используется.
Анатомия [ править ]
Структура [ править ]
Основной тип нейронов, обнаруживаемых в субталамическом ядре, имеет довольно длинные, редко шипастые дендриты . [2] [3] В более центральных нейронах дендритные ветви имеют более эллипсоидальную форму. [4] Размеры этих беседок (1200 мкм, 600 мкм и 300 мкм) одинаковы для многих видов, включая крыс, кошек, обезьян и человека, что необычно. Однако количество нейронов увеличивается с увеличением размера мозга, а также с увеличением внешних размеров ядра. Основные нейроны глутаматергические , что придает им особое функциональное положение в системе базальных ганглиев. В организме человека также присутствует небольшое количество (около 7,5%) ГАМКергических интернейроны, которые участвуют в локальной цепи; однако дендритные ветви субталамических нейронов уклоняются от границы и в первую очередь взаимодействуют друг с другом. [5]
Афферентные аксоны [ править ]
Субталамическое ядро получает свой основной входной сигнал от внешнего бледного шара (GPe) [6] не столько через ansa lenticularis, как часто говорят, сколько через излучающие волокна, сначала пересекающие медиальный pallidum и внутреннюю капсулу (см. Рисунок). Эти афференты являются ГАМКергическими, подавляя нейроны в субталамическом ядре. Возбуждающие, глутаматергические сигналы поступают из коры головного мозга (особенно моторной коры) и из парафасцикулярной части центрального комплекса . Субталамическое ядро также получает нейромодулирующие сигналы, особенно дофаминергические аксоны из черной субстанции.pars compacta. [7] Он также получает входные данные от педункулопонтинового ядра .
Эффектные цели [ править ]
Аксоны нейронов субталамического ядра покидают ядро дорсально. Эфферентные аксоны глутаматергические (возбуждающие). За исключением соединения со стриатумом (17,3% у макак), большинство основных нейронов субталамической области являются многоцелевыми и направлены на другие элементы ядра базальных ганглиев. [8] Некоторые направляют аксоны к черной субстанции медиально и к медиальному и латеральному ядрам паллидума латерально (3 мишени, 21,3%). Некоторые из них являются двумя мишенями с латеральным паллидумом и черной субстанцией (2,7%) или латеральным паллидумом и медиальной частью (48%). Реже - единственная цель для латерального паллидума. В паллидуме субталамические окончания заканчиваются полосами, параллельными паллидальной границе. [8] [9]Когда все аксоны, достигающие этой мишени, добавляются, основное влияние субталамического ядра в 82,7% случаев оказывается внутренним бледным шаром (GPi).
Некоторые исследователи сообщили о внутренних коллатералях аксонов . [10] Однако функциональных доказательств этому мало.
Физиология [ править ]
Субталамическое ядро [ править ]
Первые внутриклеточные электрические записи субталамических нейронов были выполнены с использованием острых электродов в препарате крысиного среза. [ необходима цитата ] В этих записях были сделаны три ключевых наблюдения, все три из которых преобладали в последующих отчетах о субталамических свойствах возгорания. Первое наблюдение заключалось в том, что в отсутствие инъекции тока или синаптической стимуляции большинство клеток запускались спонтанно. Второе наблюдение заключается в том, что эти клетки способны временно срабатывать на очень высоких частотах. Третье наблюдение касается нелинейного поведения, когда клетки временно деполяризованы после гиперполяризации ниже -65 мВ. Затем они могут задействовать управляемые по напряжению кальциевые и натриевые токи, чтобы вызвать всплески потенциалов действия.
Несколько недавних исследований были сосредоточены на способности субталамических нейронов управлять автономным ритмом. Эти клетки часто называют «пейсмейкерами с быстрым импульсом» [11], поскольку они могут генерировать потенциалы спонтанного действия с частотой от 80 до 90 Гц у приматов.
Колебательная и синхронная активность [12] [13] , вероятно, является типичным паттерном разряда в субталамических нейронах, зарегистрированным у пациентов и животных моделей, характеризующимся потерей дофаминергических клеток в компактной части черной субстанции , которая является основной патологией, лежащей в основе болезни Паркинсона. болезнь .
Латеропаллидо-субталамическая система [ править ]
Сильные реципрокные связи связывают субталамическое ядро и внешний сегмент бледного шара . Оба являются кардиостимуляторами с высокой скоростью. Считается, что вместе они составляют «центральный кардиостимулятор базальных ганглиев» [14] с синхронными импульсами.
Соединение латерального pallidum с субталамическим ядром также является соединением в системе базальных ганглиев , где сокращение между эмиттерными / принимающими элементами, вероятно, наиболее сильно. Что касается объема, у людей размер латерального паллидума составляет 808 мм³, а субталамического ядра - всего 158 мм³. [15] Это выражается в количестве нейронов, что представляет собой сильное сжатие с потерей точности карты.
Некоторые аксоны от латерального pallidum переходят в полосатое тело. [16] На активность медиального паллидума влияет афферентность латерального паллидума и субталамического ядра. [17] То же самое для черной субстанции pars reticulata . [9] Субталамическое ядро отправляет аксоны другому регулятору: педункуло-понтинному комплексу (id).
Считается, что латеропаллидо-субталамическая система играет ключевую роль в формировании паттернов активности, наблюдаемых при болезни Паркинсона . [18]
Патофизиология [ править ]
Хроническая стимуляция STN, называемая глубокой стимуляцией мозга (DBS), используется для лечения пациентов с болезнью Паркинсона . В первую очередь стимулируются терминальные разветвления афферентных аксонов, которые изменяют активность субталамических нейронов. Однако на срезах таламуса мышей [19] было показано, что стимул также заставляет близлежащие астроциты выделять аденозинтрифосфат (АТФ), предшественник аденозина (через катаболический процесс). В свою очередь, активация аденозинового рецептора A1 подавляет передачу возбуждения в таламусе, имитируя абляцию субталамического ядра.
Одностороннее разрушение или разрушение субталамического ядра, которое обычно может происходить в результате инсульта малого сосуда у пациентов с диабетом, гипертонией или курением в анамнезе, вызывает гемибаллизм .
Поскольку одна из предполагаемых функций STN заключается в контроле над импульсами, дисфункция в этой области связана с обсессивно-компульсивным расстройством . [20] Искусственная стимуляция STN показала некоторые перспективы в коррекции тяжелого импульсивного поведения и может позже использоваться в качестве альтернативного лечения расстройства. [21]
Функция [ править ]
Функция STN неизвестна, но современные теории рассматривают его как компонент системы контроля базальных ганглиев, который может выполнять выбор действия. Считается, что он реализует так называемый «гиперпрямой путь» моторного контроля, в отличие от прямых и непрямых путей, реализуемых где-нибудь в базальных ганглиях. Также было показано, что дисфункция STN увеличивает импульсивность у людей, которым предъявлены два одинаково полезных стимула. [22]
Исследования показали, что субталамус является экстрапирамидным центром. Он контролирует мышечные реакции, и повреждение может привести к гемибаллизму (сильному раскачиванию руки и ноги с одной стороны тела). [23]
Дополнительные изображения [ править ]
Венечный отдел головного мозга непосредственно перед мостом. Субталамическое ядро обозначено как «Ядро Луйса».
См. Также [ править ]
| Викискладе есть медиафайлы, связанные с субталамическим ядром . |
- Базальные ганглии приматов
Ссылки [ править ]
- ^ Luys, Жюль Бернар (1865). Recherches sur le système cérébro-spinal, sa structure, ses fonctions et ses maladies (на французском). Париж: Байер.
- ^ Afsharpour, S. (1985). «Световой микроскопический анализ субталамических нейронов крыс, пропитанных методом Гольджи». Журнал сравнительной неврологии . 236 (1): 1–13. DOI : 10.1002 / cne.902360102 . PMID 4056088 .
- ^ Rafols, JA; Фокс, Калифорния (1976). «Нейроны в субталамическом ядре приматов: исследование Гольджи и электронно-микроскопическое исследование». Журнал сравнительной неврологии . 168 (1): 75–111. DOI : 10.1002 / cne.901680105 . PMID 819471 .
- ^ Ельник, J .; Першерон, Г. (1979). «Субталамические нейроны приматов: количественная и сравнительная анатомия». Неврология . 4 (11): 1717–1743. DOI : 10.1016 / 0306-4522 (79) 90030-7 . PMID 117397 .
- ^ Левеск JC; Родитель А. (2005). «ГАМКергические интернейроны в субталамическом ядре человека». Расстройства движения . 20 (5): 574–584. DOI : 10.1002 / mds.20374 . PMID 15645534 .
- ^ Canteras NS, Самма-Lagnado SJ, Silva BA, Ricardo JA (апрель 1990). «Афферентные связи субталамического ядра: комбинированное ретроградное и антероградное исследование пероксидазы хрена на крысах». Brain Res . 513 (1): 43–59. DOI : 10.1016 / 0006-8993 (90) 91087-W . PMID 2350684 .
- ^ Cragg SJ; Baufreton J .; Xue Y .; Болам Дж. П. и Беван М. Д. (2004). «Синаптическое высвобождение дофамина в субталамическом ядре». Европейский журнал нейробиологии . 20 (7): 1788–1802. doi : 10.1111 / j.1460-9568.2004.03629.x . PMID 15380000 .
- ^ a b Наута HJ, Коул М (июль 1978 г.). «Эфферентные проекции субталамического ядра: авторадиографическое исследование на обезьянах и кошках». J. Comp. Neurol . 180 (1): 1–16. DOI : 10.1002 / cne.901800102 . PMID 418083 .
- ^ a b Smith, Y .; Hazrati, LN .; Родитель, А. (1990). «Эфферентные проекции субталамического ядра у беличьей обезьяны, изученные с помощью метода антероградного отслеживания PHA-L». Журнал сравнительной неврологии . 294 (2): 306–323. DOI : 10.1002 / cne.902940213 . PMID 2332533 .
- ^ Кита, H .; Чанг, HT и Китай, ST (1983). «Морфология внутриклеточно меченых субталамических нейронов крысы: световой микроскопический анализ». Неврология . 215 (3): 245–257. DOI : 10.1002 / cne.902150302 . PMID 6304154 .
- ^ Surmeier DJ ; Мерсер Дж. Н. и Чан К. С. (2005). «Автономные кардиостимуляторы в базальных ганглиях: кому вообще нужны возбуждающие синапсы?». Текущее мнение в нейробиологии . 15 (3): 312–318. DOI : 10.1016 / j.conb.2005.05.007 . PMID 15916893 .
- ^ Леви Р .; Hutchison WD; Лозано А.М., Достровский Ю.О. (2000). «Высокочастотная синхронизация нейрональной активности в субталамическом ядре у пациентов с паркинсонизмом и тремором конечностей» . Журнал неврологии . 20 (20): 7766–7775. DOI : 10.1523 / JNEUROSCI.20-20-07766.2000 . PMC 6772896 . PMID 11027240 .
- ^ Линтас А .; Silkis IG; Albéri L .; Вилла АЭП (2012 г.). «Дефицит дофамина увеличивает синхронизированную активность в субталамическом ядре крысы» (PDF) . Исследование мозга . 1434 (3): 142–151. DOI : 10.1016 / j.brainres.2011.09.005 . PMID 21959175 .
- ^ Plenz, Д. & Китай, ST (1999). «Пейсмейкер базальных ганглиев, образованный субталамическим ядром и внешним бледным шаром». Природа . 400 (6745): 677–682. DOI : 10.1038 / 23281 . PMID 10458164 .
- ^ Yelnik, J. (2002). «Функциональная анатомия базальных ганглиев». Расстройства движения . 17 (Приложение 3): S15 – S21. DOI : 10.1002 / mds.10138 . PMID 11948751 .
- ^ Сато, Ф .; Lavallée, P .; Левеск М. и Родитель А. (2000). «Одноаксонное отслеживание нейронов внешнего сегмента бледного шара у приматов». Журнал сравнительной неврологии . 417 (1): 17–31. DOI : 10.1002 / (SICI) 1096-9861 (20000131) 417: 1 <17 :: AID-CNE2> 3.0.CO; 2-I . PMID 10660885 .
- ^ Смит, Y .; Вичманн, Т. и ДеЛонг, М.Р. (1994). «Синаптическая иннервация нейронов во внутреннем паллидном сегменте субталамическим ядром и наружным паллидумом у обезьян». Журнал сравнительной неврологии . 343 (2): 297–318. DOI : 10.1002 / cne.903430209 . PMID 8027445 .
- ^ Bevan MD; Magill PJ; Терман Д .; Болам Дж. П. и Уилсон С. Дж. (2002). «Двигайтесь в ритм: колебания в сети субталамического ядра - внешнего бледного шара». Тенденции в неврологии . 25 (10): 525–531. DOI : 10.1016 / S0166-2236 (02) 02235-X . PMID 12220881 .
- ^ Бекар Л .; Либионка В .; Tian G .; Xu Q .; Торрес А .; Ван Х .; Lovatt D .; Williams E .; Такано Т .; Schnermann J .; Бакос Р .; Недергаард М. (2008). «Аденозин имеет решающее значение для ослабления тремора, опосредованного глубокой стимуляцией мозга». Природная медицина . 14 (1): 75–80. DOI : 10.1038 / nm1693 . PMID 18157140 .
- ^ Картер, Рита. Книга человеческого мозга . С. 58, 233.
- ^ L, Молоток; Polosan M, Jaafari N, Baup N, Welter ML, Fontaine D; и другие. (2008). «Стимуляция субталамического ядра при тяжелом обсессивно-компульсивном расстройстве». Медицинский журнал Новой Англии . 359 (20): 2121–34. DOI : 10.1056 / NEJMoa0708514 . PMID 19005196 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Франк, М .; Samanta, J .; Мустафа, А .; Шерман, С. (2007). «Держите лошадей: импульсивность, глубокая стимуляция мозга и лекарства при паркинсонизме». Наука . 318 (5854): 1309–12. DOI : 10.1126 / science.1146157 . PMID 17962524 .
- ^ Брюс Х. Робинсон (2007). Биомедицина - Учебник для практиков акупунктуры и восточной медицины . Пресс для голубого мака. п. 126. ISBN 978-1-891845-38-3. LCCN 2006940894 .
