| Черная субстанция | |
|---|---|
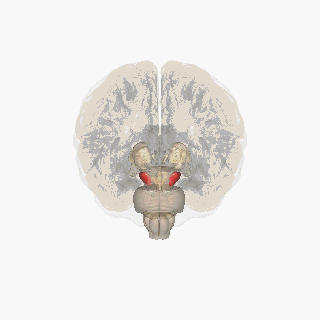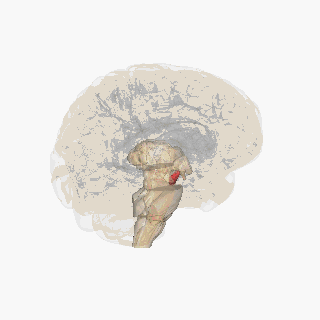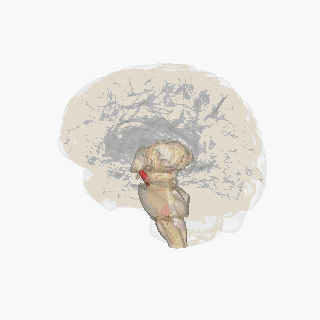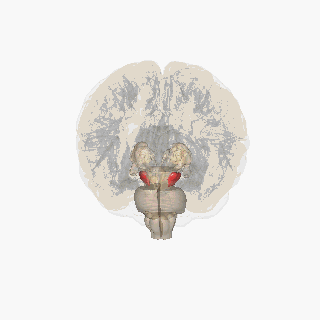 Черная субстанция выделена красным. | |
 Разрез верхнего бугорка, показывающий черную субстанцию. | |
| Подробности | |
| Часть | Средний мозг , базальные ганглии |
| Идентификаторы | |
| латинский | Черная субстанция |
| MeSH | D013378 |
| NeuroNames | 536 |
| НейроЛекс ID | birnlex_789 |
| TA98 | A14.1.06.111 |
| TA2 | 5881 |
| FMA | 67947 |
| Анатомические термины нейроанатомии | |
Черная субстанция ( SN ) представляет собой базальные ганглии структура расположен в мозге , который играет важную роль в награде и движении . Черная субстанция является латынь для «черного вещества», что отражает тот факт , что части черной субстанции появляются темнее , чем соседние районы из - за высокие уровни нейромеланина в дофаминергических нейронах . [1] Болезнь Паркинсона характеризуется потерей дофаминергических нейронов в компактной части черной субстанции . [2]
Хотя черная субстанция появляется в виде непрерывной полосы в срезах мозга, анатомические исследования показали , что это на самом деле состоит из двух частей с очень различными соединениями и функцией: в Парс компактах (SNPC) и Парс геисиЫа (SNpr). Компактная часть служит в основном выступом в цепи базальных ганглиев, снабжая полосатое тело дофамином. Pars reticulata передает сигналы от базальных ганглиев множеству других структур мозга. [3]
Структура [ править ]
Черная субстанция вместе с четырьмя другими ядрами является частью базальных ганглиев . Это самое большое ядро в среднем мозге, расположенное дорсально от ножек головного мозга . У людей есть две черные субстанции, по одной с каждой стороны от средней линии.
SN делится на две части: pars reticulata (SNpr) и pars compacta (SNpc), которая лежит медиальнее pars reticulata. Иногда упоминается третья область, латеральная часть, хотя обычно ее классифицируют как часть ретикулатной части. (SNpr) и внутренний бледный шар (GPi) разделены внутренней капсулой . [4]
Pars reticulata [ править ]
Pars reticulata имеет сильное структурное и функциональное сходство с внутренней частью бледного шара. Их иногда считают частями одной и той же структуры, разделенной белым веществом внутренней капсулы. Подобно нейронам бледного шара, нейроны pars reticulata в основном являются ГАМКергическими . [ необходима цитата ]
Афферентные связи [ править ]
Основной вклад в SNpr поступает из полосатого тела . Он идет двумя путями, известными как прямой и косвенный . Прямой путь состоит из аксонов от средних колючих клеток полосатого тела, которые проецируются непосредственно в pars reticulata. Непрямой путь состоит из трех звеньев: проекция от колючих клеток средней полосы стриатума на внешнюю часть бледного шара ; ГАМКергическая проекция из бледного шара к гипоталамическому ядру , и глутаматергическая проекции из субталамического ядра в геисиЫа Парса. [5]Таким образом, активность полосатого тела через прямой путь оказывает ингибирующее действие на нейроны в (SNpr), но возбуждающее действие через непрямой путь. Прямые и непрямые пути берут начало от разных подгрупп шиповатых клеток полосатого тела: они тесно переплетены, но экспрессируют разные типы дофаминовых рецепторов, а также демонстрируют другие нейрохимические различия.
Эфферентные связи [ править ]
Значительные проекции происходят в таламус (вентральное латеральное и вентральное переднее ядра), верхний бугорок и другие каудальные ядра из pars reticulata (нигроталамический путь) [6], которые используют ГАМК в качестве своего нейромедиатора. Кроме того, эти нейроны образуют до пяти коллатералей, которые разветвляются как внутри pars compacta, так и pars reticulata, вероятно, модулируя дофаминергическую активность в pars compacta. [7]
Функция [ править ]
Черная субстанция играет важную роль в работе мозга, в частности, в движении глаз , моторном планировании , поиске вознаграждения , обучении и зависимости . Многие эффекты черной субстанции передаются через полосатое тело . Поступление нигрального дофаминергического вещества в полосатое тело через нигростриатальный путь тесно связано с функцией полосатого тела. [8]Взаимозависимость между полосатым телом и черной субстанцией можно увидеть следующим образом: когда черная субстанция электрически стимулируется, движения не происходит; тем не менее, симптомы дегенерации черной субстанции из-за болезни Паркинсона являются ярким примером влияния черной субстанции на движение. Помимо функций, опосредованных полосатым телом, черная субстанция также служит основным источником ГАМКергического ингибирования различных мишеней мозга.
Pars reticulata [ править ]
Рагз геисиЫа из черной субстанции является важным центром обработки в базальных ганглиях. ГАМКергические нейроны в сетчатой части передают окончательные обработанные сигналы базальных ганглиев в таламус и верхний бугорок . Кроме того, pars reticulata также ингибирует дофаминергическую активность в pars compacta через коллатерали аксонов, хотя функциональная организация этих связей остается неясной.
ГАМКергические нейроны ретикулатной части спонтанно запускают потенциалы действия . У крыс частота потенциалов действия составляет примерно 25 Гц. [9] Целью этих потенциалов спонтанного действия является подавление мишеней базальных ганглиев, а уменьшение подавления связано с движением. [10] Субталамическое ядро дает возбуждающий сигнал, который модулирует скорость возбуждения этих потенциалов спонтанного действия. Однако поражение субталамического ядра приводит только к 20% снижению частоты активации pars reticulata, что позволяет предположить, что генерация потенциалов действия в pars reticulata в значительной степени автономна, [11] как показано на примере роли pars reticulata в саккадических движениях глаз.. Группа ГАМКергических нейронов от pars reticulata проецируется в верхний холмик, демонстрируя высокий уровень устойчивой ингибирующей активности. [12] Проходы от хвостатого ядра к верхнему бугорку также модулируют саккадические движения глаз. Измененные паттерны возбуждения pars reticulata, такие как однократное или импульсное возбуждение, обнаруживаются при болезни Паркинсона [13] и эпилепсии . [14]
Pars compacta [ править ]
Наиболее известная функция компактов Парса является управлением двигателем , [15]хотя роль черной субстанции в двигательном контроле косвенная; электрическая стимуляция черной субстанции не приводит к движению из-за посредничества полосатого тела во влиянии движения. Компактная часть посылает возбуждающий сигнал в полосатое тело через путь D1, который возбуждает и активирует полосатое тело, что приводит к высвобождению ГАМК на бледный шар, чтобы подавить его ингибирующие эффекты на ядро таламуса. Это приводит к возбуждению таламокортикальных путей и передаче сигналов двигательных нейронов к коре головного мозга, что позволяет инициировать движение, которое отсутствует при болезни Паркинсона. Однако отсутствие нейронов pars compacta оказывает большое влияние на движение, о чем свидетельствуют симптомы болезни Паркинсона. Моторная роль компактной части может включать мелкую моторику,что было подтверждено на животных моделях с поражениями в этой области.[16]
Компактная часть активно участвует в усвоении ответов на раздражители. У приматов активность дофаминергических нейронов в нигростриатном пути увеличивается при предъявлении нового стимула. [17] Дофаминергическая активность снижается при повторном предъявлении стимула. [17] Тем не менее, поведенчески значимое предъявление стимула (т.е. вознаграждение) продолжает активировать дофаминергические нейроны в компактной части черной субстанции. Дофаминергические проекции из вентральной тегментальной области (нижняя часть «среднего мозга» или среднего мозга) в префронтальную кору (мезокортикальный путь) и в прилежащее ядро (мезолимбический путь - «мезо» относится к «из среднего мозга» ... в частности, вентральная тегментальная область) связаны с вознаграждением, удовольствием и вызывающим привыкание поведением. Компактная часть также важна в пространственном обучении, наблюдениях за окружающей средой и положением в пространстве. Повреждения компактной части кишечника приводят к дефициту обучения повторению идентичных движений [18], и некоторые исследования указывают на его участие в спинномозависимой стриарной системе памяти, основанной на ответах, которая функционирует относительно независимо от гиппокампа , который, как традиционно считается, поддерживает пространственные или эпизодические функции памяти . [19]
Компактная часть также играет роль во временной обработке и активируется во время воспроизведения во времени. Поражение компактной части приводит к временному дефициту. [20] В последнее время подозревают, что pars compacta регулирует цикл сна и бодрствования, [21] что согласуется с такими симптомами, как бессонница и нарушения быстрого сна, о которых сообщают пациенты с болезнью Паркинсона . Даже в этом случае частичный дефицит дофамина, который не влияет на моторный контроль, может привести к нарушениям цикла сна и бодрствования, особенно к REM-подобным паттернам нервной активности во время бодрствования, особенно в гиппокампе . [22]
Клиническое значение [ править ]
Черная субстанция играет решающую роль в развитии многих заболеваний и синдромов, включая паркинсонизм и болезнь Паркинсона . Существует исследование, показывающее, что высокочастотная стимуляция левой черной субстанции может вызывать преходящие симптомы острой депрессии. [23]
Болезнь Паркинсона [ править ]
Болезнь Паркинсона - нейродегенеративное заболевание , которое частично характеризуется гибелью дофаминергических нейронов в SNpc. Основные симптомы болезни Паркинсона включают тремор , акинезию , брадикинезию и скованность. [24] Другие симптомы включают нарушение осанки, утомляемость , нарушения сна и подавленное настроение . [25]
Причина гибели дофаминергических нейронов в SNpc неизвестна. Тем не менее, некоторые вклады в уникальную восприимчивость дофаминергических нейронов в компактной части pars были идентифицированы. Во-первых, дофаминергические нейроны обнаруживают аномалии в митохондриальном комплексе 1 , вызывая агрегацию альфа-синуклеина ; это может привести к неправильной обработке белков и гибели нейронов. [26] Во-вторых, дофаминергические нейроны компактной части содержат меньше кальбиндина, чем другие дофаминергические нейроны. [27] Кальбиндин - это белок, участвующий в транспорте ионов кальция внутри клеток, а избыток кальция в клетках токсичен. кальбиндинТеория объяснила бы высокую цитотоксичность болезни Паркинсона в черной субстанции по сравнению с вентральной тегментальной областью. Независимо от причины гибели нейронов пластичность компактной части очень высока; Симптомы паркинсонизма не проявляются до тех пор, пока не погибнет до 50–80% дофаминергических нейронов pars compacta. [28] Большая часть этой пластичности происходит на нейрохимическом уровне; Транспортные системы дофамина замедляются, что позволяет дофамину задерживаться на более длительные периоды времени в химических синапсах в полосатом теле. [28]
Menke, Jbabdi, Miller, Matthews and Zari (2010) использовали визуализацию тензора диффузии, а также картографирование T1 для оценки объемных различий в SNpc и SNpr у участников с болезнью Паркинсона по сравнению со здоровыми людьми. Эти исследователи обнаружили, что участники с болезнью Паркинсона постоянно имели меньшую черную субстанцию, особенно в SNpr. Поскольку SNpr связан с задним таламусом, вентральным таламусом и, в частности, с моторной корой, и поскольку участники с болезнью Паркинсона сообщают о меньших SNprs (Menke, Jbabdi, Miller, Matthews and Zari, 2010), небольшой объем этой области может быть причиной двигательных нарушений у пациентов с болезнью Паркинсона. Этот небольшой объем может быть причиной более слабых и / или менее контролируемых двигательных движений,что может привести к тремору, который часто бывает у людей с болезнью Паркинсона.[29]
Окислительный стресс и окислительное повреждение SNpc, вероятно, являются ключевыми факторами в этиологии болезни Паркинсона с возрастом. [30] Повреждения ДНК, вызванные окислительным стрессом, могут быть восстановлены процессами, модулируемыми альфа-синуклеином . [31] Альфа-синуклеин экспрессируется в черной субстанции, но его функция восстановления ДНК , по-видимому, нарушена в нейронах, несущих включения тельца Леви . [31] Эта потеря может вызвать гибель клеток.
Шизофрения [ править ]
Повышенный уровень дофамина уже давно причастен к развитию шизофрении . [32] Тем не менее, по сей день продолжается много споров вокруг этой допаминовой гипотезы шизофрении . Несмотря на разногласия, антагонисты дофамина остаются стандартным и успешным средством лечения шизофрении. Эти антагонисты включают (типичные) антипсихотические средства первого поколения, такие как бутирофеноны , фенотиазины и тиоксантены . Эти препараты в значительной степени были заменены (атипичными) антипсихотическими средствами второго поколения, такими как клозапин и палиперидон.. Как правило, эти препараты действуют не на сами нейроны, продуцирующие дофамин, а на рецепторы постсинаптического нейрона.
Другие, нефармакологические доказательства в поддержку гипотезы дофамина, относящейся к черной субстанции, включают структурные изменения компактной части, такие как уменьшение размера синаптического терминала. [33] Другие изменения в черном веществе включают повышенную экспрессию рецепторов NMDA в черном веществе и снижение экспрессии дисбиндина . Увеличение NMDA рецепторы могут указывать на причастность глутамата - допамин взаимодействий при шизофрении. Дисбиндин, который был (спорно) , связанных с шизофренией, может регулировать высвобождение допамина, и низкое выражение Дисбиндин в черной субстанции могут играть важную роль в этиологии шизофрении. [34]Из-за изменений в черной субстанции в головном мозге шизофреника со временем может появиться возможность использовать определенные методы визуализации (такие как нейромеланин-специфическая визуализация) для обнаружения физиологических признаков шизофрении в черной субстанции. [35]
Синдром деревянного сундука [ править ]
Деревянная грудная клетка , также называемый фентанил грудной стенка жесткость синдромом, является редким побочным эффектом синтетических опиоидов , таких как фентанил , Sulfentanil, альфентанил , Ремифентанил . Это приводит к общему повышению тонуса скелетных мышц . Считается, что этот механизм связан с повышенным высвобождением дофамина и пониженным высвобождением ГАМК в нервах черной субстанции / полосатого тела. Эффект наиболее выражен на мышцах грудной стенки и может привести к нарушению вентиляции. Состояние чаще всего наблюдается при анестезии, когда быстрые и высокие дозы этих препаратов вводятся внутривенно. [ необходима цитата ]
Множественная системная атрофия [ править ]
Множественная системная атрофия, характеризующаяся дегенерацией нейронов в полосатом теле и черной субстанции, ранее называлась стриатонигральной дегенерацией .
Химическая модификация черной субстанции [ править ]
Химические манипуляции и модификация черной субстанции важны в областях нейрофармакологии и токсикологии . Различные соединения, такие как леводопа и МФТП, используются в лечении и изучении болезни Паркинсона, а многие другие препараты действуют на черную субстанцию.
Амфетамин и следовые амины [ править ]
Исследования показали, что в определенных областях мозга амфетамин и следовые амины увеличивают концентрацию дофамина в синаптической щели , тем самым усиливая реакцию постсинаптического нейрона. [36] Различные механизмы, с помощью которых амфетамин и следовые амины влияют на концентрацию дофамина, были тщательно изучены и, как известно, включают как DAT, так и VMAT2 . [36] [37] [38] Амфетамин похож по структуре на дофамин и следовые амины; как следствие, он может проникать в пресинаптический нейрон через DAT, а также напрямую диффундировать через нервную мембрану. [36]Попадая в пресинаптический нейрон, амфетамин и следовые амины активируют TAAR1 , который посредством передачи сигналов протеинкиназы вызывает отток дофамина, интернализацию DAT, зависимую от фосфорилирования , и неконкурентное ингибирование обратного захвата. [36] [39] Из-за сходства между амфетамином и следами аминов, он также является субстратом для переносчиков моноаминов; как следствие, он (конкурентно) ингибирует обратный захват дофамина и других моноаминов, также конкурируя с ними за захват. [36]
Кроме того, амфетамин и следовые амины являются субстратами для нейронального переносчика везикулярных моноаминов, переносчика везикулярных моноаминов 2 (VMAT2). [38] Когда амфетамин поглощается VMAT2 , везикула выделяет (отталкивает) молекулы дофамина в цитозоль взамен. [38]
Кокаин [ править ]
Механизм действия кокаина в мозге человека включает ингибирование обратного захвата дофамина [40], что объясняет вызывающие привыкание свойства кокаина, поскольку дофамин является критическим нейротрансмиттером для вознаграждения. Однако кокаин более активен в дофаминергических нейронах вентральной тегментальной области, чем в черной субстанции. Прием кокаина увеличивает метаболизм в черной субстанции, что может объяснить изменение моторной функции, наблюдаемое у субъектов, употребляющих кокаин. [41] Ингибирование обратного захвата дофамина кокаином также подавляет активацию спонтанных потенциалов действия компактной частью. [42] Механизм, с помощью которого кокаин ингибирует обратный захват дофамина, включает его связывание с переносчиком дофамина.белок. Однако исследования показывают, что кокаин также может вызывать снижение уровней мРНК DAT [43], скорее всего, из-за блокирования кокаином дофаминовых рецепторов, а не прямого вмешательства в пути транскрипции или трансляции. [43]
Инактивация черной субстанции может оказаться возможным лечением кокаиновой зависимости. В исследовании на кокаинозависимых крысах инактивация черной субстанции с помощью имплантированных канюль значительно снизила рецидивы кокаиновой зависимости. [44]
Леводопа [ править ]
Черная субстанция является мишенью химических терапевтических средств для лечения болезни Паркинсона. Леводопа (обычно называемая L-ДОФА), предшественник дофамина, является наиболее часто назначаемым лекарством от болезни Паркинсона, несмотря на разногласия относительно нейротоксичности дофамина и L-ДОФА. [45] Препарат особенно эффективен при лечении пациентов на ранних стадиях болезни Паркинсона, хотя со временем он теряет свою эффективность. [46] Леводопа может преодолевать гематоэнцефалический барьер.и увеличивает уровень дофамина в черной субстанции, тем самым облегчая симптомы болезни Паркинсона. Недостатком лечения леводопой является то, что оно лечит симптомы болезни Паркинсона (низкий уровень дофамина), а не причину (гибель дофаминергических нейронов в черной субстанции).
MPTP [ править ]
МРТР представляет собой нейротоксин, специфичный для дофаминергических клеток головного мозга, особенно в черной субстанции. МФТП привлек к себе внимание в 1982 году, когда у потребителей героина в Калифорнии проявились симптомы болезни Паркинсона после употребления МППП, загрязненного МФТП. Пациенты, которые были жесткими и почти полностью неподвижными, ответили на лечение леводопой. О ремиссии симптомов болезни Паркинсона не сообщалось, что свидетельствует о необратимой гибели дофаминергических нейронов. [47] Предлагаемый механизм MPTP включает нарушение функции митохондрий , в том числе нарушение метаболизма и создание свободных радикалов . [48]
Вскоре после этого МФТП был протестирован на животных моделях на предмет его эффективности в индукции болезни Паркинсона (с успехом). MPTP вызывал акинезию, ригидность и тремор у приматов, и было обнаружено, что его нейротоксичность очень специфична для компактной части черной субстанции. [49] У других животных, таких как грызуны, индукция болезни Паркинсона с помощью MPTP является неполной или требует гораздо более высоких и частых доз, чем у приматов. Сегодня МФТП остается наиболее популярным методом индукции болезни Паркинсона на животных моделях . [48] [50]
История [ править ]
Черной субстанции был обнаружен в 1784 году Вик-д'Азир , [51] и Самуэль Томас Зёммеринг ссылались на эту структуру в 1791 году [52] дифференциации между черной субстанции Парс геисиЫа и компакты была впервые предложена в 1910 году Sano . [53] в 1963 году Олег Хорникиуикс заключил из своих наблюдений , что 'потеря клеток в черной субстанции (пациентов с болезнью Паркинсона) также может быть причиной дефицита дофамина в стриатуме «». [54]
Дополнительные изображения [ править ]
Дофамин и серотонин
Деградация черной субстанции, связанная с болезнью Паркинсона.
Горизонтальный срез МРТ (взвешенный по T1) с выделением, указывающим на расположение черной субстанции.
Улучшенная МРТ нейромеланина с цветными изображениями (RGB), показывающими компактную часть черной субстанции
Микрофильмирование
Ссылки [ править ]
- ^ Rabey JM, Hefti F (1990). «Синтез нейромеланина в черной субстанции крысы и человека». Журнал нейронной передачи. Секция болезни Паркинсона и деменции . 2 (1): 1–14. DOI : 10.1007 / BF02251241 . PMID 2357268 .
- ↑ Kim SJ, Sung JY, Um JW, Hattori N, Mizuno Y, Tanaka K, Paik SR, Kim J, Chung KC (октябрь 2003 г.). «Паркин расщепляет внутриклеточные включения альфа-синуклеина посредством активации кальпаина» . Журнал биологической химии . 278 (43): 41890–9. DOI : 10.1074 / jbc.M306017200 . PMID 12917442 .
- ^ Bolam, JP; Браун, MTC; Moss, J .; Magill, PJ (1 январь 2009), Squire, Ларри Р. (ред.), "Базальные ганглии: Внутренняя организация" , Энциклопедия Neuroscience , Оксфорд:. Academic Press, стр 97-104, DOI : 10.1016 / b978-008045046- 9.01294-8 , ISBN 978-0-08-045046-9, дата обращения 7 сентября 2020
- Перейти ↑ Kita H, Jaeger D (2016). «Организация Глобус Паллидус». Справочник по структуре и функциям базальных ганглиев, второе издание . Справочник по поведенческой неврологии. 24 . С. 259–276. DOI : 10.1016 / B978-0-12-802206-1.00013-1 . ISBN 9780128022061.
- ^ Наута HJ, Cole M (июль 1978). «Эфферентные проекции субталамического ядра: авторадиографическое исследование на обезьянах и кошках». Журнал сравнительной неврологии . 180 (1): 1–16. DOI : 10.1002 / cne.901800102 . PMID 418083 . [ нужен лучший источник ]
- Перейти ↑ Carpenter MB, Nakano K, Kim R (февраль 1976 г.). «Нигроталамические проекции у обезьяны, продемонстрированные авторадиографической техникой». Журнал сравнительной неврологии . 165 (4): 401–15. DOI : 10.1002 / cne.901650402 . PMID 57125 .
- ^ Deniau JM, Kitai ST, Донохью JP, Grofova I (1982). «Нейрональные взаимодействия в сетчатой части черной субстанции через коллатерали аксонов проекционных нейронов. Электрофизиологическое и морфологическое исследование». Экспериментальное исследование мозга . 47 (1): 105–13. DOI : 10.1007 / BF00235891 . PMID 6288427 .
- ^ Nicola С.М., Surmeier J , Malenka RC (2000). «Дофаминергическая модуляция возбудимости нейронов в полосатом теле и прилежащем ядре». Ежегодный обзор неврологии . 23 : 185–215. DOI : 10.1146 / annurev.neuro.23.1.185 . PMID 10845063 .
- ^ Гернерт М, Fedrowitz М, Wlaz Р, Лешер Вт (ноябрь 2004 г.). «Субрегиональные изменения скорости разряда, паттерна и лекарственной чувствительности предполагаемых ГАМКергических нигральных нейронов в киндлинг-модели эпилепсии». Европейский журнал нейробиологии . 20 (9): 2377–86. DOI : 10.1111 / j.1460-9568.2004.03699.x . PMID 15525279 .
- ^ Sato M, Hikosaka O (март 2002). «Роль приматов черной субстанции pars reticulata в ориентированном на вознаграждение саккадическом движении глаз» . Журнал неврологии . 22 (6): 2363–73. DOI : 10.1523 / JNEUROSCI.22-06-02363.2002 . PMC 6758246 . PMID 11896175 .
- ^ Zahr Н.М., Martin LP, Waszczak BL (ноябрь 2004). «Повреждения субталамического ядра изменяют базальный уровень, а агонист дофамина стимулирует электрофизиологический выход базальных ганглиев крысы». Синапс . 54 (2): 119–28. DOI : 10.1002 / syn.20064 . PMID 15352137 .
- ^ Hikosaka O, Вюрец RH (май 1983). «Зрительные и глазодвигательные функции обезьяны nigra pars reticulata. III. Зрительные и саккадные реакции, обусловленные памятью». Журнал нейрофизиологии . 49 (5): 1268–84. DOI : 10,1152 / jn.1983.49.5.1268 . PMID 6864250 .
- ^ Цзэн KY, Рикельме Л.А., Belforte JE, Пазо JH, Murer MG (январь 2000). «Черная субстанция pars reticulata единиц у крыс с поражением 6-гидроксидофамином: ответы на стимуляцию дофаминового рецептора D2 в полосатом теле и субталамические поражения». Европейский журнал нейробиологии . 12 (1): 247–56. DOI : 10,1046 / j.1460-9568.2000.00910.x . PMID 10651879 .
- ^ Deransart С, Хеллвигом В, Heupel-Рейтер М, Леже ДФ, Хек D, Lücking СН (декабрь 2003 г.). "Одноэлементный анализ нейронов pars reticulata черной субстанции у свободно ведущих крыс с генетической абсансной эпилепсией". Эпилепсия . 44 (12): 1513–20. DOI : 10.1111 / j.0013-9580.2003.26603.x . PMID 14636321 .
- ↑ Ходж Г.К., Мясник Л.Л. (август 1980 г.). «Компактная часть черной субстанции модулирует двигательную активность, но не участвует в регулировании потребления пищи и воды». Архив фармакологии Наунин-Шмидеберг . 313 (1): 51–67. DOI : 10.1007 / BF00505805 . PMID 7207636 .
- ^ Pioli EY, Мейснера W, SOHR R, Gross CE, Bezard E, Bioulac BH (июнь 2008). «Дифференциальные поведенческие эффекты частичных двусторонних поражений вентральной тегментальной области или компактной части черной субстанции у крыс». Неврология . 153 (4): 1213–24. DOI : 10.1016 / j.neuroscience.2008.01.084 . PMID 18455318 .
- ^ a b Ljungberg T, Apicella P, Schultz W (январь 1992 г.). «Ответы дофаминовых нейронов обезьяны во время обучения поведенческим реакциям» . Журнал нейрофизиологии . 67 (1): 145–63. DOI : 10,1152 / jn.1992.67.1.145 . PMID 1552316 .
- ^ Da Кунья C, Silva MH, Wietzikoski S, Wietzikoski EC, Ферро М., Кузьмин I, Canteras NS (декабрь 2006). «Стратегия обучения места у крыс с поражением компактной части черной субстанции». Поведенческая неврология . 120 (6): 1279–84. DOI : 10.1037 / 0735-7044.120.6.1279 . PMID 17201473 .
- ^ Da Кунья C, Wietzikoski S, Wietzikoski EC, Миёси E, Ферро М., Ансельмо-Франци JA, Canteras NS (май 2003). «Доказательства того, что компактная часть черной субстанции является важным компонентом системы памяти, независимой от системы памяти гиппокампа». Нейробиология обучения и памяти . 79 (3): 236–42. DOI : 10.1016 / S1074-7427 (03) 00008-X . PMID 12676522 .
- ^ Matell MS, Meck WH (январь 2000). «Нейропсихологические механизмы интервального временного поведения». BioEssays . 22 (1): 94–103. DOI : 10.1002 / (SICI) 1521-1878 (200001) 22: 1 <94 :: AID-BIES14> 3.0.CO; 2-E . PMID 10649295 .
- ^ Лима М., Андерсен М.Л., Reksidler AB, Vital MA, Tufik S (июнь 2007). Броснан С (ред.). «Роль компактной части черной субстанции в регулировании режима сна у крыс» . PLOS One . 2 (6): e513. Bibcode : 2007PLoSO ... 2..513L . DOI : 10.1371 / journal.pone.0000513 . PMC 1876809 . PMID 17551593 .
- ^ Dzirasa K, S Ribeiro, Коста - R, Сантос LM, Lin SC, Grosmark A, Сотникова ТД, Гайнетдинов RR, Caron MG, Николелис MA (октябрь 2006). «Дофаминергический контроль состояний сна и бодрствования» . Журнал неврологии . 26 (41): 10577–89. DOI : 10.1523 / JNEUROSCI.1767-06.2006 . PMC 6674686 . PMID 17035544 .
- ^ Bejjani, Булос-Поль; Дамье, Филипп; Арнульф, Изабель; Тивард, Лайонел; Бонне, Анн-Мари; Дормон, Дидье; Корню, Филипп; Пиду, Бернар; Самсон, Ив; Агид, Ив (13 мая 1999 г.). «Переходная острая депрессия, вызванная высокочастотной стимуляцией глубокого мозга» . Медицинский журнал Новой Англии . 340 (19): 1476–1480. DOI : 10.1056 / NEJM199905133401905 . ISSN 0028-4793 .
- Перейти ↑ Jankovic J (апрель 2008 г.). «Болезнь Паркинсона: клиника и диагностика» . Журнал неврологии, нейрохирургии и психиатрии . 79 (4): 368–76. DOI : 10.1136 / jnnp.2007.131045 . PMID 18344392 .
- Перейти ↑ Adler CH (2005). «Немоторные осложнения при болезни Паркинсона». Расстройства движения . 20 Дополнение 11: S23-9. DOI : 10.1002 / mds.20460 . PMID 15822106 .
- Перейти ↑ Dawson TM , Dawson VL (октябрь 2003 г.). «Молекулярные пути нейродегенерации при болезни Паркинсона». Наука . 302 (5646): 819–22. Bibcode : 2003Sci ... 302..819D . DOI : 10.1126 / science.1087753 . PMID 14593166 .
- ^ Liang CL, CM Синтон, Sonsalla PK, Немецкий DC (декабрь 1996). «Дофаминергические нейроны среднего мозга у мышей, которые содержат кальбиндин-D28k, демонстрируют пониженную уязвимость к нейродегенерации, индуцированной МРТР». Нейродегенерация . 5 (4): 313–8. DOI : 10,1006 / neur.1996.0042 . PMID 9117542 .
- ^ a b Интервью. Йоланд Смит, доктор философии [ требуется проверка ]
- ^ Menke RA, Jbabdi S, Миллер KL, Matthews PM, Zarei M (октябрь 2010). «Сегментация на основе подключения черной субстанции у человека и ее последствия при болезни Паркинсона». NeuroImage . 52 (4): 1175–80. DOI : 10.1016 / j.neuroimage.2010.05.086 . PMID 20677376 .
- ^ Трист BG, Заяц DJ, Двойной KL. Окислительный стресс при старении черной субстанции и этиология болезни Паркинсона. Ячейка старения. 2019 Декабрь; 18 (6): e13031. DOI: 10.1111 / acel.13031. Epub 2019 20 августа. Обзор. PMID 31432604
- ^ a b Schaser AJ, Osterberg VR, Dent SE, Stackhouse TL, Wakeham CM, Boutros SW, Weston LJ, Owen N, Weissman TA, Luna E, Raber J, Luk KC, McCullough AK, Woltjer RL, Unni VK. Альфа-синуклеин - это ДНК-связывающий белок, который модулирует репарацию ДНК с последствиями для заболеваний с тельцами Леви. Sci Rep.29 июля 2019; 9 (1): 10919. DOI: 10.1038 / s41598-019-47227-z. PMID 31358782
- ^ ван Россум J (1967). «Значение блокады дофаминовых рецепторов для действия нейролептических препаратов». В Brill H, Cole J, Deniker P, Hippius H, Bradley PB (ред.). Нейропсихофармакология, Труды пятой международной коллегии Neuropsychopharmacologicum . С. 321–9. OCLC 458719 .
- ^ Коломеец Н.С., Уранова Н.А. (1999). «Синаптические контакты при шизофрении: исследования с использованием иммуноцитохимической идентификации дофаминергических нейронов». Неврология и поведенческая физиология . 29 (2): 217–21. DOI : 10.1007 / BF02465329 . PMID 10432512 .
- ^ Кумамото N, S Мацудзаки, Иноуэ К, Т Хаттори, Shimizu S, R Хасимото, Yamatodani А, Т Катаяма, Tohyama М (июнь 2006 г.). «Гиперактивация дофаминергической системы среднего мозга при шизофрении может быть связана с подавлением дисбиндина». Сообщения о биохимических и биофизических исследованиях . 345 (2): 904–9. DOI : 10.1016 / j.bbrc.2006.04.163 . PMID 16701550 .
- ^ Шибата Е, Сасаки М, Tohyama К, Отсука К, ЭндоН Дж, Terayama Y, Сакаи А (сентябрь 2008 г.). «Использование нейромеланин-чувствительной МРТ для различения пациентов с шизофренией и депрессией и здоровых людей на основе изменений сигнала в черной субстанции и голубом пятне». Биологическая психиатрия . 64 (5): 401–6. DOI : 10.1016 / j.biopsych.2008.03.021 . PMID 18452894 .
- ^ a b c d e Миллер GM (январь 2011 г.). «Возникающая роль следового аминосвязанного рецептора 1 в функциональной регуляции переносчиков моноаминов и дофаминергической активности» . Журнал нейрохимии . 116 (2): 164–76. DOI : 10.1111 / j.1471-4159.2010.07109.x . PMC 3005101 . PMID 21073468 .
- ^ «Амфетамин» . DrugBank . Университет Альберты. 8 февраля 2013 . Проверено 13 октября 2013 года .
- ^ a b c Eiden LE, Weihe E (январь 2011 г.). «VMAT2: динамический регулятор моноаминергической нейрональной функции мозга, взаимодействующий с наркотиками, вызывающими злоупотребление» . Летопись Нью-Йоркской академии наук . 1216 (1): 86–98. Bibcode : 2011NYASA1216 ... 86E . DOI : 10.1111 / j.1749-6632.2010.05906.x . PMC 4183197 . PMID 21272013 .
- ^ Maguire JJ, Parker WA, Фурд СМ, Боннэр Т.И., Neubig RR, Дэвенпорт AP (март 2009). «Международный союз фармакологии. LXXII. Рекомендации по номенклатуре следовых аминовых рецепторов» . Фармакологические обзоры . 61 (1): 1–8. DOI : 10,1124 / pr.109.001107 . PMC 2830119 . PMID 19325074 .
- ^ Хейккиля RE, Cabbat FS, Duvoisin RC (1979). «Двигательная активность и вращательное поведение после аналогов кокаина: корреляция с блокадой захвата дофамина». Коммуникации в психофармакологии . 3 (5): 285–90. PMID 575770 .
- ^ Lakoski JM, Galloway MP, White FJ (1991). Кокаин . Телфорд Пресс. ISBN 978-0-8493-8813-2.
- ^ Lacey MG, Меркури NB, North RA (апрель 1990). «Действия кокаина на дофаминергические нейроны крысы in vitro» . Британский журнал фармакологии . 99 (4): 731–5. DOI : 10.1111 / j.1476-5381.1990.tb12998.x . PMC 1917549 . PMID 2361170 .
- ^ a b Xia Y, Goebel DJ, Kapatos G, Bannon MJ (сентябрь 1992 г.). «Количественное определение мРНК переносчика дофамина крысы: эффекты лечения кокаином и отмены». Журнал нейрохимии . 59 (3): 1179–82. DOI : 10.1111 / j.1471-4159.1992.tb08365.x . PMID 1494906 .
- ^ См. RE, Elliott JC, Feltenstein MW (октябрь 2007 г.). «Роль дорсальных и вентральных стриатальных путей в поиске кокаина после длительного воздержания у крыс». Психофармакология . 194 (3): 321–31. DOI : 10.1007 / s00213-007-0850-8 . PMID 17589830 .
- ↑ Cheng N, Maeda T, Kume T, Kaneko S, Kochiyama H, Akaike A, Goshima Y, Misu Y (декабрь 1996). «Дифференциальная нейротоксичность, вызванная L-DOPA и дофамином в культивируемых нейронах полосатого тела». Исследование мозга . 743 (1–2): 278–83. DOI : 10.1016 / S0006-8993 (96) 01056-6 . PMID 9017256 .
- ^ Rascol О, Payoux Р, Р Ори, Феррейра JJ, Brefel-Курбон С, Montastruc ДЛ (2003). «Ограничения современной терапии болезни Паркинсона». Анналы неврологии . 53 Дополнение 3: S3–12, обсуждение S12–5. DOI : 10.1002 / ana.10513 . PMID 12666094 .
- ^ Langston JW, Ballard P, Tetrud JW, Irwin I (февраль 1983). «Хронический паркинсонизм у человека из-за продукта синтеза аналога меперидина» . Наука . 219 (4587): 979–80. Bibcode : 1983Sci ... 219..979L . DOI : 10.1126 / science.6823561 . PMID 6823561 .
- ^ а б Шмидт Н, Фергер Б (2001). «Нейрохимические данные в модели болезни Паркинсона MPTP». Журнал нейронной передачи . 108 (11): 1263–82. DOI : 10.1007 / s007020100004 . PMID 11768626 .
- ^ Langston JW, Forno LS, Rebert CS, Irwin I (февраль 1984). «Избирательная негральная токсичность после системного введения 1-метил-4-фенил-1,2,5,6-тетрагидропирина (МРТР) на белку-обезьяну». Исследование мозга . 292 (2): 390–4. DOI : 10.1016 / 0006-8993 (84) 90777-7 . PMID 6607092 .
- ↑ Blanchet PJ, Calon F, Morissette M, Hadj Tahar A, Bélanger N, Samadi P, Grondin R, Grégoire L, Meltzer L, Di Paolo T, Bédard PJ (июль 2004 г.). «Актуальность модели приматов MPTP в изучении механизмов прайминга дискинезии». Паркинсонизм и связанные с ним расстройства . 10 (5): 297–304. DOI : 10.1016 / j.parkreldis.2004.02.011 . PMID 15196509 .
- ^ Таббс RS, Loukas M, Shoja М.М., Mortazavi М.М., Cohen-Gadol AA (июль 2011). «Феликс Вик д'Азир (1746-1794): один из первых основателей нейроанатомии и королевский французский врач» . Нервная система ребенка . 27 (7): 1031–4. DOI : 10.1007 / s00381-011-1424-у . PMID 21445631 .
- ^ Swanson LW (2014). Нейроанатомическая терминология: лексикон классических истоков и исторических основ . Англия: Издательство Оксфордского университета. ISBN 9780195340624.
- ↑ Сано Т. (1910). "Beitrag zur vergleichenden Anatomie der Substantia nigra, des Corpus Luysii und der Zona incerta" . MSCHR Psychiat Neurol . 28 (1): 26–34. DOI : 10.1159 / 000209678 .
- ^ Hornykiewicz, О. (2006). «Открытие дофаминовой недостаточности в паркинсоническом мозге». В Riederer, P .; Reichmann, H .; Юдим, МБХ; Герлах, М. (ред.). Болезнь Паркинсона и связанные с ней расстройства . Журнал нейронной передачи. Дополнение . Springer Вена. С. 9–15. DOI : 10.1007 / 978-3-211-45295-0_3 . ISBN 978-3-211-28927-3. PMID 17017502 .
Внешние ссылки [ править ]
| Викискладе есть медиафайлы по теме черной субстанции . |
- Окрашенные изображения срезов мозга, которые включают " черную субстанцию" в проекте BrainMaps
- Схема и объяснение кортико-базальных путей