| Wee1 | |||||||
|---|---|---|---|---|---|---|---|
 Кристаллическая структура человека Wee1 | |||||||
| Идентификаторы | |||||||
| Символ | Ингибитор митоза протеинкиназа Wee1 | ||||||
| Альт. символы | Wee1 протеинкиназа двойной специфичности Wee1 | ||||||
| Ген NCBI | 2539123 | ||||||
| UniProt | P07527 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 2.7.11.1 | ||||||
| |||||||
Wee1 представляет собой ядерную киназу, принадлежащую к семейству протеинкиназ Ser / Thr в делящихся дрожжах Schizosaccharomyces pombe ( S. pombe ). Wee1 имеет молекулярную массу 96 кДа и является ключевым регулятором развития клеточного цикла . Он влияет на размер клеток, подавляя вступление в митоз , через ингибирование Cdk1 . Wee1 имеет гомологи у многих других организмов, включая млекопитающих.
Введение [ править ]
Регулирование размера ячейки имеет решающее значение для обеспечения функциональности ячейки. Помимо факторов окружающей среды, таких как питательные вещества, факторы роста и функциональная нагрузка, размер клетки также контролируется контрольной точкой размера клетки.
Wee1 является составной частью этой контрольной точки. Это киназа, определяющая момент вступления в митоз, тем самым влияя на размер дочерних клеток. Потеря функции Wee1 приведет к образованию дочерних клеток меньшего размера, чем у нормальных, потому что деление клеток происходит преждевременно.
Его название происходит от шотландского диалектного слова «wee», что означает «маленький» - его первооткрыватель Пол Нерс на момент открытия работал в Эдинбургском университете в Шотландии. [1] [2]
Функция [ править ]
Wee1 ингибирует Cdk1 , фосфорилируя его по двум разным сайтам, Tyr15 и Thr14. [3] Cdk1 имеет решающее значение для циклин-зависимого прохождения различных контрольных точек клеточного цикла. Существует по крайней мере три контрольных точки, для которых важно ингибирование Cdk1 с помощью Wee1:
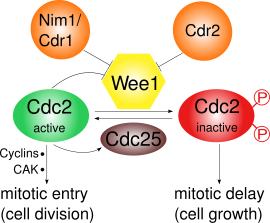
- Контрольная точка G2 / M : Wee1 фосфорилирует аминокислоты Tyr15 и Thr14 Cdk1, что поддерживает киназную активность Cdk1 на низком уровне и предотвращает вступление в митоз ; у S. pombe может происходить дальнейший рост клеток. Было показано, что опосредованная Wee1 инактивация Cdk1 является сверхчувствительной в результате конкуренции за субстрат. [4] Во время митотического входа активность Wee1 снижается несколькими регуляторами, и, таким образом, активность Cdk1 увеличивается. В S. pombe , Pom1, протеинкиназа, локализуется на полюсах клетки. Это активирует путь, в котором Cdr2 ингибирует Wee1 через Cdr1. Сам Cdk1 негативно регулирует Wee1 путем фосфорилирования, что приводит к положительной петле обратной связи. Одной только пониженной активности Wee1 недостаточно для митотического входа: также необходимы синтез циклинов и активирующее фосфорилирование с помощью активирующей киназы Cdk (САК). [5]
- Контрольная точка размера клетки: есть свидетельства существования контрольной точки размера клетки, которая предотвращает попадание мелких клеток в митоз. Wee1 играет роль в этой контрольной точке, координируя размер клетки и развитие клеточного цикла. [6]
- Контрольная точка повреждения ДНК: эта контрольная точка также контролирует переход G2 / M. У S. pombe эта контрольная точка задерживает вход в митоз клеток с повреждением ДНК (например, вызванным гамма-излучением ). Удлинение фазы G2 зависит от Wee1; Мутанты wee1 не имеют продолжительной фазы G2 после гамма-облучения. [7]
Сообщалось также об эпигенетической функции киназы Wee1. Было показано, что Wee1 фосфорилирует гистон H2B по остатку тирозина 37, который регулирует глобальную экспрессию гистонов. [8] [9]
Гомологи [ править ]
| гомолог WEE1 человека ( S. pombe ) | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | WEE1 | ||||||
| Ген NCBI | 7465 | ||||||
| HGNC | 12761 | ||||||
| OMIM | 193525 | ||||||
| RefSeq | NM_003390 | ||||||
| UniProt | P30291 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 11 п.15.3-15.1 | ||||||
| |||||||
| человеческий WEE1 гомолог 2 ( S. pombe ) | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | WEE2 | ||||||
| Ген NCBI | 494551 | ||||||
| HGNC | 19684 | ||||||
| RefSeq | NM_001105558 | ||||||
| UniProt | P0C1S8 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 7 q32-q32 | ||||||
| |||||||
Wee1 ген имеет два известных гомологов у человека, Wee1 (также известный как WEE1A) и WEE2 (WEE1B). Соответствующими белками являются Wee1-подобная протеинкиназа и Wee1-подобная протеинкиназа 2, которые действуют на гомолог Cdk1 человека Cdk1 .
Гомолог Wee1 у почкующихся дрожжей Saccharomyces cerevisiae называется Swe1.
Регламент [ править ]
У S. pombe Wee1 фосфорилируется
Cdk1, а циклин B составляет фактор, способствующий созреванию (MPF), который способствует вступлению в митоз. Он инактивируется фосфорилированием через Wee1 и активируется фосфатазой Cdc25C . Cdc25C, в свою очередь, активируется Polo kinase и инактивируется Chk1 . [6] Таким образом, у S. pombe регуляция Wee1 в основном находится под контролем фосфорилирования посредством пути полярности киназы Pom1 , включая Cdr2 и Cdr1. [10] [11] [12] [13]
При переходе G2 / M Cdk1 активируется Cdc25 посредством дефосфорилирования Tyr15. В то же время Wee1 инактивируется посредством фосфорилирования в его C-концевом каталитическом домене с помощью Nim1 / Cdr1. [12] Кроме того, активный MPF будет способствовать своей собственной активности, активируя Cdc25 и инактивируя Wee1, создавая петлю положительной обратной связи , хотя это еще не изучено в деталях. [6]
Высшие эукариоты регулируют Wee1 посредством фосфорилирования и деградации.
У высших эукариот инактивация Wee1 происходит как посредством фосфорилирования, так и деградации . [14]
Белковый комплекс [nb 1] SCF β-TrCP1 / 2 представляет собой убиквитин-лигазу E3, которая участвует в убиквитинировании Wee1A . М-фазы киназ Polo-подобные киназы (Plk1) и Cdc2 фосфорилирует два сериновых остатков в Wee1A , которые признаны SCF β-TrCP1 / 2 . [15]
Гомолог S. cerevisiae Swe1.
В S. cerevisiae циклин-зависимая киназа Cdc28 (гомолог Cdk1) фосфорилируется Swe1 (гомолог Wee1) и дефосфорилируется Mih1 (гомолог Cdc25). Гомолог Nim1 / Cdr1 в S. cerevisiae , Hsl1, вместе с родственными ему киназами Gin4 и Kcc4 локализуют Swe1 на шейке почки . Киназы, связывающие почковую шейку, Cla4 и Cdc5 (гомолог полокиназы) фосфорилируют Swe1 на разных стадиях клеточного цикла. Swe1 также фосфорилируется с помощью Clb2-Cdc28, который служит распознаванием дальнейшего фосфорилирования с помощью Cdc5.
CEREVISIAE С. Белок Swe1 также регулируется деградации. Swe1 гиперфосфорилируется Clb2-Cdc28 и Cdc5, что может быть сигналом для убиквитинирования и деградации SCF E3 убиквитин-лигазным комплексом, как у высших эукариот. [16]
Роль в раке [ править ]
Фактор MPF, способствующий митозу, также регулирует апоптоз, вызванный повреждением ДНК . Отрицательная регуляция MPF с помощью WEE1 вызывает аберрантный митоз и, таким образом, устойчивость к апоптозу, вызванному повреждением ДНК. Kruppel-подобный фактор 2 (KLF2) негативно регулирует человеческий WEE1, тем самым повышая чувствительность к апоптозу, вызванному повреждением ДНК, в раковых клетках. [17]
Мутантный фенотип [ править ]
Wee1 действует как дозозависимый ингибитор митоза. [18] Таким образом, количество белка Wee1 коррелирует с размером клеток:
Мутант делящихся дрожжей wee1 , также называемый wee1 - , делится со значительно меньшим размером клеток, чем клетки дикого типа. Поскольку Wee1 подавляет вступление в митоз, его отсутствие приведет к преждевременному делению и к субнормальному размеру клеток. Напротив, когда экспрессия Wee1 увеличивается, митоз задерживается, и клетки вырастают до больших размеров перед делением.
См. Также [ править ]
- Wee1-подобная протеинкиназа
- Клеточный цикл
Заметки [ править ]
- ^ β-трансдуциновый повтор-содержащий белок 1/2 (β-TrCP1 / 2) F-бокс-белок, содержащий белок SKP1 / Cul1 / F-бокс-белковый комплекс
Ссылки [ править ]
- ↑ Медсестра П. (декабрь 2004 г.). "Маленькие звери". Природа . 432 (7017): 557. Bibcode : 2004Natur.432..557N . DOI : 10.1038 / 432557a . PMID 15577889 . S2CID 29840746 .
- ^ Nurse P, Thuriaux P (ноябрь 1980). «Регулирующие гены, контролирующие митоз у делящихся дрожжей Schizosaccharomyces pombe» . Генетика . 96 (3): 627–37. PMC 1214365 . PMID 7262540 .
- ^ Den Haese GJ, Walworth N, Карр AM, Гулд KL (1995). «Протеинкиназа Wee1 регулирует фосфорилирование T14 делящихся дрожжей Cdc2» . Mol Biol Cell . 6 (4): 371–85. DOI : 10.1091 / mbc.6.4.371 . PMC 301198 . PMID 7626804 .
- ^ Ким, SY; Феррелл Дж. Э. младший (23 марта 2007 г.). «Конкуренция субстратов как источник сверхчувствительности при инактивации Wee1». Cell . 128 (6): 1133–45. DOI : 10.1016 / j.cell.2007.01.039 . PMID 17382882 . S2CID 14138576 .
- ^ Coleman TR, Дунфи WG (1994). «Регулирующие факторы Cdc2». Текущее мнение в клеточной биологии . 6 (6): 877–82. DOI : 10.1016 / 0955-0674 (94) 90060-4 . PMID 7880537 .
- ^ а б в Келлог Д.Р. (2003). «Wee1-зависимые механизмы, необходимые для координации роста и деления клеток» . J Cell Sci . 116 (24): 4883–90. DOI : 10,1242 / jcs.00908 . PMID 14625382 .
- Перейти ↑ Rowley R, Hudson J, Young PG (1992). «Протеинкиназа wee1 необходима для радиационно-индуцированной задержки митоза». Природа . 356 (6367): 353–5. Bibcode : 1992Natur.356..353R . DOI : 10.1038 / 356353a0 . PMID 1549179 . S2CID 4280074 .
- ^ Mahajan K, Fang B, Koomen JM Махаян NP (2012). «Фосфорилирование H2B Tyr37 подавляет экспрессию зависимых от репликации генов гистонов ядра» . Структурная и молекулярная биология природы . 19 (9): 930–7. DOI : 10.1038 / nsmb.2356 . PMC 4533924 . PMID 22885324 .
- ^ Mahajan K Махаян NP (2013). «Тирозинкиназа WEE1, новый эпигенетический модификатор» . Тенденции Genet . 29 (7): 394–402. DOI : 10.1016 / j.tig.2013.02.003 . PMC 3700603 . PMID 23537585 .
- ^ Boddy MN, Furnari B, Mondesert O, Russell P (май 1998). «Контрольная точка репликации обеспечивается киназами Cds1 и Chk1». Наука . 280 (5365): 909–12. Bibcode : 1998Sci ... 280..909B . DOI : 10.1126 / science.280.5365.909 . PMID 9572736 .
- ↑ Wu L, Russell P (июнь 1993 г.). «Киназа Nim1 способствует митозу, инактивируя тирозинкиназу Wee1». Природа . 363 (6431): 738–41. Bibcode : 1993Natur.363..738W . DOI : 10.1038 / 363738a0 . PMID 8515818 . S2CID 4320080 .
- ^ a b Коулман Т. Р., Тан З., Данфи В. Г. (март 1993 г.). «Отрицательная регуляция протеинкиназы wee1 за счет прямого действия митотического индуктора nim1 / cdr1». Cell . 72 (6): 919–29. DOI : 10.1016 / 0092-8674 (93) 90580-J . PMID 7681363 . S2CID 42256641 .
- Перейти ↑ Tang Z, Coleman TR, Dunphy WG (сентябрь 1993). «Два различных механизма отрицательной регуляции протеинкиназы Wee1» . EMBO J . 12 (9): 3427–36. DOI : 10.1002 / j.1460-2075.1993.tb06017.x . PMC 413619 . PMID 7504624 .
- ↑ Watanabe N, Broome M, Hunter T (май 1995 г.). «Регулирование человеческой тирозин-15-киназы WEE1Hu CDK во время клеточного цикла» . EMBO J . 14 (9): 1878–91. DOI : 10.1002 / j.1460-2075.1995.tb07180.x . PMC 398287 . PMID 7743995 .
- ^ Ватанабе Н., Араи Х, Нишихара Й и др. (Март 2004 г.). «Киназы M-фазы индуцируют фосфозависимое убиквитинирование соматического Wee1 с помощью SCFbeta-TrCP» . Proc. Natl. Акад. Sci. США . 101 (13): 4419–24. Bibcode : 2004PNAS..101.4419W . DOI : 10.1073 / pnas.0307700101 . PMC 384762 . PMID 15070733 .
- ^ Ли К.С., Асано S, Парк JE, Sakchaisri K, Эриксон RL (октябрь 2005). «Мониторинг клеточного цикла с помощью мультикиназозависимой регуляции Swe1 / Wee1 у почкующихся дрожжей» . Клеточный цикл . 4 (10): 1346–9. DOI : 10.4161 / cc.4.10.2049 . PMID 16123596 .
- ^ Ван Ф, Чжу Й, Хуанг И и др. (Июнь 2005 г.). «Транскрипционная репрессия WEE1 с помощью Kruppel-подобного фактора 2 участвует в апоптозе, вызванном повреждением ДНК» . Онкоген . 24 (24): 3875–85. DOI : 10.1038 / sj.onc.1208546 . PMID 15735666 .
- ↑ Рассел П., медсестра П. (май 1987 г.). «Отрицательная регуляция митоза с помощью We1 +, гена, кодирующего гомолог протеинкиназы». Cell . 49 (4): 559–67. DOI : 10.1016 / 0092-8674 (87) 90458-2 . PMID 3032459 . S2CID 42801276 .
Внешние ссылки [ править ]
- Drosophila wee - Интерактивная муха