| Имена | |||
|---|---|---|---|
| Имена ИЮПАК N , N- Диметилпиридин-4-амин Диметил (пиридин-4-ил) азан Диметил (пиридин-4-ил) амин | |||
| Предпочтительное название IUPAC N , N- диметилпиридин-4-амин | |||
| Другие имена 4- (диметиламино) пиридин N , N- диметил-4-аминопиридин DMAP 4-диметиламинопиридин 4- (диметиламино) азин N , N- диметил-4-аминоазин 4- (диметиламино) азабензол N , N- диметил-4-аминоазабензол | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.013.049 | ||
PubChem CID | |||
| UNII | |||
Панель управления CompTox ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| C 7 H 10 N 2 | |||
| Молярная масса | 122,17 г / моль | ||
| Внешность | белое твердое вещество | ||
| Температура плавления | От 110 до 113 ° C (от 230 до 235 ° F, от 383 до 386 K) | ||
| Точка кипения | 162 ° С (324 ° F, 435 К) при 50 мм рт. | ||
| Кислотность (p K a ) | 9,6 в воде, 17,95 (p K a конъюгированной кислоты в ацетонитриле) [1] | ||
| Опасности | |||
| Паспорт безопасности | [2] | ||
| Пиктограммы GHS |  | ||
| Сигнальное слово GHS | Опасность | ||
| H301 , H310 , H315 , H319 , H335 [2] | |||
| P280 , P305 + 351 + 338 , P337 + 313 [2] | |||
| Смертельная доза или концентрация (LD, LC): | |||
LD 50 ( средняя доза ) | олени мыши: перорально, 450 мг / кг [3] мыши: перорально, 350 мг / кг / день [3] | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
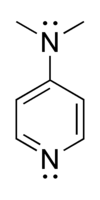
4-Диметиламинопиридин ( DMAP ) представляет собой производное пиридина с химической формулой (CH 3 ) 2 NC 5 H 4 N. Это бесцветное твердое вещество представляет интерес, поскольку оно является более основным, чем пиридин , из-за резонансной стабилизации от заместителя NMe 2. .
Из - за его основность, ДМАП является полезным нуклеофильным катализатором для различных реакций , таких как этерификации с ангидридами , то реакция Бэйлиса-Hillman , hydrosilylations , тритилирование, перегруппировка Steglich, Штаудингер синтез из беты-лактамов и многих других. Хиральные аналоги DMAP используются в экспериментах по кинетическому разделению в основном вторичных спиртов и амидов вспомогательного типа Эванса. [4] [5] [6]
Подготовка [ править ]
DMAP может быть получен двухстадийным способом из пиридина, который сначала окисляется до катиона 4-пиридилпиридиния. Затем этот катион вступает в реакцию с диметиламином : [7]
Катализатор этерификации [ править ]
В случае этерификации с уксусными ангидридами принятый в настоящее время механизм включает три этапа. Во-первых, ДМАП и уксусный ангидрид вступают в реакцию до равновесия с образованием ионной пары ацетата и иона ацетилпиридиния. На второй стадии спирт присоединяется к ацетилпиридину, и при удалении пиридина образуется сложный эфир . Здесь ацетат действует как основание для удаления протона из спирта, поскольку он нуклеофильно присоединяется к активированному ацилпиридинию. Связь ацетильной группы с катализаторомрасщепляется с образованием катализатора и сложного эфира. Описанный процесс образования и разрыва связи протекает синхронно, без появления тетраэдрического интермедиата. Образовавшаяся уксусная кислота затем протонирует DMAP. На последней стадии каталитического цикла вспомогательное основание (обычно триэтиламин или пиридин) депротонирует протонированный DMAP, реформируя катализатор. Реакция протекает по описанному пути нуклеофильной реакции независимо от используемого ангидрида, но механизм изменяется в зависимости от значения pKa используемого спирта. Например, в случае фенола реакция протекает по пути реакции, катализируемой основанием. В этом случае DMAP действует как основание и депротонирует фенол, и образующийся фенолят-ион присоединяется к ангидриду. [8]
Безопасность [ править ]
DMAP обладает относительно высокой токсичностью и особенно опасен из-за его способности всасываться через кожу. Он также вызывает коррозию. [9]
Связанное соединение [ править ]
- 4-пирролидинилпиридин
Ссылки [ править ]
- ^ Kaljurand, I .; Kütt, A .; Sooväli, L .; Родима, Т .; Мяэметс, В .; Leito, I .; Коппель, ИА (2005). «Расширение самосогласованной спектрофотометрической шкалы основности в ацетонитриле до полного диапазона 28 единиц pKa: объединение различных шкал основности». J. Org. Chem . 70 (3): 1019–1028. DOI : 10.1021 / jo048252w . PMID 15675863 .
- ^ a b c Sigma-Aldrich Co. , 4- (диметиламино) пиридин . Проверено 9 сентября 2015.
- ^ a b c d Нахтергаэль, Амандин; Кулембье, Оливье; Дюбуа, Филипп; Гельвенштейн, Максим; Duez, Пьер; Бланкерт, Бертран; Меспуй, Летиция (9 февраля 2015 г.). «Пересмотренная парадигма органокатализа: действительно ли безметалловые катализаторы безвредны?». Биомакромолекулы . 16 (2): 507–514. DOI : 10.1021 / bm5015443 . PMID 25490408 .
- ^ Дональд Дж. Берри; Карл V Дигиованна; Стефани С. Метрик; Рамиа Муруган (2001). «Катализ 4-диалкиламинопиридинами» . Arkivoc : 201–226. Архивировано из оригинала на 2007-09-27 . Проверено 27 ноября 2006 .
- ^ Höfle, G .; Steglich, W .; Форбрюгген, Х. (1978). «4-Диалкиламинопиридины как высокоактивные катализаторы ацилирования». Энгью. Chem. Int. Эд. Англ. 17 (8): 569–583. DOI : 10.1002 / anie.197805691 .
- ^ Райан П. Вурц (2007). «Хиральные диалкиламиновые катализаторы в асимметричном синтезе». Chem. Ред. 107 (12): 5570–5595. DOI : 10.1021 / cr068370e . PMID 18072804 .
- ↑ Симидзу, Шинкичи; Ватанабэ, Нанао; Катаока, Тошиаки; Сёдзи, Такаяки; Абэ, Нобуюки; Моришита, Синджи; Ичимура, Хисао (2007). «Пиридин и производные пиридина». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a22_399 .
- ^ С. Сюй; Я держал; Б. Кемпф; Х. Майр; Вольфганг Штеглих ; Х. Зипсе (2005). «Катализируемое DMAP ацетилирование спиртов - механистическое исследование (DMAP = 4- (диметиламино) пиридин)». Chem. Евро. J. 11 (16): 4751–4757. DOI : 10.1002 / chem.200500398 . PMID 15924289 .
- ^ DMAP MSDS - Fischer Science
Дальнейшее чтение [ править ]
- Б. Нейзес; В. Стеглич (1990). «Этерификация карбоновых кислот дициклогексилкарбодиимидом / 4-диметиламинопиридином: трет-бутилэтилфумарат» . Органический синтез .; Сборник , 7 , с. 93
- Я держал; П. фон ден Хофф; Д. С. Стивенсон; Х. Зипсе (2008). «Домино-катализ при прямом превращении карбоновых кислот в сложные эфиры». Adv. Synth. Катал. 11/12 (11–12): 1891–1900. DOI : 10.1002 / adsc.200800268 .