Эта статья поднимает множество проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалить эти сообщения-шаблоны ) ( Узнайте, как и когда удалить этот шаблон сообщения )
|
Абсолютная конфигурация относится к пространственному расположению атомов одного хирального молекулярного объекта (или группы) и ее стереохимического описание , например , R или S , [1] со ссылкой на Rectus или Sinister , соответственно.
Абсолютные конфигурации хиральной молекулы (в чистом виде) чаще всего получают с помощью рентгеновской кристаллографии , хотя и с некоторыми важными ограничениями. Все энантиомерно чистые хиральные молекулы кристаллизуются в одной из 65 групп Зонке (хиральных пространственных групп).
Альтернативными методами являются оптическая вращательная дисперсия , колебательный круговой дихроизм , ультрафиолетовая и видимая спектроскопия , использование реагентов хирального сдвига в протонном ЯМР и визуализации кулоновского взрыва. [2] [3]
Когда получена абсолютная конфигурация, назначение дескрипторов R или S основано на правилах приоритета Кана – Ингольда – Прелога .
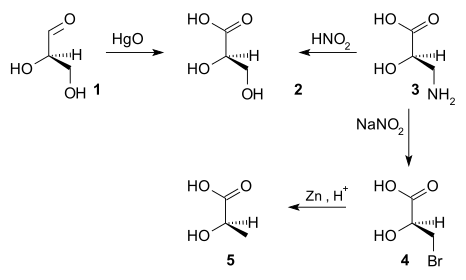
Абсолютные конфигурации являются ризолютивными для определения структуры любой хиральной молекулы. До 1951 г. невозможно было получить абсолютную конфигурацию хиральных соединений. [4] Некоторое время было решено, что (+) - глицеральдегид является D- энантиомером. [ необходима цитата ] Конфигурация других хиральных соединений была затем связана с конфигурацией (+) - глицеральдегида последовательностями химических реакций . Например, окисление (+) - глицеральдегида ( 1 ) оксидом ртути дает (-) - глицериновую кислоту ( 2), реакция, не меняющая стереоцентра. Таким образом, абсолютная конфигурация (-) - глицериновой кислоты должна быть такой же, как и у (+) - глицеральдегида. Азотная кислота [ ссылка необходима ] окисление (+) - изосерина ( 3 ) дает (-) - глицериновую кислоту, устанавливая, что (+) - изосерин также имеет такую же абсолютную конфигурацию. (+) - Изосерин может быть преобразован с помощью двухстадийного процесса бромирования [ необходима ссылка ] и восстановления цинка с образованием (-) - молочной кислоты., следовательно, (-) - молочная кислота также имеет такую же абсолютную конфигурацию. Если реакция дала энантиомер известной конфигурации, на что указывает противоположный знак оптического вращения, это будет указывать на то, что абсолютная конфигурация инвертирована.
В 1951 году Йоханнес Мартин Бийвоет впервые применил в рентгеновской кристаллографии эффект аномальной дисперсии , который теперь называется резонансным рассеянием , для определения абсолютной конфигурации. [5] Исследуемое соединение представляло собой (+) - тартрат рубидия натрия и, судя по его конфигурации ( R , R) был сделан вывод, что первоначальное предположение для (+) - глицеральдегида было правильным. Несмотря на огромное и уникальное влияние на доступ к молекулярным структурам, рентгеновская кристаллография создает некоторые проблемы. Процесс кристаллизации целевых молекул зависит от времени и ресурсов и не может быть применен к соответствующим интересующим системам, таким как многие биомолекулы (за исключением некоторых белков) и катализаторы in situ . Еще одно важное ограничение состоит в том, что молекула должна содержать «тяжелые» атомы (например, брома), чтобы усилить рассеяние. [6] Кроме того, критические искажения сигнала возникают из-за влияния ближайших соседей в любой кристаллической структуре и растворителей, используемых в процессе кристаллизации .
Совсем недавно были введены новые методы прямого исследования абсолютной конфигурации одиночных молекул в газовой фазе, обычно в сочетании с квантовомеханическими теоретическими расчетами ab initio , что позволяет преодолеть некоторые ограничения рентгеновской кристаллографии. [7]
Соглашения [ править ]
По абсолютной конфигурации: R - и S - [ править ]
Система R / S является важной системой номенклатуры для обозначения энантиомеров. Этот подход маркирует каждый хиральный центр R или S в соответствии с системой, в которой каждому его заместителю назначается приоритет в соответствии с правилами приоритета Кана-Ингольда-Прелога (CIP) на основе атомного номера. Если центр ориентирован так, что самый низкий приоритет из четырех направлен в сторону от зрителя, тогда зритель увидит две возможности: если приоритет оставшихся трех заместителей уменьшается по часовой стрелке, он обозначается R (для Rectus , Латинское для правого), если оно уменьшается против часовой стрелки, это S (дляЗловещий , латинское слева). [8]
( R ) ( S ) пишется курсивом и круглыми скобками. Если имеется несколько хиральных атомов углерода, например (1 R , 4 S ), число указывает расположение углерода, предшествующего каждой конфигурации. [9]
Не R / S система также имеет фиксированное отношение к D / L системе. Например, боковая цепь серина содержит гидроксильную группу -ОН. Если бы вместо нее была заменена тиоловая группа -SH, то на маркировку D / L эта замена, по ее определению, не повлияла бы. Но эта замена изменила бы R / S- мечение молекулы , потому что приоритет CIP для CH 2 OH ниже, чем для CO 2 H, но приоритет CIP для CH 2 SH выше, чем для CO 2 H. По этой причине D / LСистема по-прежнему широко используется в определенных областях биохимии, таких как химия аминокислот и углеводов, потому что удобно иметь одну и ту же хиральную метку для обычно встречающихся структур данного типа структуры у высших организмов. В D / L системы, они почти все последовательно встречающиеся в природе аминокислоты , все л , в то время как встречающиеся в природе углеводы являются почти все D . В системе R / S это в основном S , но есть некоторые общие исключения.
По оптическому вращению: (+) - и (-) - или d- и l- [ править ]
Энантиомер можно назвать по направлению, в котором он вращает плоскость поляризованного света. Вращение по часовой стрелке света, идущего к наблюдателю, обозначено (+) энантиомером. Его зеркальное отображение обозначено (-). (+) И (-) изомеры также называются d- и l- (для правовращающих и левовращающих ); Но именование с помощью d- и l- легко спутать с маркировкой D- и L-, и поэтому IUPAC не одобряет его . [10]
По относительной конфигурации: D - и L - [ править ]
Оптический изомер можно назвать пространственной конфигурацией его атомов. Система D / L (названная в честь латинских dexter и laevus, справа и слева), не путать с d- и l- системами, см. Выше , делает это, связывая молекулу с глицеральдегидом . Глицеральдегид сам по себе хиральный, и два его изомера обозначены D и L (обычно набираются маленькими заглавными буквами.в опубликованной работе). Некоторые химические манипуляции могут быть выполнены с глицеральдегидом, не влияя на его конфигурацию, и его историческое использование для этой цели (возможно, в сочетании с его удобством как одной из самых маленьких обычно используемых хиральных молекул) привело к его использованию для номенклатуры. В этой системе соединения названы по аналогии с глицеральдегидом, который, как правило, дает однозначные обозначения, но его легче всего увидеть в небольших биомолекулах, подобных глицеральдегиду. Одним из примеров является хиральная аминокислота аланин , которая имеет два оптических изомера, и они помечены в соответствии с изомером глицеральдегида, из которого они происходят. С другой стороны, глицин , аминокислота, полученная из глицеральдегида, не обладает оптической активностью, так как не является хиральной (ахиральной).
D / L маркировка не имеет отношения к (+) / (-); он не указывает, какой энантиомер является правовращающим, а какой - левовращающим. Скорее, это указывает на стереохимию соединения по отношению к правовращающему или левовращающему энантиомеру глицеральдегида. Правовращающий изомер глицеральдегида фактически является D- изомером. Девять из девятнадцати L- аминокислот, обычно присутствующих в белках, являются правовращающими (при длине волны 589 нм), а D -фруктоза также называется левулозой, поскольку она левовращает. Эмпирическим правилом для определения изомерной формы D / L аминокислоты является правило «CORN». Группы:
- CO OH, R , N H 2 и H (где R - боковая цепь)
расположены вокруг атома углерода хирального центра. С атомом водорода вдали от зрителя, если расположение групп CO → R → N вокруг атома углерода в качестве центра против часовой стрелки, то это L- форма. [11] Если расположение по часовой стрелке, это форма D. Как обычно, если сама молекула ориентирована иначе, например, H по направлению к наблюдателю, картина может быть обратной. L форма является обычной один найден в природных белках. Для большинства аминокислот L- форма соответствует абсолютной стереохимии S , но для определенных боковых цепей это R.
См. Также [ править ]
- Молекулярная конфигурация
Ссылки [ править ]
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Абсолютная конфигурация ». DOI : 10,1351 / goldbook.A00020
- ^ «Снимки отличают молекулы от их зеркального отображения» . www.mpg.de . Проверено 16 февраля 2021 года .
- ^ Питцер, Мартин; Куницкий Максим; Джонсон, Аллан С .; Янке, Тилль; Санн, Хендрик; Штурм, Феликс; Schmidt, Lothar Ph. H .; Шмидт-Бёкинг, Хорст; Дёрнер, Рейнхард; Штонер, Юрген; Кедровски, Юлия; Реджелин, Майкл; Марквардт, Себастьян; Шисер, Александр; Бергер, Роберт; Шёффлер, Маркус С. (6 сентября 2013 г.). «Прямое определение абсолютной молекулярной стереохимии в газовой фазе с помощью визуализации кулоновского взрыва». Наука . 341 (6150): 1096–1100. Bibcode : 2013Sci ... 341.1096P . DOI : 10.1126 / science.1240362 . ISSN 0036-8075 . PMID 24009390 . S2CID 206549826 .
- ^ Органическая химия (4-е издание) Паула Ю. Брюс
- ^ Bijvoet, JM; Peerdeman, AF; ван БОММЕЛЬ, AJ (август 1951 г.). «Определение абсолютной конфигурации оптически активных соединений с помощью рентгеновских лучей». Природа . 168 (4268): 271–272. Bibcode : 1951Natur.168..271B . DOI : 10.1038 / 168271a0 . ISSN 0028-0836 . S2CID 4264310 .
- ^ Haesler, J .; Schindelholz, I .; Riguet, E .; Bochet, CG; Обнять, В. (март 2007 г.). «Абсолютная конфигурация хирально дейтерированного неопентана» (PDF) . Природа . 446 (7135): 526–529. Bibcode : 2007Natur.446..526H . DOI : 10,1038 / природа05653 . ISSN 0028-0836 . PMID 17392783 . S2CID 4423560 .
- ^ Fehre, K .; Налин, Г .; Новиковский, НМ; Grundmann, S .; Kastirke, G .; Эккарт, S .; Тринтер, Ф .; Rist, J .; Hartung, A .; Trabert, D .; Янке, гл; Питцер, М .; Zeller, S .; Wiegandt, F .; Веллер, М .; Kircher, M .; Hofmann, M .; Schmidt, L. Ph H .; Knie, A .; Hans, A .; Ltaief, L. Ben; Ehresmann, A .; Berger, R .; Fukuzawa, H .; Ueda, K .; Schmidt-Böcking, H .; Уильямс, JB; Jahnke, T .; Dörner, R .; Демехин, к.м.н .; Schöffler, MS (9 января 2021 г.). «Определение энантиочувствительной структуры по рассеянию фотоэлектронов на одиночных молекулах» . arXiv: 2101.03375 [физика] . arXiv : 2101.03375 . Проверено 16 февраля 2021 года .
- ^ Эндрю Стрейтуизер & Clayton H. Heathcock (1985). Введение в органическую химию (3-е изд.). Издательская компания Macmillan.
- ^ Клейн, Дэвид Р. (2013-12-31). Органическая химия (2-е изд.). Вайли. п. 208. ISBN 978-1118454312.
- ↑ Moss, GP (1 января 1996 г.). «Базовая терминология стереохимии (Рекомендации IUPAC 1996 г.)» . Чистая и прикладная химия . 68 (12): 2193–2222. DOI : 10,1351 / pac199668122193 . ISSN 1365-3075 . S2CID 98272391 . Проверено 16 февраля 2021 года .
- ^ «Номенклатура и символика аминокислот и пептидов» . Pure Appl Chem . 56 (5): 595–624. 1984. DOI : 10,1351 / pac198456050595 .