Агостическое взаимодействие - это термин в металлоорганической химии для взаимодействия координационно-ненасыщенного переходного металла со связью C-H , когда два электрона, участвующие в связи C-H, входят в пустую d-орбиталь переходного металла, что приводит к трехцентровая двухэлектронная связь . [1] Предполагается, что многие каталитические превращения, например окислительное присоединение и восстановительное отщепление , протекают через промежуточные соединения с агостическими взаимодействиями. Агостические взаимодействия наблюдаются на протяжении всей металлоорганической химии в алкильных, алкилиденовых и полиенильных лигандах.
История [ править ]
Термин агостик, происходящий от древнегреческого слова «держаться близко к себе», был придуман Морисом Брукхартом и Малкольмом Грином по предложению классика Джаспера Гриффина для описания этого и многих других взаимодействий между переходным металлом и металлом. С-Н св зь . Часто такие агостические взаимодействия включают алкильные или арильные группы, которые удерживаются близко к металлическому центру за счет дополнительной σ-связи. [2] [3]
Кратковременные взаимодействия между углеводородными заместителями и координационно-ненасыщенными комплексами металлов отмечались с 1960-х годов. Например, в дихлориде трис ( трифенилфосфин ) рутения наблюдается короткое взаимодействие между центром рутения (II) и атомом водорода в орто-положении одного из девяти фенильных колец. [4] Комплексы борогидрида описаны с использованием модели трехцентровой двухэлектронной связи .
Природа взаимодействия была предсказана в химии основных групп в структурной химии триметилалюминия .
Характеристики агостических облигаций [ править ]
Агостические взаимодействия лучше всего демонстрирует кристаллография . Данные нейтронной дифракции показали, что расстояния связей C − H и M┄H на 5-20% больше, чем ожидалось для изолированного гидрида металла и углеводородов. Расстояние между металлом и водородом обычно составляет 1,8–2,3 Å , а угол M┄H − C находится в диапазоне 90–140 °. Наличие сигнала 1 H ЯМР, который смещен в более сильное поле от сигнала нормального арила или алкана, часто в область, обычно относящуюся к гидридным лигандам. Константа взаимодействия 1 J CH обычно снижается до 70–100 Гц по сравнению с 125 Гц, ожидаемой для нормальной связи sp 3 углерод-водород.
Сила связи [ править ]
На основе экспериментальных и расчетных исследований стабилизация, возникающая в результате агостического взаимодействия, оценивается в 10–15 ккал / моль. Недавние расчеты с использованием констант податливости указывают на более слабую стабилизацию (<10 ккал / моль). [6] Таким образом, агостические взаимодействия сильнее, чем у большинства водородных связей . Агостические связи иногда играют роль в катализе, увеличивая «жесткость» в переходных состояниях. Например, в катализе Циглера-Натта высокоэлектрофильный металлический центр имеет агостические взаимодействия с растущей полимерной цепью. Эта повышенная жесткость влияет на стереоселективность процесса полимеризации.
Связанные взаимодействия [ править ]
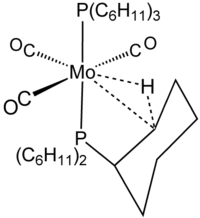
Термин агостик зарезервирован для описания двухэлектронных, трехцентровых связывающих взаимодействий между углеродом, водородом и металлом. Двухэлектронная трехцентровая связь явно участвует в комплексообразовании H 2 , например, в W (CO) 3 (PCy 3 ) 2 H 2 , который тесно связан с агостическим комплексом, показанным на рисунке. [8] Силан часто связывается с металлическими центрами посредством агостических трехцентровых взаимодействий Si┄H − M. Однако, поскольку эти взаимодействия не включают углерод, они не классифицируются как агостические.
Анагостические связи [ править ]
Определенные взаимодействия M┄H-C не классифицируются как агостические, но описываются термином анагостатические . Анагостические взаимодействия имеют более электростатический характер. С точки зрения структуры анагостических взаимодействий расстояния M┄H и углы M┄H − C попадают в диапазоны 2.3–2.9 Å и 110–170 ° соответственно. [2] [9]
Функция [ править ]
Агостические взаимодействия выполняют ключевую функцию в полимеризации и стереохимии алкенов , а также в миграционной вставке .
Ссылки [ править ]
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Онлайн-исправленная версия: (2006–) « Агостическое взаимодействие ». DOI : 10,1351 / goldbook.AT06984
- ^ а б Брукхарт, Морис ; Грин, Малькольм LH (1983). «Связи углерод-водород-переходный металл». J. Organomet. Chem . 250 : 395–408. DOI : 10.1016 / 0022-328X (83) 85065-7 ..
- ^ Брукхарт, Морис ; Грин, Малькольм LH ; Паркин, Джерард (2007). «Агостические взаимодействия в соединениях переходных металлов» . Proc. Natl. Акад. Sci . 104 (17): 6908–14. Bibcode : 2007PNAS..104.6908B . DOI : 10.1073 / pnas.0610747104 . PMC 1855361 . PMID 17442749 .
- ^ La Placa, Сэм Дж .; Иберс, Джеймс А. "Пятикоординированный комплекс d 6 : структура дихлортрис (трифенилфосфин) рутения (II)". Неорг. Chem . DOI : 10.1021 / ic50028a002 .
- ^ Z. Dawoodi; MLH Green; VSB Mtetwa; К. Прут; AJ Schultz; Дж. М. Уильямс; TF Koetzle (1986). «Доказательства взаимодействий углерод-водород-титан: синтез и кристаллические структуры агостических алкилов [TiCl 3 (Me 2 PCH 2 CH 2 PMe 2 ) R] (R = Et или Me)» . J. Chem. Soc., Dalton Trans. : 1629. DOI : 10.1039 / dt9860001629 .
- ^ Фон Франциус, Герд; Штройбель, Райнер; Брандхорст, Кай; Грюненберг, Йорг (2006). «Насколько сильна агостическая связь? Прямая оценка агостических взаимодействий с использованием обобщенной матрицы соответствия». Металлоорганические соединения . 25 (1): 118–121. DOI : 10.1021 / om050489a .
- ↑ Никонов, GI (2005). «Последние достижения в неклассических межлигандных SiH-взаимодействиях». Adv. Органомет. Chem . Успехи металлоорганической химии. 53 : 217–309. DOI : 10.1016 / s0065-3055 (05) 53006-5 . ISBN 9780120311538.
- ^ Кубас, GJ (2001). Комплексы дигидрогенов металлов и σ-связей . Нью-Йорк: Kluwer Academic. ISBN 978-0-306-46465-2.
- ^ Брага, Д .; Grepioni, F .; Tedesco, E .; Biradha, K .; Дезираджу, GR (1997). «Водородная связь в металлоорганических кристаллах. 6. Водородные связи X − H┄M и псевдоагостические связи M┄ (H − X)». Металлоорганические соединения . 16 (9): 1846–1856. DOI : 10.1021 / om9608364 .
Внешние ссылки [ править ]
- Агостические взаимодействия
