| фактор комплемента D (адипсин) | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Идентификаторы | |||||||
| Символ | CFD | ||||||
| Альт. символы | DF, PFD | ||||||
| Ген NCBI | 1675 | ||||||
| HGNC | 2771 | ||||||
| OMIM | 134350 | ||||||
| RefSeq | NM_001928 | ||||||
| UniProt | P00746 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 19 п. 13.3 | ||||||
| |||||||
Фактор D ( EC 3.4.21.46 , С3 proactivator конвертаза , пропердин фактор D эстеразы , фактор D (комплемент) , комплемент - фактор D , CFD , адипсин ) на белка , который у человека кодируется с помощью CFD гена . [3] Фактор D участвует в альтернативном пути комплемента в системе комплемента , где он расщепляет фактор B .
Функция [ править ]
Белок , кодируемый этим геном является членом трипсина семейства пептидаз . Кодируемый белок является компонентом альтернативного пути комплемента, наиболее известного своей ролью в гуморальном подавлении инфекционных агентов. Этот белок также является сериновой протеазой, которая секретируется адипоцитами в кровоток. Наконец, кодируемый белок имеет высокий уровень экспрессии в жире, что предполагает роль жировой ткани в биологии иммунной системы. [3]
Фактор D представляет собой сериновую протеазу, которая стимулирует транспорт глюкозы для накопления триглицеридов в жировых клетках и ингибирует липолиз . [4]
Клиническое значение [ править ]
Уровень фактора D снижен [5] у пациентов с ожирением. Это снижение может быть связано с высокой активностью или сопротивлением, но точная причина полностью не известна.
Структура [ править ]
Все члены семейства сериновых протеаз химотрипсина имеют очень похожие структуры. Во всех случаях, включая фактор D, существуют два антипараллельных домена β-бочонка, каждый из которых содержит шесть β-цепей с одинаковой типологией во всех ферментах. Основное различие в структуре основной цепи между фактором D и другими сериновыми протеазами семейства химотрпсина заключается в поверхностных петлях, соединяющих вторичные структурные элементы. Фактор D демонстрирует различные конформации основных каталитических и связывающих субстрат остатков, обычно обнаруживаемых в семействе хротрипсина. Эти особенности предполагают, что каталитическая активность фактора D запрещена, если конформационные изменения не вызваны перестройкой. [6]
Механизм действия [ править ]
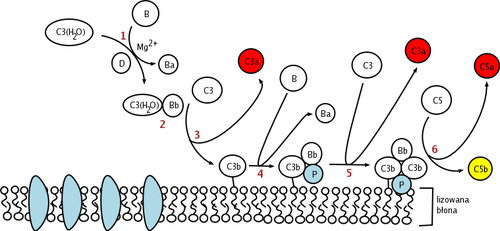
Фактор D представляет собой сериновую протеазу, присутствующую в крови и тканях в активной последовательности, но самоингибирующейся конформации. Единственным известным природным субстратом фактора D является фактор B, и расщепление ножницеобразной связи Arg 234 -Lys 235 в факторе B приводит к образованию двух фрагментов фактора B, Ba и Bb. Прежде чем может произойти расщепление ножницеобразной связи в факторе B, фактор B должен сначала связываться с C3b, прежде чем образовать комплекс C3bB. [7] Предполагается, что это конформационное изменение фактора B в комплексе C3bB позволяет фактору B соответствовать сайту связывания фактора D.
Каталитическая триада фактора D состоит из Asp 102 , His 57 и Ser 195 . Другими ключевыми компонентами фактора D являются солевой мостик Asp 189 -Arg 218, который стабилизирует самоингибирующую петлю (аминокислотные остатки с 212 по 218) и боковую цепь His 57 в неканонической конформации. [8] [9] В своей ингибированной форме самоингибирующая петля предотвращает доступ фактора B к фактору D. Когда комплекс C3bB приближается к самоингибированной конформации фактора D, C3bB вытесняет солевой мостик в факторе D и приводит к образованию нового солевого мостика между Arg 234 фактора B и Asp 189 фактора D. [10][11] Смещение солевого мостика фактора D приводит к перестройке самоингибиторной петли и вращению гистидиновой боковой цепи активного сайта, создавая каноническую форму фактора D. Затем следует расщепление ножницеобразной связи в факторе B. , высвобождая фрагмент Ва и образуя C3bBb, альтернативный путь C3-конвертазы . [12]
Неканонической конформации фактора D подавляется само-ингибирующей петли (синий). Солевой мостик Asp-Arg (пурпурные и оранжевые боковые цепи соответственно) стабилизирует петлю самоингибирования. Каталитическая триада показана зеленым цветом. [13] | Канонические конформации фактор D не является самой-тормозится. Солевой мостик Asp-Arg (пурпурная и оранжевая боковые цепи соответственно) был смещен, что привело к смещению петли самоингибирования (синий). Каталитическая триада показана зеленым цветом. [14] |
Регламент [ править ]
Фактор D синтезируется печенью и адипоцитами, причем последние являются основным источником. Секретируемая проформа фактора D расщепляется MASP-3 с образованием активной последовательности, которая циркулирует в организме. [15] Фактор D поддерживает чрезвычайно высокую субстратную специфичность и, как следствие, не имеет известных естественных ингибиторов в организме. [16] Однако большая часть фактора D остается в самоингибированной форме, которая ограничивает доступ субстрата к каталитическому сайту. Фактор D имеет молекулярную массу 23,5 кДа и присутствует в концентрации 1,8 мг / л крови у здоровых людей. Скорость синтеза фактора составляет приблизительно 1,33 мг / кг / день, и большая часть фактора D выводится через почки после катаболизма в проксимальных канальцах.после реабсорбции. Чистый эффект - высокая фракционная скорость метаболизма 60% в час. [17] У пациентов с нормальной функцией почек фактор D не обнаруживался в моче. Однако у пациентов с почечной недостаточностью уровень фактора D был повышен. Альтернативный путь может работать даже при низких уровнях фактора D, а дефицит уровня фактора D встречается редко. [18] [19]
Роль в болезнях [ править ]
Точечная мутация, приводящая к замене серинового кодона (Ser 42 в необработанной метиониновой форме фактора D) стоп-кодоном (TAG) в гене фактора D на хромосоме 19, была задокументирована как причина дефицита фактора D. [20] Дефицит фактора D может вызвать повышенную восприимчивость к бактериальным инфекциям, особенно к инфекциям Neisseria . Тип наследования дефицита фактора D является аутосомно-рецессивным, и люди с мутацией только в одном аллеле могут не иметь такой же предрасположенности к повторным инфекциям. У пациента с рецидивирующими инфекциями полное улучшение состояния было получено при введении очищенного фактора D. [21]
Заболевания с чрезмерной активацией комплемента включают пароксизмальную ночную гемоглобинурию (ПНГ), а ингибиторы фактора D могут быть полезны при лечении ПНГ. Низкомолекулярные ингибиторы фактора D находятся в стадии разработки для лечения ПНГ, и один низкомолекулярный ингибитор, ACH-4471, показал многообещающие результаты в фазе 2 клинических испытаний ингибирования фактора D в сочетании с экулизумабом . Пациенты, получающие лечение ингибиторами фактора D, должны быть иммунизированы против инфекций, чтобы избежать повторных инфекций, как у пациентов с дефицитом фактора D. [22] [23]
Ссылки [ править ]
- ^ PDB : 1HFD
- Перейти ↑ Narayana SV, Carson M, el-Kabbani O, Kilpatrick JM, Moore D, Chen X, Bugg CE, Volanakis JE, DeLucas LJ (1994). «Структура человеческого фактора D. Белок системы комплемента при разрешении 2,0 A». Журнал молекулярной биологии . 235 (2): 695–708. DOI : 10.1006 / jmbi.1994.1021 . PMID 8289289 .
- ^ а б EntrezGene 1675
- ^ Ronti T, Lupattelli G, Mannarino E (2006). «Эндокринная функция жировой ткани: обновление» . Клиническая эндокринология . 64 (4): 355–65. DOI : 10.1111 / j.1365-2265.2006.02474.x . PMID 16584505 . S2CID 12455240 .
- ^ Флиер JS, Кук К., Usher P, Spiegelman BM (1987). «Сильно нарушенная экспрессия адипсина при генетическом и приобретенном ожирении». Наука . 237 (4813): 405–8. Bibcode : 1987Sci ... 237..405F . DOI : 10.1126 / science.3299706 . PMID 3299706 .
- ^ Volanakis JE, Нараяна С.В. (1996). «Фактор комплемента D, новая сериновая протеаза» . Белковая наука . 5 (4): 553–64. DOI : 10.1002 / pro.5560050401 . PMC 2143395 . PMID 8845746 .
- ^ Лесавр, PH; Мюллер-Эберхард, HJ (1 декабря 1978 г.). «Механизм действия фактора D альтернативного пути комплемента» . Журнал экспериментальной медицины . 148 (6): 1498–509. DOI : 10,1084 / jem.148.6.1498 . PMC 2185104 . PMID 82604 .
- ^ Цзин, H; Бабу Ю.С.; Мур, Д.; Килпатрик, JM; Лю, XY; Volanakis, JE; Нараяна, SV (9 октября 1998 г.). «Структуры нативного и комплексного фактора комплемента D: влияние атипичной конформации His57 и самоингибиторной петли в регуляции специфической активности сериновой протеазы». Журнал молекулярной биологии . 282 (5): 1061–81. DOI : 10.1006 / jmbi.1998.2089 . PMID 9753554 .
- ^ Цзин, H; Macon, KJ; Мур, Д.; ДеЛукас, LJ; Volanakis, JE; Нараяна, SV (15 февраля 1999 г.). «Структурная основа активации профактора D: от очень гибкого зимогена до новой самоингибирующейся сериновой протеазы, фактора комплемента D.» Журнал EMBO . 18 (4): 804–14. DOI : 10.1093 / emboj / 18.4.804 . PMC 1171173 . PMID 10022823 .
- ^ Карки, RG; Пауэрс, Дж; Mainolfi, N; Андерсон, К; Belanger, DB; Лю, Д; Ji, N; Jendza, K; Гелин, CF; Мак Суини, А; Соловей, К; Дельгадо, О; Кроули, М; Liao, SM; Аргикар, UA; Flohr, S; Ла Бонте, LR; Lorthiois, EL; Вульпетти, А; Браун, А; Длинный, D; Прентисс, М; Граду, Н; де Эркенез, А; Тмин, F; Адамс, К; Джеффи, B; Моги, М. (9 мая 2019 г.). «Дизайн, синтез и доклиническая характеристика селективных ингибиторов фактора D, направленных на альтернативный путь комплемента». Журнал медицинской химии . 62 (9): 4656–4668. DOI : 10.1021 / acs.jmedchem.9b00271 . PMID 30995036 .
- ^ Форнерис, F; Риклин, Д; Ву, Дж; Цеку, А; Уоллес, РС; Lambris, JD; Gros, P (24 декабря 2010 г.). «Структуры C3b в комплексе с факторами B и D дают представление об образовании конвертазы комплемента» . Наука . 330 (6012): 1816–20. Bibcode : 2010Sci ... 330.1816F . DOI : 10.1126 / science.1195821 . PMC 3087196 . PMID 21205667 .
- ^ Вульпетти, А; Randl, S; Рюдиссер, S; Остерманн, Н; Эрбель, П; Мак Суини, А; Золлер, Т; Салем, Б; Герхарц, B; Тмин, F; Hommel, U; Dalvit, C; Lorthiois, E; Майбаум, Дж. (9 марта 2017 г.). «Структурный дизайн библиотеки и скрининг фрагментов для идентификации обратимых ингибиторов протеазы фактора комплемента D». Журнал медицинской химии . 60 (5): 1946–1958. DOI : 10.1021 / acs.jmedchem.6b01684 . PMID 28157311 .
- ^ Maibaum, J; Liao, SM; Вульпетти, А; Остерманн, Н; Randl, S; Рюдиссер, S; Lorthiois, E; Эрбель, П; Кинзель, Б; Колб, Ф.А.; Барбьери, S; Вагнер, Дж; Дюран, К; Феттис, К; Dussauge, S; Hughes, N; Дельгадо, О; Hommel, U; Гулд, Т; Мак Суини, А; Герхарц, B; Тмин, F; Flohr, S; Шубарт, А; Джеффи, B; Харрисон, Р. Ризитано, AM; Эдер, Дж; Андерсон, К. (декабрь 2016 г.). «Низкомолекулярные ингибиторы фактора D, нацеленные на альтернативный путь комплемента». Природа Химическая биология . 12 (12): 1105–1110. DOI : 10.1038 / nchembio.2208 . PMID 27775713 .
- ^ Вульпетти, А; Остерманн, Н; Randl, S; Юн, Т; Мак Суини, А; Тмин, F; Lorthiois, E; Рюдиссер, S; Эрбель, П; Майбаум, Дж. (10 мая 2018 г.). «Открытие и дизайн первых лигандов на основе бензиламина, связывающихся с разблокированной конформацией фактора комплемента D.» Письма по медицинской химии ACS . 9 (5): 490–495. DOI : 10.1021 / acsmedchemlett.8b00104 . PMC 5949727 . PMID 29795765 .
- ^ Хаяси, М; Мачида, Т; Ishida, Y; Огата, Y; Омори, Т; Такасуми, М; Эндо, Y; Сузуки, Т; Секимата, М; Homma, Y; Икава, М; Охира, H; Fujita, T; Sekine, H (15 сентября 2019 г.). «Передний край: роль MASP-3 в физиологической активации фактора D альтернативного пути комплемента» . Журнал иммунологии . 203 (6): 1411–1416. DOI : 10.4049 / jimmunol.1900605 . PMID 31399515 . S2CID 199518699 .
- ^ Lorthiois, E; Андерсон, К; Вульпетти, А; Рогель, О; Тмин, F; Остерманн, Н; Steinbacher, S; Мак Суини, А; Дельгадо, О; Liao, SM; Randl, S; Рюдиссер, S; Dussauge, S; Феттис, К; Киффер, Л; де Эркенез, А; Ян, Л; Hartwieg, C; Аргикар, UA; Ла Бонте, LR; Ньютон, R; Kansara, V; Flohr, S; Hommel, U; Джеффи, B; Майбаум, Дж. (13 июля 2017 г.). «Открытие сильнодействующих и селективных обратимых маломолекулярных ингибиторов фактора D, демонстрирующих ингибирование альтернативного пути комплемента in vivo». Журнал медицинской химии . 60 (13): 5717–5735. DOI : 10.1021 / acs.jmedchem.7b00425 . PMID 28621538 .
- ^ Добо, J; Кочиш, А; Гал, П (2018). «Быть на цели: стратегии нацеливания на альтернативные компоненты и компоненты лектинового пути при заболеваниях, опосредованных комплементом» . Границы иммунологии . 9 : 1851. DOI : 10.3389 / fimmu.2018.01851 . PMC 6092519 . PMID 30135690 .
- ^ Volanakis, JE; Barnum, SR; Гидденс, М; Галла, Дж. Х. (14 февраля 1985 г.). «Почечная фильтрация и катаболизм белка комплемента D.». Медицинский журнал Новой Англии . 312 (7): 395–9. DOI : 10.1056 / NEJM198502143120702 . PMID 3844050 .
- ^ Паскуаль, М; Steiger, G; Estreicher, J; Macon, K; Volanakis, JE; Шифферли, Дж. А. (октябрь 1988 г.). «Метаболизм фактора комплемента D при почечной недостаточности». Kidney International . 34 (4): 529–36. DOI : 10.1038 / ki.1988.214 . PMID 3199673 .
- ^ Biesma, DH; Hannema, AJ; van Velzen-Blad, H; Малдер, Л; van Zwieten, R; Kluijt, I; Роос, Д. (июль 2001 г.). «Семья с дефицитом фактора комплемента D» . Журнал клинических исследований . 108 (2): 233–40. DOI : 10.1172 / JCI12023 . PMC 203023 . PMID 11457876 .
- ^ Hiemstra, PS; Langeler, E; Compier, B; Хранители, Y; Leijh, PC; van den Barselaar, MT; Овербош, Д; Даха, MR (декабрь 1989 г.). «Полный и частичный дефицит фактора комплемента D в голландской семье» . Журнал клинических исследований . 84 (6): 1957–61. DOI : 10.1172 / JCI114384 . PMC 304077 . PMID 2687330 .
- ^ Юань, X; Гавриилаки, Э; Thanassi, JA; Ян, G; Бейнс, AC; Подос, СД; Хуанг, Y; Хуанг, М; Бродский, Р.А. (март 2017 г.). «Ингибиторы низкомолекулярного фактора D избирательно блокируют альтернативный путь комплемента при пароксизмальной ночной гемоглобинурии и атипичном гемолитико-уремическом синдроме» . Haematologica . 102 (3): 466–475. DOI : 10,3324 / haematol.2016.153312 . PMC 5394948 . PMID 27810992 .
- ^ Risitano, AM (январь 2014). «Лечение антикомплементом при пароксизмальной ночной гемоглобинурии: где мы находимся и куда мы идем» . Трансляционная медицина @ UniSa . 8 : 43–52. PMC 4000462 . PMID 24778997 .
Внешние ссылки [ править ]
- Дополнение + Фактор + D в Национальной медицинской библиотеке США по предметным заголовкам по медицинским предметам (MeSH)
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в общественном достоянии .