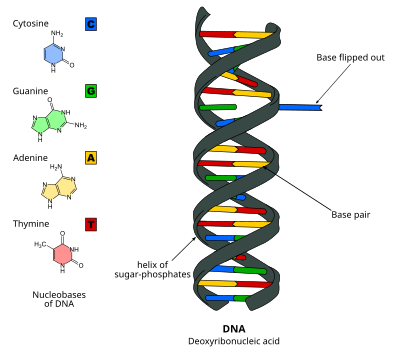
Переворачивание оснований ДНК , или переворачивание нуклеотидов , представляет собой механизм, при котором одно нуклеотидное основание или нуклеотидное основание вращается вне двойной спирали нуклеиновой кислоты. [1] Это происходит, когда ферменту, обрабатывающему нуклеиновую кислоту, необходим доступ к основанию для выполнения работы с ним, такой как его удаление для замены другим основанием во время репарации ДНК . Это было впервые отмечено в 1994 году с помощью рентгеновской кристаллографии в метилтрансферазы фермент , катализирующий метилирования цитозина основания в ДНК. С тех пор было показано, что он используется различными ферментами во многих биологических процессах, таких как метилирование ДНК., Различные репарации ДНК механизмы и ДНК репликации . Это также может происходить в двойных спиралях РНК [2] или в промежуточных соединениях ДНК: РНК, образующихся во время транскрипции РНК .
Переворот оснований ДНК происходит за счет разрыва водородных связей между основаниями и отделения основания от его соседей. Это может происходить посредством активного процесса, когда фермент связывается с ДНК и затем способствует вращению основания, или пассивного процесса, когда основание вращается самопроизвольно, и это состояние распознается и связывается ферментом. Его можно обнаружить с помощью рентгеновской кристаллографии , ЯМР-спектроскопии , флуоресцентной спектроскопии или гибридизационных зондов .
Открытие [ править ]
Переворачивание оснований впервые было обнаружено в 1994 году, когда исследователи Климасаускас, Кумар, Робертс и Ченг использовали рентгеновскую кристаллографию для изучения промежуточной стадии химической реакции метилтрансферазы, связанной с ДНК . [3] Метилтрансфераза, которую они использовали, представляла собой C5- цитозинметилтрансферазу из Haemophilus haemolyticus (M. HhaI). Этот фермент распознает конкретную последовательность ДНК (5'-GCGC-3 ') и метилирует первое цитозиновое основание последовательности в ее месте C5. [3] После кристаллизации комплекса M. HhaI-ДНК они увидели, что целевое цитозиновое основание полностью развернулось из двойной спирали и расположилось в активном центре M. HhaI. Это поддерживалось многочисленными взаимодействиями между M. HhaI и ДНК. [3]
Авторы предположили, что переворот оснований был механизмом, используемым многими другими ферментами, такими как геликазы , ферменты рекомбинации , РНК-полимеразы , ДНК-полимеразы и топоизомеразы типа II . [3] За годы, последовавшие за этим открытием, было проведено много исследований, и было обнаружено, что переворачивание оснований является механизмом, используемым во многих биологических процессах, предлагаемых авторами. [4] [5] [6]
Механизм [ править ]
Нуклеотиды ДНК удерживаются вместе водородными связями , которые относительно слабы и могут быть легко разорваны. Переворот базы происходит в миллисекундном масштабе времени [7] за счет разрыва водородных связей между основаниями и отделения основания от его соседей. [8] Основание разворачивается из двойной спирали на 180 градусов, [9] обычно через большую бороздку , [10] в активный центр фермента. Это открытие приводит к небольшим конформационным изменениям в основной цепи ДНК [11], которые быстро стабилизируются за счет усиления взаимодействий фермент-ДНК. [12] Исследования, посвященные свободной энергиипрофили переворота основания показали, что барьер свободной энергии для переворота может быть снижен на 17 ккал / моль для M.HhaI в закрытой конформации . [10]
Существует два механизма переворота оснований ДНК: активный и пассивный. [13] При активном механизме фермент связывается с ДНК, а затем активно вращает основание, в то время как при пассивном механизме поврежденное основание сначала спонтанно вращается, а затем распознается и связывается ферментом. [8] Исследования продемонстрировали оба механизма: урацил-ДНК-гликозилаза следует пассивному механизму [8], а транспозаза Tn10 следует активному механизму. [14]
Кроме того, исследования показали, что переключение оснований ДНК используется многими различными ферментами в различных биологических процессах, таких как метилирование ДНК , различные механизмы репарации ДНК , транскрипция РНК и репликация ДНК . [4] [5] [6]
Биологические процессы [ править ]
Модификация и восстановление ДНК [ править ]
В ДНК могут быть мутации , вызывающие повреждение основания цепи ДНК. Чтобы гарантировать генетическую целостность ДНК, ферменты должны восстанавливать любые повреждения. Есть много типов восстановления ДНК . Базовая эксцизионная репарация использует переворот основания, чтобы перевернуть поврежденное основание из двойной спирали [5] в карман специфичности гликозилазы, которая гидролизует гликозидную связь и удаляет основание. [15] ДНК-гликозилазы взаимодействуют с ДНК, меняя основания для определения несоответствия. Пример эксцизионной репарации оснований происходит, когда основание цитозина дезаминируется и становится основанием урацила. Это вызывает неправильную пару U: G, которая обнаруживается урацил-ДНК-гликозилазой.. Основание урацила переворачивается в активный карман гликозилазы, где оно удаляется из цепи ДНК. [16] Переключение оснований используется для исправления таких мутаций, как 8-оксогуанин (oxoG) [17] и димеры тимина, созданные УФ-излучением. [15] [18]
Репликация, транскрипция и рекомбинация [ править ]
И репликация ДНК, и транскрипция РНК используют переворачивание оснований. [5] ДНК-полимераза - это фермент, осуществляющий репликацию. Его можно рассматривать как руку, которая сжимает однонитевую матрицу ДНК. [15] По мере того, как шаблон проходит через область ладони полимеразы, основания шаблона выворачиваются из спирали и от сайта связывания dNTP . [19] Во время транскрипции РНК-полимераза катализирует синтез РНК. Во время фазы инициации две базы в элементе -10вывернуть из спирали в два кармана в РНК-полимеразе. Эти новые взаимодействия стабилизируют элемент -10 и способствуют разделению или плавлению цепей ДНК. [15] [20]
Переворот базы происходит на последних стадиях рекомбинации . [21] RecA - это белок, который способствует инвазии цепи [15] во время гомологичной рекомбинации . Переворот оснований был предложен как механизм, с помощью которого RecA может позволить одной цепи распознавать гомологию в дуплексной ДНК. [22] Другие исследования указывают на то, что он также участвует в V (D) J рекомбинация . [23]
Метилирование ДНК [ править ]
Метилирование ДНК - это процесс, в котором метильная группа добавляется либо к цитозину, либо к аденину . [24] Этот процесс вызывает активацию или инактивацию экспрессии генов , что приводит к регуляции генов в эукариотических клетках. Также известно, что процесс метилирования ДНК вовлечен в формирование определенных типов рака . [25] [26] [27] Для того, чтобы эта химическая модификация произошла, необходимо, чтобы основание-мишень выворачивалось из двойной спирали ДНК, чтобы позволить метилтрансферазам катализировать реакцию. [5]
Распознавание цели рестрикционными эндонуклеазами [ править ]
Эндонуклеазы рестрикции, также известные как рестрикционные ферменты, представляют собой ферменты, которые расщепляют сахарно-фосфатный остов ДНК по определенным нуклеотидным последовательностям, которые обычно имеют длину от четырех до шести нуклеотидов. [28] Исследования, проведенные Хортоном и его коллегами, показали, что механизм, с помощью которого эти ферменты расщепляют ДНК, включает в себя переворачивание оснований, а также изгиб ДНК и расширение малой бороздки . [29] В 2006 году Хортон и его коллеги представили доказательства рентгеновской кристаллографии, показывающие, что эндонуклеаза рестрикции HinP1I использует переворот оснований для распознавания своей целевой последовательности. Этот ферменткак известно, расщепляет ДНК по палиндромной тетрануклеотидной последовательности G ↓ CGC.
Экспериментальные подходы к обнаружению [ править ]
Рентгеновская кристаллография [ править ]
Рентгеновская кристаллография - это метод измерения углов и интенсивности кристаллических атомов для определения атомной и молекулярной структуры интересующего кристалла. Затем кристаллографы могут создать трехмерное изображение, на котором можно определить положение атомов , химические связи, а также другие важные характеристики. [30] Климасаукас и его коллеги использовали эту технику для наблюдения первого явления переворота базы, в котором их экспериментальная процедура включала несколько этапов: [3]
- Очищение
- Кристаллизация
- Сбор информации
- Определение и уточнение структуры
Во время очистки метилтрансфераза Haemophilus haemolyticus была сверхэкспрессирована и очищена с использованием стадии обратной экстракции с высоким содержанием соли для селективной солюбилизации M.HhaI с последующей быстрой жидкостной хроматографией белка ( FPLC ), как это было сделано ранее Кумаром и его коллегами. [31] Авторы использовали анионообменную колонку Mono-Q для удаления небольшого количества белковогоматериалы и нежелательная ДНК до стадии кристаллизации. После успешной очистки M.HhaI образец был затем выращен с использованием метода, который смешивает раствор, содержащий комплекс, при температуре 16 ° C и метод диффузии пара висячей капли для получения кристаллов. Затем авторы смогли собрать рентгеновские данные в соответствии с методом, использованным Ченгом и его коллегами в 1993 году. [32] Этот метод включал измерение интенсивности дифракции на детекторе FAST, где время экспозиции для вращения на 0,1 ° составляло 5 или 10 секунд. Для определения и уточнения структуры Климасаукас и его коллеги использовали молекулярную замену уточненной структуры апо, описанную Ченгом и его коллегами в 1993 г. [32], где модели поиска X-PLOR, MERLOT и TRNSUM использовались для решения функций вращения и перевода. [33] [34] Эта часть исследования включает использование разнообразного программного обеспечения и компьютерных алгоритмов для определения структур и характеристик интересующего кристалла.
ЯМР-спектроскопия [ править ]
ЯМР-спектроскопия - это метод, который использовался на протяжении многих лет для изучения важных динамических аспектов переворота основания. Этот метод позволяет исследователям определять физические и химические свойства атомов и других молекул, используя магнитные свойства атомных ядер . [35] Кроме того, ЯМР может предоставить различную информацию, включая структуру, реакционные состояния , химическое окружение молекул и динамику. [36] [37] Во время эксперимента по открытию переворота оснований ДНК исследователи использовали ЯМР-спектроскопию для изучения индуцированного ферментом переворота оснований метилтрансферазы HhaI. Для проведения этого эксперимента два 5-фторцитозинаостатки были включены в составе мишени и опорное положение с подложкой ДНК таким образом , 19 Анализ химического сдвига F может быть выполнен. После оценки анализа химического сдвига 19 F был сделан вывод о существовании комплексов ДНК с множественными формами целевого 5-фторцитозина на пути переворота оснований. [38]
Флуоресцентная спектроскопия [ править ]
Флуоресцентная спектроскопия - это метод, который используется для анализа образца с помощью флуоресцентного зонда. Сами нуклеотиды ДНК не являются хорошими кандидатами для этого метода, потому что они с трудом переизлучают свет при возбуждении светом. [39] Флуоресцентный маркер необходим для обнаружения переворота основания. 2-Аминопурин - это основание, которое структурно похоже на аденин , но очень флуоресцирует при выходе из дуплекса ДНК. [40] Он обычно используется для обнаружения переворота оснований и имеет возбуждение при 305–320 нм и испускание при 370 нм, так что он хорошо отделен от возбуждений белков и ДНК. Другими флуоресцентными зондами, используемыми для изучения переворота оснований ДНК, являются 6MAP (4 ‑ амино ‑ 6 ‑ метил ‑ 7 (8H) ‑ птеридон).[41] и пирроло-C (3- [β-D-2-рибофуранозил] -6-метилпирроло [2,3-d] пиримидин-2 (3H) -он). [42] [43] Флуоресцентная спектроскопия с временным разрешением также используется для получения более подробной картины степени переворота оснований, а также конформационной динамики, происходящей во время переворота оснований. [44]
Исследование гибридизации [ править ]
Зонды гибридизации можно использовать для обнаружения переворота основания. В этом методе используется молекула, которая имеет последовательность, комплементарную последовательности, которую вы хотите обнаружить, так что она связывается с однонитевой цепью ДНК или РНК. Несколько гибридизационных зондов были использованы для обнаружения переворота оснований. Перманганат калия используется для обнаружения остатков тимина , которые были удалены цитозин-C5 и аденин-N6 метилтрансферазами . [45] Хлорацетальдегид используется для обнаружения остатков цитозина, перевернутых ДНК-цитозин-5-метилтрансферазой HhaI (M. HhaI). [46]
См. Также [ править ]
- Ремонт ДНК
- Базовая эксцизионная пластика
- Репликация ДНК
- Транскрипция РНК
- Метилирование ДНК
- ДНК-метилтрансфераза
- Генетическая рекомбинация
- Гомологичная рекомбинация
- ДНК
- Эпигенетика
- Эпигеномика
Ссылки [ править ]
- ^ Робертс, RJ; Ченг, X (1998). «Базовое переворачивание» . Ежегодный обзор биохимии . 67 (1): 181–198. DOI : 10.1146 / annurev.biochem.67.1.181 . PMID 9759487 .
- ^ Райтер, Нью-Джерси; Blad, H; Abildgaard, F; Мясник, SE (2004). «Динамика внутримолекулярной стебель-петли РНК U6: конформационное изменение переворота основания». Биохимия . 43 (43): 13739–47. DOI : 10.1021 / bi048815y . PMID 15504036 . S2CID 25391616 .
- ^ a b c d e Климасаускас, Саулюс; Кумар, Санджай; Робертс, Ричард Дж .; Чэн, Сяодун (январь 1994 г.). «Хал-метилтрансфераза переворачивает целевое основание из спирали ДНК». Cell . 76 (2): 357–369. DOI : 10.1016 / 0092-8674 (94) 90342-5 . PMID 8293469 .
- ^ а б Браун, Том. «Книга нуклеиновых кислот» . Проверено 26 февраля 2014 года .
- ^ a b c d e Хуанг, Ниу; Нилеш К. Банавали; Александр Д. МакКерелл (7 января 2003 г.). «Белок-облегченный переворачивание оснований в ДНК цитозин-5-метилтрансферазой» . PNAS . 100 (1): 68–73. Bibcode : 2003PNAS..100 ... 68H . DOI : 10.1073 / pnas.0135427100 . PMC 140885 . PMID 12506195 .
- ^ a b Грубмюллер, Гельмут. «Перевертывание базы ДНК» . Проверено 26 февраля 2014 года .
- ^ Бувье, Бенджамин; Грубмюллер, Гельмут (август 2007 г.). «Исследование молекулярной динамики медленного переворота оснований в ДНК с использованием конформационного затопления» (PDF) . Биофизический журнал . 93 (3): 770–786. Bibcode : 2007BpJ .... 93..770B . DOI : 10.1529 / biophysj.106.091751 . PMC 1913169 . PMID 17496048 .
- ^ a b c Ларивьер, Л. (23 июня 2004 г.). «Структурные доказательства пассивного механизма переворота оснований для глюкозилтрансферазы» . Журнал биологической химии . 279 (33): 34715–34720. DOI : 10.1074 / jbc.M404394200 . PMID 15178685 .
- ^ Грожан, [отредактированный] Анри (2009). Ферменты модификации ДНК и РНК: структура, механизм, функции и эволюция . Остин, Техас: Landes Bioscience. ISBN 978-1-58706-329-9. Архивировано из оригинала на 2014-04-07 . Проверено 10 марта 2014 .CS1 maint: дополнительный текст: список авторов ( ссылка )
- ^ a b Huang, N .; Банавали, Н.К .; МакКерелл, AD (27 декабря 2002 г.). «Белок-облегченный переворачивание оснований в ДНК цитозин-5-метилтрансферазой» . Труды Национальной академии наук . 100 (1): 68–73. DOI : 10.1073 / pnas.0135427100 . PMC 140885 . PMID 12506195 .
- ^ Giudice, E. (1 марта 2003). «Открытие пары оснований в B-ДНК: пути свободной энергии для пар GC и AT из моделирования зонтичной выборки» . Исследования нуклеиновых кислот . 31 (5): 1434–1443. DOI : 10.1093 / NAR / gkg239 . PMC 149832 . PMID 12595551 .
- ^ Хуанг, N .; Банавали, Н.К .; МакКерелл, AD (27 декабря 2002 г.). «Белок-облегченный переворачивание оснований в ДНК цитозин-5-метилтрансферазой» . Труды Национальной академии наук . 100 (1): 68–73. DOI : 10.1073 / pnas.0135427100 . PMC 140885 . PMID 12506195 .
- ^ О'Нил, Лорен. Перевернутое основание в ДНК: обнаружение, структура и энергия, Диссертация . ISBN 9780549590743. Проверено 15 марта 2014 .
- ^ Bischerour, Жюльен; Чалмерс, Рональд; Белинский, Аня-Катрин (10 июля 2009 г.). «Базовый поворот в транспозиции Tn10: активный механизм переворота и захвата» . PLOS ONE . 4 (7): e6201. Bibcode : 2009PLoSO ... 4.6201B . DOI : 10.1371 / journal.pone.0006201 . PMC 2705183 . PMID 19593448 .
- ^ a b c d e Университет, Джеймс Д. Уотсон, Лаборатория Колд-Спринг-Харбор, Таня А. Бейкер, Массачусетский технологический институт, Александр Ганн, Лаборатория Колд-Спринг-Харбор, Майкл Левин, Калифорнийский университет, Беркли, Ричард Лосик, Гарвард ( 2014). Молекулярная биология гена (Седьмое изд.). Бостон: Пирсон / CSH Press. ISBN 978-0-321-76243-6.
- ^ Крокан, Ханс Э; Драблёш, Финн; Слуппхауг, Гейр (16 декабря 2002 г.). «Урацил в ДНК - возникновение, последствия и ремонт» . Онкоген . 21 (58): 8935–8948. DOI : 10.1038 / sj.onc.1205996 . PMID 12483510 .
- ^ Банерджи, Анирбан; Ян, Вэй; Карплюс, Мартин; Вердин, Грегори Л. (31 марта 2005 г.). «Структура фермента репарации, исследующего неповрежденную ДНК, проясняет распознавание поврежденной ДНК». Природа . 434 (7033): 612–618. Bibcode : 2005Natur.434..612B . DOI : 10,1038 / природа03458 . PMID 15800616 .
- ^ Fuxreiter, Моника; Ло, Нин; Едловски, Пал; Саймон, Иштван; Осман, Роман (ноябрь 2002 г.). «Роль переворота оснований в специфическом распознавании поврежденной ДНК восстанавливающими ферментами». Журнал молекулярной биологии . 323 (5): 823–834. DOI : 10.1016 / S0022-2836 (02) 00999-3 . PMID 12417196 .
- ^ Patel, Premal H .; Сузуки, Мотоши; Адман, Элинор; Синкай, Акео; Лоэб, Лоуренс А. (май 2001 г.). «Прокариотическая ДНК-полимераза I: эволюция, структура и механизм« переворота оснований »для выбора нуклеотидов». Журнал молекулярной биологии . 308 (5): 823–837. DOI : 10.1006 / jmbi.2001.4619 . PMID 11352575 . S2CID 16277925 .
- ^ Лим, HM; Ли, HJ; Рой, С .; Адхья, С. (4 декабря 2001 г.). «Мастер» в разрыве оснований во время изомеризации промотора при связывании РНК-полимеразы » . Труды Национальной академии наук . 98 (26): 14849–14852. Bibcode : 2001PNAS ... 9814849L . DOI : 10.1073 / pnas.261517398 . PMC 64947 . PMID 11734629 .
- ^ Волошин, Олег Н .; Камерини-Отеро, Р. Даниэль (сентябрь 2004 г.). «Возвращение к синаптическому комплексу» . Молекулярная клетка . 15 (6): 846–847. DOI : 10.1016 / j.molcel.2004.09.010 . PMID 15383274 .
- ^ Folta-Stogniew, E; О'Мэлли, S; Gupta, R; Андерсон, KS; Раддинг, CM (24 сентября 2004 г.). «Обмен парами оснований ДНК, совпадающий с распознаванием гомологии, обеспечиваемой белком RecA E. coli» . Молекулярная клетка . 15 (6): 965–75. DOI : 10.1016 / j.molcel.2004.08.017 . PMID 15383285 .
- ^ Bischerour, J .; Lu, C .; Рот, DB; Чалмерс, Р. (31 августа 2009 г.). «Перевернутое основание в рекомбинации V (D) J: понимание механизма образования шпильки, правила 12/23 и координации двунитевых разрывов» . Молекулярная и клеточная биология . 29 (21): 5889–5899. DOI : 10.1128 / MCB.00187-09 . PMC 2772739 . PMID 19720743 .
- ^ Клозе, Роберт Дж .; Адриан П. Берд (2006). «Метилирование геномной ДНК: метка и ее медиаторы». Направления биохимических наук . 31 (2): 89–97. DOI : 10.1016 / j.tibs.2005.12.008 . ISSN 0968-0004 . PMID 16403636 .
- ^ Накао, M (2001). «Эпигенетика: взаимодействие метилирования ДНК и хроматина». Джин . 278 (1-2): 25-31. DOI : 10.1016 / s0378-1119 (01) 00721-1 . PMID 11707319 .
- ^ Plass, C; Soloway, PD (2002). «Метилирование ДНК, импринтинг и рак» . Eur J Hum Genet . 10 (1): 6–16. DOI : 10.1038 / sj.ejhg.5200768 . PMID 11896451 .
- ^ Эстеллер, М; Герман, JG (2002). «Рак как эпигенетическое заболевание: метилирование ДНК и изменения хроматина в опухолях человека». J Pathol . 196 (1): 1–7. DOI : 10.1002 / path.1024 . PMID 11748635 .
- ^ "Архивная копия" . Архивировано из оригинала на 2014-04-18 . Проверено 3 апреля 2014 .CS1 maint: заархивированная копия как заголовок ( ссылка )
- ^ Хортон, Джон Р .; Чжан, Син; Маунус, Роберт; Ян, Чжэ; Уилсон, Джеффри; Робертс, Ричард; Чэн, Сяодун (2006). «ДНК Nicking эндонуклеазой HinP1I: изгиб, переворот основания и расширение малых бороздок» . Исследования нуклеиновых кислот . 34 (3): 939–948. DOI : 10.1093 / NAR / gkj484 . PMC 1363774 . PMID 16473850 .
- ^ Рентгеновская кристаллография
- ^ Кумар, S; Ченг, X; Pflugrath, JW; Робертс, Р.Дж. (1992). «Очистка, кристаллизация и предварительный рентгеноструктурный анализ комплекса M.HhaI-AdoMet». Биохимия . 31 (36): 8648–8653. DOI : 10.1021 / bi00151a035 . PMID 1390649 .
- ^ а б Ченг, X; Кумар, S; Posfai, J; Pflugrath, JW; Робертс, Р.Дж. (1993). «Кристаллическая структура ДНК-метилтрансферазы HhaI в комплексе с S-аденозил-L-метионином». Cell . 74 (2): 299–307. DOI : 10.1016 / 0092-8674 (93) 90421-л . PMID 8343957 .
- ^ Brunger AT (1992) «X-PLOR, версия 3.1: система для рентгеновской кристаллографии и ЯМР» (Нью-Хейвен, Коннектикут: Yale University Press)
- ^ Fitzgerald, PMD (1988). «MERLOT, интегральный пакет компьютерных программ для определения кристаллической структуры путем молекулярного замещения» . J. Appl. Кристаллогр . 21 (3): 273–288. DOI : 10.1107 / s0021889887012299 .
- ^ Спектроскопия ЯМР
- ^ Gueron, М., JL Leroy. 1995. Исследования кинетики пар оснований с помощью ЯМР-измерения протонного обмена. В ядерном магнитном резонансе и нуклеиновых кислотах. Academic Press, Сан-Диего, Калифорния.
- ^ Leijon, M .; Граслунд, А. (1992). «Влияние последовательности и длины на кинетику имино-протонного обмена и раскрытия пары оснований в дуплексах ДНК-олигонуклеотидов» . Nucleic Acids Res . 20 (20): 5339–5343. DOI : 10.1093 / NAR / 20.20.5339 . PMC 334339 . PMID 1331987 .
- ^ Klimasaukas, Салюс, и Зита Liutkeviciute. «Экспериментальные подходы к изучению смещения оснований ДНК». Ферменты модификации ДНК и РНК: структура, механизм, функция и эволюция. Landes Bioscience, 2009. 37-50. Интернет. 16 марта 2014 г. < https://www.landesbioscience.com/pdf/04GrosjeanKlimasauskas.pdf Архивировано 7 апреля 2014 г. на Wayback Machine >.
- ^ Грожан, [отредактированный] Анри (2009). Ферменты модификации ДНК и РНК: структура, механизм, функции и эволюция (PDF) . Остин, Техас: Landes Bioscience. п. 43. ISBN 978-1-58706-329-9.CS1 maint: дополнительный текст: список авторов ( ссылка )
- ↑ Holz, B (15 февраля 1998 г.). «2-Аминопурин в качестве флуоресцентного зонда для переворота оснований ДНК метилтрансферазами» . Исследования нуклеиновых кислот . 26 (4): 1076–1083. DOI : 10.1093 / NAR / 26.4.1076 . PMC 147370 . PMID 9461471 .
- ^ Ян, К; Мацика, С; Стэнли, RJ (6 сентября 2007 г.). «6MAP, флуоресцентный аналог аденина, представляет собой пробу переворота оснований ДНК-фотолиазой». Журнал физической химии B . 111 (35): 10615–25. DOI : 10.1021 / jp071035p . PMID 17696385 . S2CID 4998287 .
- ^ Ян, К; Стэнли, Р. Дж. (Май – июнь 2008 г.). «Степень деформации ДНК в комплексах ДНК-фотолиаза-субстрат: исследование флуоресценции состояния раствора». Фотохимия и фотобиология . 84 (3): 741–9. DOI : 10.1111 / j.1751-1097.2007.00251.x . PMID 18086248 .
- ^ Берри, Дэвид А .; Юнг, Ки-Йонг; Мудрый, Дин С .; Sercel, Anthony D .; Пирсон, Уильям Х .; Маки, Хью; Рэндольф, Джон Б.; Сомерс, Роберт Л. (март 2004 г.). «Пирроло-dC и пирроло-C: флуоресцентные аналоги цитидина и 2'-дезоксицитидина для исследования олигонуклеотидов». Буквы тетраэдра . 45 (11): 2457–2461. DOI : 10.1016 / j.tetlet.2004.01.108 .
- ^ Нили, РК; Tamulaitis, G .; Chen, K .; Кубала, М .; Сиксныс, В .; Джонс, AC (8 сентября 2009 г.). «Флуоресцентные исследования с временным разрешением переворота нуклеотидов рестрикционными ферментами» . Исследования нуклеиновых кислот . 37 (20): 6859–6870. DOI : 10.1093 / NAR / gkp688 . PMC 2777440 . PMID 19740769 .
- ^ Serva, S (1 августа 1998). «Химическое отображение остатков тимина, нарушенных ДНК-метилтрансферазами» . Исследования нуклеиновых кислот . 26 (15): 3473–3479. DOI : 10.1093 / NAR / 26.15.3473 . PMC 147733 . PMID 9671807 .
- ^ Daujotyte, D .; Liutkeviciute, Z .; Tamulaitis, G .; Климасаускас, С. (15 апреля 2008 г.). «Химическое картирование цитозинов, ферментативно вывернутых из спирали ДНК» . Исследования нуклеиновых кислот . 36 (10): e57. DOI : 10.1093 / NAR / gkn200 . PMC 2425465 . PMID 18450817 .