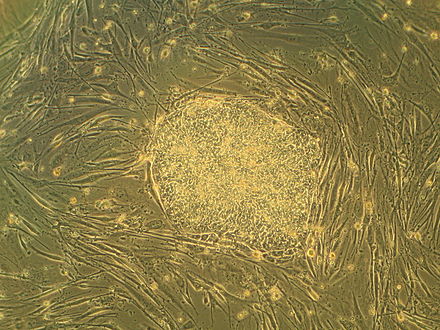
Эмбриональные стволовые клетки ( ES клетки или ЭСК ) являются плюрипотентные стволовые клетки , полученные из внутренней клеточной массы в виде бластоцисты , на ранней стадии предварительной имплантации эмбриона . [1] [2] Человеческие эмбрионы достигают стадии бластоцисты через 4–5 дней после оплодотворения , когда они состоят из 50–150 клеток. Изоляция эмбриобласта или внутренней клеточной массы (ICM) приводит к разрушению бластоцисты, что вызывает этические проблемы., включая вопрос о том, имеют ли эмбрионы на стадии до имплантации те же моральные соображения, что и эмбрионы на стадии развития после имплантации. [3] [4]
В настоящее время исследователи уделяют большое внимание терапевтическому потенциалу эмбриональных стволовых клеток, и их клиническое использование является целью многих лабораторий. [5] Возможное использование включает лечение диабета и сердечных заболеваний . [5] Клетки изучаются для использования в качестве клинических методов лечения, моделирования генетических нарушений и восстановления клеток / ДНК. Однако также сообщалось о побочных эффектах в исследованиях и клинических процессах, таких как опухоли и нежелательные иммунные реакции . [6]
Свойства [ править ]
Эмбриональные стволовые клетки (ЭСК), происходящие из стадии бластоцисты ранних эмбрионов млекопитающих, отличаются своей способностью дифференцироваться в любой тип эмбриональных клеток и своей способностью к самообновлению. Именно эти качества делают их ценными в научной и медицинской областях. ESC имеют нормальный кариотип , поддерживают высокую активность теломеразы и обладают замечательным долгосрочным пролиферативным потенциалом. [7]
Плюрипотент [ править ]
Эмбриональные стволовые клетки внутренней клеточной массы являются плюрипотентными , что означает, что они способны дифференцироваться с образованием примитивной эктодермы, которая в конечном итоге дифференцируется во время гаструляции на все производные трех первичных зародышевых листков : эктодермы , энтодермы и мезодермы . Эти зародышевые листки генерируют каждый из более чем 220 типов клеток в организме взрослого человека. При наличии соответствующих сигналов ESC первоначально образуют клетки-предшественники, которые впоследствии дифференцируются в желаемые типы клеток. Плюрипотентность отличает эмбриональные стволовые клетки от взрослых стволовых клеток , которыемультипотентны и могут производить только ограниченное количество типов клеток.
Самостоятельное обновление и ремонт конструкции [ править ]
В определенных условиях эмбриональные стволовые клетки способны бесконечно самообновляться в недифференцированном состоянии. Условия самообновления должны предотвращать слипание клеток и поддерживать среду, которая поддерживает неспециализированное состояние. [8] Обычно это делается в лаборатории с использованием сред, содержащих сыворотку и фактор ингибирования лейкемии, или бессывороточных сред с двумя ингибиторами («2i»), ингибитором MEK PD03259010 и ингибитором GSK-3 CHIR99021. [9]
Рост [ править ]
ЭСК делятся очень часто из-за укороченной фазы G1 в их клеточном цикле . Быстрое деление клеток позволяет клеткам быстро расти в количестве, но не в размере, что важно для раннего развития эмбриона. В ESCs белки cyclin A и cyclin E, участвующие в переходе G1 / S , всегда экспрессируются на высоких уровнях. [10] Циклинзависимые киназы, такие как CDK2, которые способствуют развитию клеточного цикла, обладают повышенной активностью, отчасти из-за подавления их ингибиторов. [11] Белки ретинобластомы, которые ингибируют фактор транскрипции E2F, пока клетка не будет готова к входу.S-фаза гиперфосфорилируется и инактивируется в ESC, что приводит к постоянной экспрессии генов пролиферации. [10] Эти изменения приводят к ускорению циклов деления клеток. Хотя укороченная фаза G1 связана с поддержанием плюрипотентности, [12] ESCs, выращенные в бессывороточных условиях 2i, действительно экспрессируют гипофосфорилированные активные белки ретинобластомы и имеют удлиненную фазу G1. [13] Несмотря на это различие в клеточном цикле по сравнению с ESC, выращенными в среде, содержащей сыворотку, эти клетки обладают схожими плюрипотентными характеристиками. [14] Факторы плюрипотентности Oct4 и Nanog играют роль в транскрипционной регуляции клеточного цикла ESC. [15][16]
Использует [ редактировать ]
Из-за их пластичности и потенциально неограниченной способности к самообновлению методы лечения эмбриональными стволовыми клетками были предложены для регенеративной медицины и замены тканей после травм или болезней. Плюрипотентные стволовые клетки показали себя многообещающими при лечении ряда различных состояний, включая, помимо прочего, травмы спинного мозга , возрастную дегенерацию желтого пятна , диабет , нейродегенеративные расстройства (такие как болезнь Паркинсона ), СПИД и т. Д. [17]В дополнение к своему потенциалу в регенеративной медицине эмбриональные стволовые клетки представляют собой возможный альтернативный источник тканей / органов, который служит возможным решением дилеммы нехватки доноров. Однако вокруг этого есть некоторые этические противоречия (см. Раздел « Этические дебаты » ниже). Помимо этих применений, ESC также можно использовать для исследований в области раннего развития человека, определенных генетических заболеваний и токсикологического тестирования in vitro . [7]
Утилизации [ править ]
Согласно статье 2002 года в PNAS , «человеческие эмбриональные стволовые клетки обладают потенциалом дифференцироваться в различные типы клеток и, таким образом, могут быть полезны в качестве источника клеток для трансплантации или тканевой инженерии». [18]
Тканевая инженерия [ править ]
В тканевой инженерии недавно было обнаружено использование стволовых клеток, которые, как известно, имеют большое значение. Чтобы успешно сконструировать ткань, используемые клетки должны быть способны выполнять определенные биологические функции, такие как секреция цитокинов, сигнальные молекулы, взаимодействие с соседними клетками и производство внеклеточного матрикса в правильной организации. Стволовые клетки демонстрируют эти специфические биологические функции, а также способность самообновляться и дифференцироваться в один или несколько типов специализированных клеток. Эмбриональные стволовые клетки - один из текущих источников, которые рассматриваются для использования в тканевой инженерии. [19] Использование человеческих эмбриональных стволовых клеток открыло много новых возможностей для тканевой инженерии, однако существует множество препятствий, которые необходимо преодолеть, прежде чем человеческие эмбриональные стволовые клетки можно будет использовать. Предполагается, что если эмбриональные стволовые клетки можно изменить так, чтобы они не вызывали иммунный ответ при имплантации пациенту, это стало бы революционным шагом в тканевой инженерии. [20]
Однако эмбриональные стволовые клетки не ограничиваются клеточной / тканевой инженерией.
Терапия замещения клеток [ править ]
Текущие исследования сосредоточены на дифференцировке ESC в различные типы клеток для последующего использования в качестве терапии замещения клеток (CRT). Некоторые из типов клеток, которые уже существуют или разрабатываются в настоящее время, включают кардиомиоциты (CM), нейроны , гепатоциты , клетки костного мозга , островковые клетки и эндотелиальные клетки. [21] Однако получение таких типов клеток из ESC не обходится без препятствий, поэтому текущие исследования сосредоточены на преодолении этих барьеров. Например, в настоящее время проводятся исследования по дифференциации ESC в тканеспецифичные CM и по искоренению их незрелых свойств, которые отличают их от взрослых CM. [22]
Клинический потенциал [ править ]
- Исследователи дифференцировали ESC в клетки, продуцирующие дофамин, в надежде, что эти нейроны могут быть использованы в лечении болезни Паркинсона. [23] [24]
- ESC были дифференцированы в естественные клетки-киллеры (NK) и костную ткань. [25]
- В настоящее время проводятся исследования с участием ЭСК, чтобы предложить альтернативное лечение диабета. Например, D'Amour et al. смогли дифференцировать ESC в клетки, продуцирующие инсулин [26], а исследователи из Гарвардского университета смогли продуцировать большие количества бета-клеток поджелудочной железы из ES. [27]
- В статье, опубликованной в European Heart Journal, описан трансляционный процесс создания сердечных клеток-предшественников, полученных из человеческих эмбриональных стволовых клеток, которые будут использоваться в клинических испытаниях пациентов с тяжелой сердечной недостаточностью. [28]
Открытие лекарств [ править ]
Помимо того, что они стали важной альтернативой трансплантации органов, ESC также используются в области токсикологии и в качестве клеточного скрининга для выявления новых химических соединений (NCE), которые могут быть разработаны как низкомолекулярные препараты. Исследования показали, что кардиомиоциты, полученные из ESC, проверены на моделях in vitro для тестирования лекарственного ответа и прогнозирования профилей токсичности. [21] Было показано, что кардиомиоциты, полученные из ES, реагируют на фармакологические стимулы и, следовательно, могут использоваться для оценки кардиотоксичности, как Torsades de Pointes . [29]
Гепатоциты, полученные из ESC, также являются полезными моделями, которые можно использовать на доклинических стадиях открытия лекарств. Однако оказалось, что развитие гепатоцитов из ESC затруднено, и это препятствует возможности тестирования метаболизма лекарств. Таким образом, текущие исследования сосредоточены на создании полностью функциональных гепатоцитов, полученных из ЭСК, со стабильной ферментативной активностью фазы I и II. [30]
Модели генетического расстройства [ править ]
Несколько новых исследований начали рассматривать концепцию моделирования генетических нарушений с помощью эмбриональных стволовых клеток. Либо путем генетических манипуляций с клетками, либо, в последнее время, путем получения линий пораженных клеток, идентифицированных с помощью пренатальной генетической диагностики (ПГД), моделирование генетических нарушений - это то, что было достигнуто с помощью стволовых клеток. Такой подход вполне может оказаться полезными при изучении расстройств , таких как синдром ломкой Х , кистозного фиброза и других генетических заболеваний , которые не имеют надежной модели системы.
Юрий Верлинский , российско-американский медицинский исследователь , специализирующийся на эмбриональной и клеточной генетике (генетической цитологии ), разработал методы пренатальной диагностики для определения генетических и хромосомных нарушений на полтора месяца раньше, чем стандартный амниоцентез.. В настоящее время эти методы используются многими беременными женщинами и потенциальными родителями, особенно парами, у которых в анамнезе есть генетические аномалии или женщины старше 35 лет (когда риск генетически связанных заболеваний выше). Кроме того, позволяя родителям выбирать эмбрион без генетических нарушений, они могут спасти жизни братьев и сестер, у которых уже были подобные нарушения и заболевания, с использованием клеток потомства, свободного от болезней. [31]
Ремонт повреждений ДНК [ править ]
Дифференцированные соматические клетки и ES-клетки используют разные стратегии для борьбы с повреждениями ДНК. Например, фибробласты крайней плоти человека, один из типов соматических клеток, используют негомологичное соединение концов (NHEJ) , процесс репарации ДНК, подверженный ошибкам, в качестве основного пути восстановления двухцепочечных разрывов (DSB) на всех стадиях клеточного цикла. [32] Из-за своей склонности к ошибкам NHEJ имеет тенденцию вызывать мутации в клональных потомках клетки.
ES-клетки используют другую стратегию для работы с DSB. [33] Поскольку ES-клетки дают начало всем типам клеток организма, включая клетки зародышевой линии, мутации, возникающие в ES-клетках из-за неправильной репарации ДНК, представляют собой более серьезную проблему, чем в дифференцированных соматических клетках. Следовательно, в ES-клетках необходимы надежные механизмы для точного восстановления повреждений ДНК и, если восстановление не удается, для удаления этих клеток с не восстановленными повреждениями ДНК. Таким образом, мышиные ES-клетки преимущественно используют гомологичную рекомбинационную репарацию с высокой точностью (HRR) для репарации DSB. [33] Этот тип восстановления зависит от взаимодействия двух сестринских хромосом [ необходима проверка ]образуются во время фазы S и присутствуют вместе во время фазы G2 клеточного цикла. HRR может точно восстанавливать DSB в одной сестринской хромосоме, используя неизменную информацию из другой сестринской хромосомы. Клетки в фазе G1 клеточного цикла (то есть после метафазы / деления клетки, но до следующего раунда репликации) имеют только одну копию каждой хромосомы (то есть сестринские хромосомы отсутствуют). ES-клетки мыши не имеют контрольной точки G1 и не подвергаются остановке клеточного цикла при повреждении ДНК. [34] Скорее они подвергаются запрограммированной гибели клеток (апоптозу) в ответ на повреждение ДНК. [35] Апоптоз можно использовать как безотказную стратегию для удаления клеток с не восстановленными повреждениями ДНК, чтобы избежать мутации и развития рака. [36] В соответствии с этой стратегией, ES стволовые клетки мыши имеют частоту мутаций примерно в 100 раз ниже, чем изогенные соматические клетки мыши. [37]
Клиническое испытание [ править ]
23 января 2009 г. клинические испытания фазы I по трансплантации олигодендроцитов (тип клеток головного и спинного мозга), полученных из ES-клеток человека, людям с травмой спинного мозга получили одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). это первое в мире испытание ES-клеток на людях. [38] Исследование, приведшее к этому научному прогрессу, было проведено Хансом Кейрстедом и его коллегами из Калифорнийского университета в Ирвине при поддержке корпорации Geron из Менло-Парк, Калифорния , основанной Майклом Д. Уэстом., Кандидат наук. Предыдущий эксперимент показал улучшение локомоторного восстановления у крыс с повреждением спинного мозга после 7-дневной отсроченной трансплантации человеческих ES-клеток, которые были перенесены в олигодендроцитарный клон. [39]Клиническое исследование фазы I было разработано для включения от восьми до десяти людей, страдающих параличом нижних конечностей, у которых были травмы не ранее, чем за две недели до начала исследования, поскольку клетки должны быть введены до того, как рубцовая ткань сможет сформироваться. Исследователи подчеркнули, что инъекции не должны были полностью вылечить пациентов и восстановить их подвижность. Основываясь на результатах испытаний на грызунах, исследователи предположили, что может произойти восстановление миелиновых оболочек и увеличение подвижности. Это первое испытание было в первую очередь предназначено для проверки безопасности этих процедур, и если все пойдет хорошо, есть надежда, что это приведет к будущим исследованиям с участием людей с более тяжелыми формами инвалидности. [40]Испытание было приостановлено в августе 2009 г. из-за опасений FDA относительно небольшого количества микроскопических кист, обнаруженных на нескольких моделях обработанных крыс, но 30 июля 2010 г. приостановка была снята. [41]
В октябре 2010 года исследователи зарегистрировали и назначили EST первому пациенту в Shepherd Center в Атланте . [42] Создатели терапии стволовыми клетками, Geron Corporation , подсчитали, что для репликации стволовых клеток и оценки эффективности или неудачи терапии GRNOPC1 потребуется несколько месяцев .
В ноябре 2011 года Geron объявил, что прекращает исследование и прекращает исследования стволовых клеток по финансовым причинам, но продолжит наблюдение за существующими пациентами и пытается найти партнера, который мог бы продолжить их исследования. [43] В 2013 году компания BioTime , возглавляемая генеральным директором доктором Майклом Д. Вестом , приобрела все активы Geron по стволовым клеткам с заявленным намерением возобновить клинические испытания Geron на основе эмбриональных стволовых клеток для исследования повреждений спинного мозга . [44]
Компания BioTime Asterias Biotherapeutics (NYSE MKT: AST) получила награду за стратегическое партнерство в размере 14,3 миллиона долларов от Калифорнийского института регенеративной медицины (CIRM) за возобновление первого в мире клинического испытания на людях с использованием эмбриональных стволовых клеток при повреждении спинного мозга. CIRM, поддерживаемый государственными фондами Калифорнии, является крупнейшим в мире спонсором исследований и разработок стволовых клеток. [45]
Премия обеспечивает финансирование Asterias для возобновления клинической разработки AST-OPC1 у субъектов с травмой спинного мозга и для расширения клинических испытаний возрастающих доз в целевой популяции, предназначенных для будущих ключевых испытаний. [45]
AST-OPC1 - это популяция клеток, полученных из эмбриональных стволовых клеток человека (hESC), которые содержат клетки-предшественники олигодендроцитов (OPC). OPC и их зрелые производные, называемые олигодендроцитами, обеспечивают важную функциональную поддержку нервных клеток в спинном и головном мозге. Астериас недавно представил результаты фазы 1 клинического испытания низкой дозы AST-OPC1 у пациентов с неврологически полным повреждением грудного отдела спинного мозга. Результаты показали, что AST-OPC1 был успешно доставлен в поврежденный участок спинного мозга. Пациенты наблюдались через 2–3 года после введения AST-OPC1, при детальных последующих оценках, включая частые неврологические осмотры и МРТ, не выявили серьезных побочных эффектов, связанных с клетками.Иммунный мониторинг субъектов в течение одного года после трансплантации не показал никаких доказательств наличия антител или клеточного иммунного ответа на AST-OPC1. У четырех из пяти пациентов последовательные МРТ, выполненные в течение 2–3-летнего периода наблюдения, показали, что могло иметь место уменьшение кавитации спинного мозга и что AST-OPC1 мог иметь некоторые положительные эффекты в снижении разрушения ткани спинного мозга. По оценке Международных стандартов неврологической классификации травм спинного мозга (ISNCSCI), неожиданной неврологической дегенерации или улучшения у пяти испытуемых не было.последовательные МРТ, выполненные в течение 2–3-летнего периода наблюдения, показывают, что могло иметь место уменьшение кавитации спинного мозга и что AST-OPC1 мог иметь некоторые положительные эффекты в снижении разрушения ткани спинного мозга. По оценке Международных стандартов неврологической классификации травм спинного мозга (ISNCSCI), неожиданной неврологической дегенерации или улучшения у пяти испытуемых не было.последовательные МРТ, выполненные в течение 2–3-летнего периода наблюдения, показывают, что могло иметь место уменьшение кавитации спинного мозга и что AST-OPC1 мог иметь некоторые положительные эффекты в снижении разрушения ткани спинного мозга. По оценке Международных стандартов неврологической классификации травм спинного мозга (ISNCSCI), неожиданной неврологической дегенерации или улучшения у пяти испытуемых не было.[45]
Грант Стратегического партнерства III от CIRM предоставит Asterias финансирование для поддержки следующего клинического испытания AST-OPC1 на субъектах с травмой спинного мозга, а также для усилий Asterias по разработке продуктов по совершенствованию и масштабированию производственных методов для поддержки более поздних стадий испытаний и, в конечном итоге, коммерциализация. Финансирование CIRM будет зависеть от одобрения FDA для испытания, завершения окончательного соглашения между Asterias и CIRM и дальнейшего прогресса Asterias в достижении определенных заранее определенных этапов проекта. [45]
Обеспокоенность и разногласия [ править ]
Побочные эффекты [ править ]
Основная проблема с возможной трансплантацией ESC пациентам в качестве лечения - это их способность образовывать опухоли, включая тератому. [46] Проблемы безопасности побудили FDA приостановить первое клиническое испытание ESC, однако опухолей не наблюдалось.
Основная стратегия повышения безопасности ESC для потенциального клинического использования - дифференцировать ESC на определенные типы клеток (например, нейроны, мышцы, клетки печени), у которых снижена или устранена способность вызывать опухоли. После дифференцировки клетки подвергают сортировке с помощью проточной цитометрии для дальнейшей очистки. Предполагается, что ESC по своей природе безопаснее, чем клетки IPS, созданные с помощью генетически интегрируемых вирусных векторов, потому что они не генетически модифицированы такими генами, как c-Myc, которые связаны с раком. Тем не менее, ESC экспрессируют очень высокие уровни генов, индуцирующих iPS, и эти гены, включая Myc, необходимы для самообновления и плюрипотентности ESC [47].и потенциальные стратегии повышения безопасности за счет устранения экспрессии c-Myc вряд ли сохранят «стволовость» клеток. Однако было установлено, что N-myc и L-myc индуцируют iPS-клетки вместо c-myc с аналогичной эффективностью. [48] Более современные протоколы для индукции плюрипотентности полностью обходят эти проблемы за счет использования неинтегрирующих вирусных векторов РНК, таких как вирус Сендаи, или трансфекции мРНК .
Этические дебаты [ править ]
Из-за характера исследований эмбриональных стволовых клеток существует множество противоречивых мнений по этой теме. Поскольку сбор эмбриональных стволовых клеток требует уничтожения эмбриона, из которого эти клетки были получены, моральный статус эмбриона ставится под сомнение. Некоторые люди утверждают, что 5-дневная масса клеток слишком молода для достижения индивидуальности или что эмбрион, если его пожертвовать из клиники ЭКО (где лаборатории обычно получают эмбрионы), в противном случае все равно попал бы в медицинские отходы. Противники исследования ESC утверждают, что эмбрион - это человеческая жизнь, поэтому его уничтожение - убийство, и эмбрион должен быть защищен с соблюдением тех же этических принципов, что и более развитый человек. [49]
История [ править ]
- 1964: Льюис Кляйнсмит и Дж. Барри Пирс-младший выделили единственный тип клетки из тератокарциномы , опухоли, которая теперь известна из зародышевой клетки . [50] Эти клетки были выделены из тератокарциномы, реплицированной и выросшей в клеточной культуре как стволовые клетки, и теперь они известны как клетки эмбриональной карциномы (ЭК). [ необходима цитата ] Хотя сходство в морфологии и дифференцирующем потенциале ( плюрипотентность ) привело к использованию ЭК-клеток в качестве модели in vitro для раннего развития мышей, [51] ЭК-клетки несут генетические мутации и часто аномальные кариотипыкоторые накопились во время развития тератокарциномы . Эти генетические аберрации дополнительно подчеркивают необходимость культивирования плюрипотентных клеток непосредственно из внутренней клеточной массы .
- 1981: Эмбриональные стволовые клетки (ES-клетки) были впервые независимо получены из эмбрионов мыши двумя группами. Мартин Эванс и Мэтью Кауфман из Департамента генетики Кембриджского университета впервые опубликовали в июле, раскрывая новую технику культивирования мышиных эмбрионов в матке, позволяющую увеличить количество клеток, что позволяет получить ES-клетки из этих эмбрионов. . [52] Гейл Р. Мартин с кафедры анатомии Калифорнийского университета в Сан-Франциско опубликовала свою статью в декабре и ввела термин «эмбриональная стволовая клетка». [53] Она показала, что эмбрионы можно культивировать in vitro. и что ES-клетки могут происходить из этих эмбрионов.
- 1989: Марио Р. Каппечи, Мартин Дж. Эванс и Оливер Смитис публикуют свои исследования, в которых подробно описывается их выделение и генетические модификации эмбриональных стволовых клеток, в результате чего создаются первые « нокаутные мыши ». [54] При создании мышей с нокаутом эта публикация предоставила ученым совершенно новый способ изучения болезней.
- 1998: команда из Университета Висконсина в Мэдисоне (Джеймс А. Томсон, Джозеф Ицковиц-Элдор, Сандер С. Шапиро, Мишель А. Вакниц, Дженнифер Дж. Свирджил, Вивьен С. Маршалл и Джеффри М. Джонс) публикуют документ под названием «Линии эмбриональных стволовых клеток, полученные из бластоцист человека». Исследователи, стоящие за этим исследованием, не только создали первые эмбриональные стволовые клетки, но и признали их плюрипотентность, а также их способность к самообновлению. В аннотации к статье отмечается важность открытия в области биологии развития и открытия лекарств. [55]
- 2001: Президент Джордж Буш разрешает федеральное финансирование для поддержки исследований примерно 60 - в настоящее время уже существующих - линий эмбриональных стволовых клеток. Поскольку ограниченное количество линий, разрешенных Бушем для исследований, уже установлено, этот закон поддерживает исследования эмбриональных стволовых клеток, не поднимая никаких этических вопросов, которые могут возникнуть при создании новых линий в рамках федерального бюджета. [56]
- 2006: Японские ученые Синья Яманака и Кадзутоши Такаши публикуют статью, в которой описывается индукция плюрипотентных стволовых клеток из культур фибробластов взрослых мышей . Индуцированные плюрипотентные стволовые клетки (ИПСК) - это огромное открытие, поскольку они кажутся идентичными эмбриональным стволовым клеткам и могут использоваться, не вызывая таких же моральных споров. [57]
- Январь 2009 г .: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобряет фазу I исследования Geron Corporation лечения травм спинного мозга на основе эмбриональных стволовых клеток человека . Это объявление было встречено с энтузиазмом в научном сообществе, но также с осторожностью со стороны противников стволовых клеток. Однако лечебные клетки были получены из клеточных линий, утвержденных в соответствии с политикой ESC Джорджа Буша . [58]
- Март 2009 г .: Президентом Бараком Обамой подписан Указ № 13505, отменяющий ограничения, введенные предыдущей президентской администрацией на федеральное финансирование стволовых клеток человека. Это позволит Национальным институтам здравоохранения (NIH) предоставить финансирование для исследований в области hESC. В документе также говорится, что NIH должен предоставить пересмотренные руководящие принципы федерального финансирования в течение 120 дней с момента подписания приказа. [59]
Методы и условия происхождения и культуры [ править ]
Происхождение от людей [ править ]
В результате экстракорпорального оплодотворения образуется несколько эмбрионов. Излишки эмбрионов не используются в клинических условиях или не подходят для имплантации пациенту и поэтому могут быть переданы донором с согласия. Эмбриональные стволовые клетки человека могут быть получены из этих пожертвованных эмбрионов или, кроме того, они также могут быть извлечены из клонированных эмбрионов с использованием клетки пациента и донорской яйцеклетки. [60]Внутренняя клеточная масса (представляющие интерес клетки) на стадии бластоцисты эмбриона отделяется от трофэктодермы, клеток, которые могут дифференцироваться во внеэмбриональную ткань. Иммунохирургия, процесс, при котором антитела связываются с трофэктодермой и удаляются другим раствором, и механическое рассечение выполняется для достижения разделения. Полученные клетки внутренней клеточной массы помещают на клетки, которые будут обеспечивать поддержку. Клетки внутренней клеточной массы прикрепляются и расширяются дальше, образуя линию эмбриональных клеток человека, которые не дифференцируются. Эти клетки питаются ежедневно и разделяются ферментативно или механически каждые четыре-семь дней. Для того чтобы дифференцировка произошла, линия эмбриональных стволовых клеток человека удаляется из поддерживающих клеток с образованием эмбриоидных тел, культивируется совместно с сывороткой, содержащей необходимые сигналы,или прививается в трехмерный каркас.[61]
Происхождение от других животных [ править ]
Эмбриональные стволовые клетки получают из внутренней клеточной массы раннего эмбриона , полученного от материнского животного-донора. Мартин Эванс и Мэтью Кауфман сообщили о технике, которая задерживает имплантацию эмбриона, позволяя увеличивать внутреннюю клеточную массу. Этот процесс включает удаление яичников матери-донора и введение ей прогестерона , изменение гормональной среды, в результате чего эмбрионы остаются свободными в матке. Через 4–6 дней внутриутробного культивирования эмбрионы собирают и выращивают в культуре in vitro до тех пор, пока внутренняя клеточная масса не образует «цилиндрические структуры яйца», которые диссоциируют на отдельные клетки и высевают на них.фибробласты, обработанные митомицином-с (для предотвращения митоза фибробластов ). Клональные клеточные линии создаются путем выращивания одной клетки. Эванс и Кауфман показали, что клетки, выросшие из этих культур, могут образовывать тератомы и эмбриоидные тельца и дифференцироваться in vitro, что указывает на плюрипотентность клеток . [52]
Гейл Мартин извлекала и культивировала свои ES-клетки по-разному. Она удалила эмбрионы у матери-донора примерно через 76 часов после совокупления и культивировала их в течение ночи в среде, содержащей сыворотку. На следующий день она удалила внутреннюю клеточную массу из поздней бластоцисты с помощью микрохирургии . Экстрагированную внутреннюю клеточную массу культивировали на фибробластах, обработанных митомицином-c в среде, содержащей сыворотку и кондиционированной ES-клетками. Примерно через неделю выросли колонии клеток. Эти клетки росли в культуре и демонстрировали плюрипотентные характеристики, о чем свидетельствует способность образовывать тератомы., дифференцируются in vitro и образуют эмбриоидные тельца . Мартин называл эти клетки ES-клетками. [53]
Теперь известно, что питающие клетки обеспечивают фактор ингибирования лейкемии (LIF), а сыворотка обеспечивает костные морфогенетические белки (BMP), которые необходимы для предотвращения дифференцировки ES-клеток. [62] [63] Эти факторы чрезвычайно важны для эффективности получения ES-клеток. Кроме того, было продемонстрировано, что разные линии мышей имеют разную эффективность для выделения ES-клеток. [64] Текущее использование мышиных ES-клеток включает создание трансгенных мышей, в том числе мышей с нокаутом.. Для лечения человека необходимы плюрипотентные клетки, специфичные для пациента. Генерация человеческих ES-клеток сложнее и сталкивается с этическими проблемами. Таким образом, в дополнение к исследованиям человеческих ES-клеток, многие группы сосредоточены на создании индуцированных плюрипотентных стволовых клеток (iPS-клеток). [65]
Возможные методы получения новых линий клеток [ править ]
23 августа 2006 г. в интернет-издании научного журнала Nature было опубликовано письмо доктора Роберта Ланца (медицинского директора Advanced Cell Technology в Вустере, Массачусетс), в котором говорилось, что его команда нашла способ извлекать эмбриональные стволовые клетки без разрушения реальных эмбрион. [66] Это техническое достижение потенциально позволит ученым работать с новыми линиями эмбриональных стволовых клеток, полученными с использованием государственного финансирования в США, где федеральное финансирование в то время ограничивалось исследованиями с использованием линий эмбриональных стволовых клеток, полученных до августа 2001 г. В марте , 2009 г. ограничение снято. [67]
Эмбриональные стволовые клетки человека также были получены путем переноса ядра соматических клеток (SCNT) . [68] [69] Этот подход также иногда называют «терапевтическим клонированием», потому что SCNT имеет сходство с другими видами клонирования в том, что ядра переносятся из соматической клетки в энуклеированную зиготу. Однако в этом случае SCNT использовался для производства линий эмбриональных стволовых клеток в лаборатории, а не живых организмов во время беременности. «Терапевтическая» часть названия включена из-за надежды на то, что эмбриональные стволовые клетки, продуцируемые SCNT, могут иметь клиническое применение.
Индуцированные плюрипотентные стволовые клетки [ править ]
Технология iPSC была впервые разработана лабораторией Шинья Яманака в Киото , Япония , которая в 2006 году показала, что введение четырех специфических генов, кодирующих факторы транскрипции, может преобразовывать взрослые клетки в плюрипотентные стволовые клетки. [70] Он был награжден Нобелевской премией 2012 года вместе с сэром Джоном Гардоном «за открытие того, что зрелые клетки могут быть перепрограммированы, чтобы стать плюрипотентными». [71]
В 2007 году было показано, что плюрипотентные стволовые клетки, очень похожие на эмбриональные стволовые клетки, могут быть получены путем доставки трех генов ( Oct4 , Sox2 и Klf4 ) к дифференцированным клеткам. [72]Доставка этих генов «перепрограммирует» дифференцированные клетки в плюрипотентные стволовые клетки, позволяя генерировать плюрипотентные стволовые клетки без эмбриона. Поскольку этические проблемы в отношении эмбриональных стволовых клеток обычно связаны с их происхождением из терминированных эмбрионов, считается, что перепрограммирование на эти «индуцированные плюрипотентные стволовые клетки» (iPS-клетки) может быть менее спорным. С помощью этой методологии можно перепрограммировать как человеческие, так и мышиные клетки, создавая как плюрипотентные стволовые клетки человека, так и плюрипотентные стволовые клетки мыши без эмбриона. [73]
Это может позволить создание специфичных для пациента линий ES-клеток, которые потенциально могут быть использованы для терапии замещения клеток. Кроме того, это позволит генерировать линии ES-клеток от пациентов с различными генетическими заболеваниями и предоставит бесценные модели для изучения этих заболеваний.
Однако, как первый признак того, что индуцированные плюрипотентные стволовые клетки технологии (плюрипотентных) клеток может в быстрой последовательности приводят к новым лечений, она была использована группа исследователей во главе с Рудольфом Йениш из Уайтхед Института медико - биологических исследований в Кембридже , штат Массачусетс , в вылечить у мышей серповидно-клеточную анемию , как сообщалось в интернет-издании журнала Science от 6 декабря 2007 г. [74] [75]
16 января 2008 года калифорнийская компания Stemagen объявила, что они создали первые зрелые клонированные человеческие эмбрионы из отдельных клеток кожи, взятых у взрослых. Эти эмбрионы могут быть получены для сопоставления с пациентами эмбриональных стволовых клеток. [76]
Загрязнение реагентами, используемыми в культуре клеток [ править ]
Интернет-издание Nature Medicine опубликовало 24 января 2005 года исследование, в котором говорилось, что человеческие эмбриональные стволовые клетки, доступные для исследований, финансируемых из федерального бюджета, загрязнены нечеловеческими молекулами из культуральной среды, используемой для выращивания клеток. [77] Это распространенный метод использования клеток мыши и других клеток животных для поддержания плюрипотентности активно делящихся стволовых клеток. Проблема была обнаружена, когда было обнаружено, что нечеловеческая сиаловая кислота в питательной среде ставит под угрозу потенциальное использование эмбриональных стволовых клеток у людей, по словам ученых из Калифорнийского университета в Сан-Диего . [78]
Тем не менее, исследование, опубликованное в онлайн-выпуске Lancet Medical Journal 8 марта 2005 г., содержит подробную информацию о новой линии стволовых клеток, полученной из человеческих эмбрионов в полностью бессывороточных условиях. После более чем 6 месяцев недифференцированной пролиферации эти клетки продемонстрировали способность образовывать производные всех трех зародышевых листков эмбриона как in vitro, так и в тератомах . Эти свойства также успешно поддерживались (более 30 пассажей) с помощью установленных линий стволовых клеток. [79]
См. Также [ править ]
- Эмбриоидное тело
- Комитеты по надзору за исследованиями эмбриональных стволовых клеток
- Имплантат ткани плода
- Индуцированные стволовые клетки
- Споры о стволовых клетках
Ссылки [ править ]
- ^ Томсон; Ицковиц-Эльдор, Дж; Шапиро, СС; Вакниц, Массачусетс; Swiergiel, JJ; Маршалл, VS; Джонс, JM (1998). «Линии эмбриональных стволовых клеток бластоцисты, полученные от человека» . Наука . 282 (5391): 1145–1147. Bibcode : 1998Sci ... 282.1145T . DOI : 10.1126 / science.282.5391.1145 . PMID 9804556 .
- ^ "Основы стволовых клеток NIH. Что такое эмбриональные стволовые клетки?" . Архивировано из оригинала на 2016-08-31 . Проверено 25 марта 2014 .
- ^ Baldwing A (2009). «Мораль и исследования человеческого эмбриона. Введение в тему для обсуждения морали и исследования человеческого эмбриона» . EMBO Reports . 10 (4): 299–300. DOI : 10.1038 / embor.2009.37 . PMC 2672902 . PMID 19337297 .
- ^ Nakaya, Andrea C. (1 августа 2011). Биомедицинская этика . Сан-Диего, Калифорния: ReferencePoint Press. С. 96 . ISBN 978-1601521576.
- ^ a b «Введение: что такое стволовые клетки и почему они так важны?» . Национальные институты здоровья . Проверено 28 октября 2018 года .
- ^ Карла Хербертс; Марсель С.Г. Ква; Вред PH Hermsen (2011). «Факторы риска в развитии терапии стволовыми клетками» . Журнал трансляционной медицины . 9 (29): 29. DOI : 10,1186 / 1479-5876-9-29 . PMC 3070641 . PMID 21418664 .
- ^ а б Томсон, Дж. А; Ицковиц-Эльдор, Дж; Шапиро, СС; Вакниц, Массачусетс; Swiergiel, JJ; Маршалл, VS; Джонс, JM (1998). «Линии эмбриональных стволовых клеток, полученные из бластоцист человека» . Наука . 282 (5391): 1145–7. Bibcode : 1998Sci ... 282.1145T . DOI : 10.1126 / science.282.5391.1145 . PMID 9804556 .
- ^ Инь; Николс, Дж; Камеры, I; Смит, А (2003). «Индукция BMP белков Id подавляет дифференцировку и поддерживает самообновление эмбриональных стволовых клеток в сотрудничестве с STAT3». Cell . 115 (3): 281–292. DOI : 10.1016 / S0092-8674 (03) 00847-X . PMID 14636556 . S2CID 7201396 .
- ^ Мартелло, G .; Смит, А. (2014). «Природа эмбриональных стволовых клеток». Ежегодный обзор клеточной биологии и биологии развития . 30 : 647–75. DOI : 10,1146 / annurev-cellbio-100913-013116 . PMID 25288119 .
- ^ a b Boward, B .; Wu, T .; Далтон, С. (2016). «Краткий обзор: контроль клеточной судьбы посредством клеточного цикла и сетей плюрипотентности» . Стволовые клетки . 34 (6): 1427–36. DOI : 10.1002 / stem.2345 . PMC 5201256 . PMID 26889666 .
- ^ Уайт, J .; Stead, E .; Faast, R .; Conn, S .; Картрайт, П .; Далтон, С. (2005). «Активация развития пути Rb-E2F и установление регулируемой клеточным циклом циклин-зависимой киназной активности во время дифференцировки эмбриональных стволовых клеток» . Молекулярная биология клетки . 16 (4): 2018–27. DOI : 10.1091 / mbc.e04-12-1056 . PMC 1073679 . PMID 15703208 .
- ^ Сингх, Амар М .; Далтон, Стивен (2007-08-07). «Клеточный цикл и Myc пересекаются с механизмами, регулирующими плюрипотентность и перепрограммирование» . Стволовая клетка . 5 (2): 141–149. DOI : 10.1016 / j.stem.2009.07.003 . ISSN 1875-9777 . PMC 2909475 . PMID 19664987 .
- ^ Тер Huurne, Менно; Чаппелл, Джеймс; Далтон, Стивен; Штунненберг, Хендрик Г. (5 октября 2017 г.). «Отличный контроль клеточного цикла в двух различных состояниях плюрипотентности мышей» . Стволовая клетка . 21 (4): 449–455.e4. DOI : 10.1016 / j.stem.2017.09.004 . ISSN 1875-9777 . PMC 5658514 . PMID 28985526 .
- ^ Инь, Ци-Лун; Рэй, Джейсон; Николс, Дженнифер; Батль-Морера, Лаура; Добл, Брэдли; Вудгетт, Джеймс; Коэн, Филипп; Смит, Остин (22 мая 2008 г.). «Основное состояние самообновления эмбриональных стволовых клеток» . Природа . 453 (7194): 519–523. Bibcode : 2008Natur.453..519Y . DOI : 10,1038 / природа06968 . ISSN 1476-4687 . PMC 5328678 . PMID 18497825 .
- ^ Ли, Дж .; Вперед, Y .; Канг, И .; Хан, YM; Ким, Дж. (2010). «Oct-4 контролирует развитие клеточного цикла эмбриональных стволовых клеток» . Биохимический журнал . 426 (2): 171–81. DOI : 10.1042 / BJ20091439 . PMC 2825734 . PMID 19968627 .
- ^ Чжан, X .; Неганова, И .; Пржиборски, С .; Ян, С .; Cooke, M .; Аткинсон, СП; Anyfantis, G .; Феник, С .; Кейт, WN; Hoare, SF; Hughes, O .; Страчан, Т .; Стойкович, М .; Hinds, PW; Armstrong, L .; Лако, М. (2009). «Роль NANOG в переходе с G1 на S в человеческих эмбриональных стволовых клетках посредством прямого связывания CDK6 и CDC25A» . Журнал клеточной биологии . 184 (1): 67–82. DOI : 10,1083 / jcb.200801009 . PMC 2615089 . PMID 19139263 .
- ^ Mahla, Ranjeet (19 июля 2016). «Применение стволовых клеток в регенеративной медицине и терапии болезней» . Международный журнал клеточной биологии . 2016 : 6940283. дои : 10,1155 / 2016/6940283 . PMC 4969512 . PMID 27516776 .
- ^ Левенберг, S. (2002). «Эндотелиальные клетки, полученные из эмбриональных стволовых клеток человека» . Труды Национальной академии наук . 99 (7): 4391–4396. Bibcode : 2002PNAS ... 99.4391L . DOI : 10.1073 / pnas.032074999 . PMC 123658 . PMID 11917100 .
- ^ Чаны, A; Толлей, Н.С.; Бишоп, AE; Полак, JM (2005-08-01). «Эмбриональные стволовые клетки и тканевая инженерия: доставка стволовых клеток в клинику» . Журнал Королевского медицинского общества . 98 (8): 346–350. DOI : 10.1177 / 014107680509800804 . ISSN 0141-0768 .
- ^ «Клетки для тканевой инженерии» . Тенденции в биотехнологии . 18 (1): 17–19. 2000-01-01. DOI : 10.1016 / S0167-7799 (99) 01396-7 . ISSN 0167-7799 .
- ^ а б Давила, JC; Cezar, GG; Thiede, M; Стром, S; Мики, Т; Троско, Дж (2004). «Использование и применение стволовых клеток в токсикологии» . Токсикологические науки . 79 (2): 214–23. DOI : 10.1093 / toxsci / kfh100 . PMID 15014205 .
- ^ Сиу, CW; Мур, JC; Ли, РА (2007). «Кардиомиоциты, полученные из стволовых эмбриональных клеток человека, для лечения сердца». Цели лекарств от сердечно-сосудистых и гематологических заболеваний . 7 (2): 145–52. DOI : 10.2174 / 187152907780830851 . PMID 17584049 .
- Перейти ↑ Perrier, AL (2004). «Получение дофаминовых нейронов среднего мозга из человеческих эмбриональных стволовых клеток» . Труды Национальной академии наук . 101 (34): 12543–12548. Bibcode : 2004PNAS..10112543P . DOI : 10.1073 / pnas.0404700101 . PMC 515094 . PMID 15310843 .
- ^ Приход, CL; Аренас, Э (2007). «Стратегии лечения болезни Паркинсона на основе стволовых клеток». Нейродегенеративные заболевания . 4 (4): 339–47. DOI : 10.1159 / 000101892 . PMID 17627139 . S2CID 37229348 .
- ^ Waese, EY; Кандел, РА; Стэнфорд, Вашингтон (2008). «Применение стволовых клеток в восстановлении костей». Скелетная радиология . 37 (7): 601–8. DOI : 10.1007 / s00256-007-0438-8 . PMID 18193216 . S2CID 12401889 .
- ^ d'Amour, штат Калифорния; Bang, AG; Элиазер, S; Келли, О. Г.; Agulnick, AD; Смарт, НГ; Мурман, Массачусетс; Kroon, E; Карпентер, МК; Баетге, Э. (2006). «Производство эндокринных клеток, экспрессирующих гормон поджелудочной железы, из человеческих эмбриональных стволовых клеток». Природа Биотехнологии . 24 (11): 1392–401. DOI : 10.1038 / nbt1259 . PMID 17053790 . S2CID 11040949 .
- ^ Colen, BD (9 октября 2014) Giant скачок против диабета Гарвардский Gazette, Источник 24 ноября 2014
- ^ Menasché, Филипп; Ванно, Валери; Фабрегетт, Жан-Рош; Бел, Ален; Тоска, Люси; Гарсия, Сильви (21 марта 2015 г.). «На пути к клиническому использованию сердечных предшественников, полученных из человеческих эмбриональных стволовых клеток: трансляционный опыт» . Европейский журнал сердца . 36 (12): 743–750. DOI : 10.1093 / eurheartj / ehu192 . PMID 24835485 .
- ^ Дженсен, J; Хилльнер, Дж; Бьорквист, П. (2009). «Технологии человеческих эмбриональных стволовых клеток и открытие лекарств». Журнал клеточной физиологии . 219 (3): 513–9. DOI : 10.1002 / jcp.21732 . PMID 19277978 . S2CID 36354049 .
- ^ Söderdahl, T; Кюпперс-Мюнтер, Б; Heins, N; Эдсбэгдж, Дж; Björquist, P; Котгрив, I; Йернстрем, Б. (2007). «Глутатионтрансферазы в гепатоцитоподобных клетках, полученных из эмбриональных стволовых клеток человека». Токсикология in vitro . 21 (5): 929–37. DOI : 10.1016 / j.tiv.2007.01.021 . PMID 17346923 .
- ↑ «Доктор Юрий Верлинский, 1943–2009: эксперт в области репродуктивных технологий». Архивировано 8 августа 2009 г.в Wayback Machine Chicago Tribune , 20 июля 2009 г.
- ^ Мао Z, Боццелла М, Seluanov А, Горбунова В (сентябрь 2008 г.). «Ремонт ДНК путем негомологичного соединения концов и гомологичной рекомбинации во время клеточного цикла в клетках человека» . Клеточный цикл . 7 (18): 2902–6. DOI : 10.4161 / cc.7.18.6679 . PMC 2754209 . PMID 18769152 .
- ^ а б Тихи Э.Д., Пиллай Р., Дэн Л. и др. (Ноябрь 2010 г.). «Эмбриональные стволовые клетки мыши, но не соматические клетки, преимущественно используют гомологичную рекомбинацию для восстановления двухцепочечных разрывов ДНК» . Stem Cells Dev . 19 (11): 1699–711. DOI : 10,1089 / scd.2010.0058 . PMC 3128311 . PMID 20446816 .
- ^ Hong Y, Stambrook PJ (октябрь 2004). «Восстановление отсутствующей остановки G1 и защита от апоптоза в эмбриональных стволовых клетках после ионизирующего излучения» . Proc. Natl. Акад. Sci. США . 101 (40): 14443–8. Bibcode : 2004PNAS..10114443H . DOI : 10.1073 / pnas.0401346101 . PMC 521944 . PMID 15452351 .
- ^ Аладжем М.И., Спайк Б.Т., Родевальд Л.В. и др. (Январь 1998 г.). «ES клетки не активируют p53-зависимые стрессовые реакции и подвергаются p53-независимому апоптозу в ответ на повреждение ДНК». Curr. Биол . 8 (3): 145–55. DOI : 10.1016 / S0960-9822 (98) 70061-2 . PMID 9443911 . S2CID 13938854 .
- ^ Bernstein C Бернштейн H, Payne CM, Garewal H (июнь 2002). «Репарация ДНК / проапоптотические белки с двойной ролью в пяти основных путях репарации ДНК: надежная защита от канцерогенеза». Мутат. Res . 511 (2): 145–78. DOI : 10.1016 / S1383-5742 (02) 00009-1 . PMID 12052432 .
- ^ Сервантес RB, Stringer JR, Шао C, Tischfield JA, Stambrook PJ (март 2002). «Эмбриональные стволовые клетки и соматические клетки различаются по частоте и типу мутаций» . Proc. Natl. Акад. Sci. США . 99 (6): 3586–90. Bibcode : 2002PNAS ... 99.3586C . DOI : 10.1073 / pnas.062527199 . PMC 122567 . PMID 11891338 .
- ^ «FDA одобряет исследование человеческих эмбриональных стволовых клеток - CNN.com» . 23 января 2009 . Проверено 1 мая 2010 года .
- ^ Кирстед HS, Нистор G, Бернал G и др. (2005). «Трансплантаты клеток-предшественников олигодендроцитов, полученных из эмбриональных стволовых клеток человека, ремиелинируют и восстанавливают двигательную активность после повреждения спинного мозга» (PDF) . J. Neurosci . 25 (19): 4694–705. DOI : 10.1523 / JNEUROSCI.0311-05.2005 . PMC 6724772 . PMID 15888645 .
- ^ Рейнберг, Стивен (2009-01-23) FDA одобряет первое испытание эмбриональных стволовых клеток . Вашингтон Пост
- ^ Герон комментирует, что FDA придерживается испытания травмы спинного мозга . geron.com (27 августа 2009 г.)
- ^ Vergano, Dan (11 октября 2010). «Эмбриональные стволовые клетки используются пациенту впервые» . USA Today . Проверено 12 октября 2010 года .
- ^ Коричневый, Eryn (15 ноября 2011). «Geron прекращает исследования стволовых клеток» . LA Times . Проверено 15 ноября 2011 .
- ^ "Отличные новости: Дочерняя компания BioTime Asterias приобретает программу эмбриональных стволовых клеток Geron" . iPScell.com . 1 октября 2013.
- ^ a b c d Калифорнийский институт регенеративной медицины. Архивировано 24 октября 2017 г. в Wayback Machine . BioTime, Inc.
- ^ Knoepfler, Пол С. (2009). «Деконструкция онкогенности стволовых клеток: дорожная карта для безопасной регенеративной медицины» . Стволовые клетки . 27 (5): 1050–6. DOI : 10.1002 / stem.37 . PMC 2733374 . PMID 19415771 .
- ^ Варлаханова Наталья В .; Коттерман, Ребекка Ф .; Деврис, Вильгельмин Н .; Морган, Джуди; Донахью, Лия Рэй; Мюррей, Стивен; Ноулз, Барбара Б .; Кнёпфлер, Пол С. (2010). «Myc поддерживает плюрипотентность и самообновление эмбриональных стволовых клеток» . Дифференциация . 80 (1): 9–19. DOI : 10.1016 / j.diff.2010.05.001 . PMC 2916696 . PMID 20537458 .
- ^ Верниг, Мариус; Мейснер, Александр; Кэссиди, Джон П.; Яениш, Рудольф (2008). «C-Myc незаменим для прямого репрограммирования фибробластов мыши». Стволовая клетка . 2 (1): 10–2. DOI : 10.1016 / j.stem.2007.12.001 . PMID 18371415 .
- ^ Король, Нэнси; Перрин, Джейкоб (7 июля 2014 г.). «Этические вопросы исследования и лечения стволовых клеток» . Исследование стволовых клеток и терапия . 5 (4): 85. DOI : 10,1186 / scrt474 . PMC 4097842 . PMID 25157428 .
- ^ Kleinsmith LJ, Пирс GB - младший (1964). «Мультипотентность клеток одиночной эмбриональной карциномы» . Cancer Res . 24 : 1544–51. PMID 14234000 .
- ^ Мартин GR (1980). «Тератокарциномы и эмбриогенез млекопитающих». Наука . 209 (4458): 768–76. Bibcode : 1980Sci ... 209..768M . DOI : 10.1126 / science.6250214 . PMID 6250214 .
- ^ а б Эванс М, Кауфман М (1981). «Создание в культуре плюрипотентных клеток из эмбрионов мыши». Природа . 292 (5819): 154–6. Bibcode : 1981Natur.292..154E . DOI : 10.1038 / 292154a0 . PMID 7242681 . S2CID 4256553 .
- ^ а б Мартин Дж. (1981). «Выделение плюрипотентной клеточной линии из ранних эмбрионов мыши, культивируемых в среде, кондиционированной стволовыми клетками тератокарциномы» . Proc Natl Acad Sci USA . 78 (12): 7634–8. Bibcode : 1981PNAS ... 78.7634M . DOI : 10.1073 / pnas.78.12.7634 . PMC 349323 . PMID 6950406 .
- ^ "Нобелевская премия 2007 года по физиологии и медицине - расширенная информация" . Нобелевская премия . Nobel Media.
- ^ Томпсон, Джеймс А .; Ицковиц-Эльдор, Джозеф; Шапиро, Сандер С .; Waknitz, Michelle A .; Swiergiel, Jennifer J .; Marshall, Vivienne S .; Джонс, Джеффри М. (6 ноября 1998 г.). «Линии эмбриональных стволовых клеток, полученные из бластоцисты человека» . Наука . 282 (5391): 1145–1147. Bibcode : 1998Sci ... 282.1145T . DOI : 10.1126 / science.282.5391.1145 . PMID 9804556 .
- ^ "Обращение президента Джорджа Буша к исследованию стволовых клеток" . CNN Внутри политики. CNN. 9 августа 2001 г.
- ^ Яманака, Шинья; Такахаши, Кадзутоши (25 августа 2006 г.). «Индукция плюрипотентных стволовых клеток из эмбриональных и взрослых культур фибробластов мыши с помощью определенных факторов». Cell . 126 (4): 663–676. DOI : 10.1016 / j.cell.2006.07.024 . hdl : 2433/159777 . PMID 16904174 . S2CID 1565219 .
- ^ Wadman, Мередит (27 января 2009). «Стволовые клетки готовы к прайм-тайму» . Природа . 457 (7229): 516. DOI : 10.1038 / 457516a . PMID 19177087 .
- ^ «Исполнительный приказ 13505 - Устранение препятствий для ответственных научных исследований с участием стволовых клеток человека» (PDF) . Федеральный реестр: документы президента . 74 (46). 11 марта 2009 г.
- ^ Mountford, JC (2008). «Эмбриональные стволовые клетки человека: происхождение, характеристики и возможности регенеративной терапии». Transfus Med . 18 (1): 1–12. DOI : 10.1111 / j.1365-3148.2007.00807.x . PMID 18279188 . S2CID 20874633 .
- ^ Thomson JA, Itskovitz-Элдор J, Шапиро С., Waknitz М.А., Swiergiel JJ, Маршалл В. С., Джонс JM (1998). «Линии эмбриональных стволовых клеток, полученные из бластоцист человека» . Наука . 282 (5391): 1145–1147. Bibcode : 1998Sci ... 282.1145T . DOI : 10.1126 / science.282.5391.1145 . PMID 9804556 .
- ↑ Smith AG, Heath JK, Donaldson DD, Wong GG, Moreau J, Stahl M, Rogers D (1988). «Ингибирование плюрипотенциальной дифференцировки эмбриональных стволовых клеток очищенными полипептидами». Природа . 336 (6200): 688–690. Bibcode : 1988Natur.336..688S . DOI : 10.1038 / 336688a0 . PMID 3143917 . S2CID 4325137 .
- ^ Williams RL, Hilton DJ, Pease S, Willson TA, Stewart CL, Gearing DP, Wagner EF, Metcalf D, Nicola NA, Gough NM (1988). «Фактор ингибирования миелоидного лейкоза поддерживает потенциал развития эмбриональных стволовых клеток». Природа . 336 (6200): 684–687. Bibcode : 1988Natur.336..684W . DOI : 10.1038 / 336684a0 . PMID 3143916 . S2CID 4346252 .
- ^ Ledermann B, Бюрки K (1991). «Создание компетентной зародышевой линии линии эмбриональных стволовых клеток C57BL / 6». Exp Cell Res . 197 (2): 254–258. DOI : 10.1016 / 0014-4827 (91) 90430-3 . PMID 1959560 .
- ^ Такахаши К, Tanabe К, Ohnuki М, Нарита М, Ichisaka Т, Tomoda К, Яманака S (2007). «Индукция плюрипотентных стволовых клеток из фибробластов взрослого человека определенными факторами». Cell . 131 (5): 861–872. DOI : 10.1016 / j.cell.2007.11.019 . hdl : 2433/49782 . PMID 18035408 . S2CID 8531539 .
- ^ Klimanskaya I, Chung Y, Becker S, Lu SJ, Lanza R (2006). «Линии эмбриональных стволовых клеток человека, полученные из отдельных бластомеров». Природа . 444 (7118): 481–5. Bibcode : 2006Natur.444..481K . DOI : 10,1038 / природа05142 . PMID 16929302 . S2CID 84792371 .
- ↑ Американские ученые с облегчением снимают запрет на исследования стволовых клеток Обамы , The Guardian , 10 марта 2009
- ^ Татибана, Масахито; Амато, Паула; Спарман, Мишель; Гутьеррес, Нурия Марти; Типпнер-Хеджес, Ребекка; Ма, Хун; Канг, Ынджу; Фулати, Алимуцзян; Ли, Хё-Сан; Шританаудомчай, Хатхаитип; Мастерсон, Кит (2013-06-06). «Человеческие эмбриональные стволовые клетки, полученные путем переноса ядра соматической клетки» . Cell . 153 (6): 1228–1238. DOI : 10.1016 / j.cell.2013.05.006 . ISSN 0092-8674 .
- ↑ Чанг, Янг Ги; Юм, Джин Хи; Ли, Чжон Ын; Шим, Сун Хан; Сепилиан, Викен; Хонг, Сын Ук; Ли, Юми; Treff, Nathan R .; Чой, Ён Хо; Kimbrel, Erin A .; Диттман, Ральф Э. (05.06.2014). «Перенос ядра соматической клетки человека с использованием взрослых клеток» . Стволовая клетка . 14 (6): 777–780. DOI : 10.1016 / j.stem.2014.03.015 . ISSN 1934-5909 . PMID 24746675 .
- ^ Такахаши, K; Яманака, S (2006). «Индукция плюрипотентных стволовых клеток из эмбриональных и взрослых культур фибробластов мыши с помощью определенных факторов». Cell . 126 (4): 663–76. DOI : 10.1016 / j.cell.2006.07.024 . hdl : 2433/159777 . PMID 16904174 . S2CID 1565219 .
- ^ "Нобелевская премия по физиологии и медицине - пресс-релиз 2012" . Nobel Media AB. 8 октября 2012 г.
- ^ Верниг, Мариус; Мейснер, Александр; Форман, Рут; Брамбринк, Тобиас; Ку, Манчинг; Хохедлингер, Конрад; Бернштейн, Брэдли Э .; Яениш, Рудольф (19 июля 2007 г.). «Перепрограммирование фибробластов in vitro в плюрипотентное состояние, подобное ES-клеткам». Природа . 448 (7151): 318–324. Bibcode : 2007Natur.448..318W . DOI : 10,1038 / природа05944 . ISSN 1476-4687 . PMID 17554336 . S2CID 4377572 .
- ^ «Эмбриональные стволовые клетки без эмбрионов» . Рейтер . 21 ноября 2007 г.
- ^ Вайс, Рик (2007-12-07). «Ученые лечат мышей от серповидных клеток, используя метод стволовых клеток: новый подход - это кожа, а не эмбрионы» . Вашингтон Пост . стр. A02.
- ^ Ханна, J .; Wernig, M .; Маркулаки, S .; Sun, C.-W .; Meissner, A .; Кэссиди, JP; Beard, C .; Brambrink, T .; Wu, L.-C .; Townes, TM; Яениш Р. (2007). «Лечение мышиной модели серповидной анемии iPS-клетками, полученными из аутологичной кожи». Наука . 318 (5858): 1920–3. Bibcode : 2007Sci ... 318.1920H . DOI : 10.1126 / science.1152092 . PMID 18063756 . S2CID 657569 .
- ↑ Хелен Бриггс (17 января 2008 г.). «Команда США делает клон эмбриона человека» . BBC . стр. A01.
- ↑ Эберт, Джессика (24 января 2005 г.). «Стволовые клетки человека вызывают иммунную атаку» . Новости природы . Лондон: Издательская группа Nature . DOI : 10.1038 / news050124-1 . Архивировано из оригинала на 2010-09-24 . Проверено 27 февраля 2009 .
- ^ Martin MJ, Muotri A, F Gage, Варки A (2005). «Эмбриональные стволовые клетки человека экспрессируют иммуногенную сиаловую кислоту, отличную от человека». Nat. Med . 11 (2): 228–32. DOI : 10.1038 / nm1181 . PMID 15685172 . S2CID 13739919 .
- ^ Klimanskaya я, Chung Y, Мейснер л, Джонсон Дж, Западный MD, Ланца R (2005). «Эмбриональные стволовые клетки человека, полученные без питающих клеток». Ланцет . 365 (9471): 1636–41. DOI : 10.1016 / S0140-6736 (05) 66473-2 . PMID 15885296 . S2CID 17139951 .
Внешние ссылки [ править ]
| Викискладе есть медиафайлы, связанные с эмбриональными стволовыми клетками . |
- Понимание стволовых клеток: взгляд на науку и проблемы национальных академий
- Национальные институты здоровья
- Практический семинар Оксфордского университета по технологии плюрипотентных стволовых клеток
- Информационный бюллетень об эмбриональных стволовых клетках
- Информационный бюллетень по этическим вопросам исследования эмбриональных стволовых клеток
- Информация и альтернативы исследованиям эмбриональных стволовых клеток
- Блог, посвященный ES-клеткам и iPS-клеткам, включая исследования, биотехнологии и вопросы, ориентированные на пациентов.