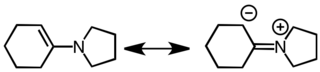
Енаминовый представляет собой ненасыщенное соединение , полученный конденсацией альдегида или кетона с вторичным амином . [1] [2] Енамины являются универсальными промежуточными продуктами. [3] [4]
 Конденсация с образованием енамина. [5]
Конденсация с образованием енамина. [5]
Слово «енамин» образовано от аффикса en -, используемого в качестве суффикса алкена , и корневого амина . Это можно сравнить с енолом , который представляет собой функциональную группу, содержащую как алкен ( ен -), так и спирт (- ол ). Енамины считаются азотными аналогами енолов. [6]
Если один из заместителей азота представляет собой атом водорода H, это таутомерная форма имина . Обычно это перегруппируется в имин; однако есть несколько исключений (например, анилин ). Енамин-иминную таутомерию можно рассматривать как аналог кето-енольной таутомерии . В обоих случаях атом водорода переключает свое положение между гетероатомом (кислородом или азотом) и вторым атомом углерода.
Енамины являются хорошими нуклеофилами и хорошими основаниями. Их поведение как углеродных нуклеофилов объясняется со ссылкой на следующие резонансные структуры.
Формирование [ править ]
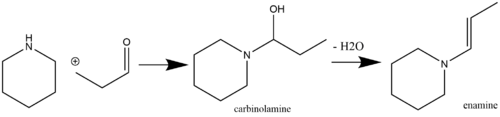
Енамины являются лабильными и, следовательно, химически полезными фрагментами, которые можно легко получить из коммерчески доступных исходных реагентов. Обычный путь получения енамина - это катализируемая кислотой нуклеофильная реакция кетонов (Stork, 1963) или альдегидов (Mannich / Davidsen, 1936), содержащих α-водород, со вторичными аминами. Кислотный катализ не всегда требуется, если рКа реагирующего амина достаточно высока (например, пирролидина , у которого рКа 11,26). Однако, если pKa реагирующего амина низкое, то требуется кислотный катализ как на стадии добавления, так и на стадии дегидратации [7] (обычные дегидратирующие агенты включают MgSO 4 и Na 2 SO 4 ).[8] Первичные амины обычно не используются для синтеза енаминов из-за преимущественного образования более термодинамически стабильных видов имина. [9] Самоконденсация метилкетона - это побочная реакция, которой можно избежать путем добавления TiCl 4 [10] в реакционную смесь (чтобы он действовал как поглотитель воды). [11] [12] Пример реакции альдегида с вторичным амином с образованием енамина через промежуточный карбиноламин показан ниже:
Реакции [ править ]
Алкилирование [ править ]
Хотя енамины более нуклеофильны, чем их енольные аналоги, они все же могут реагировать избирательно, что делает их пригодными для реакций алкилирования. Нуклеофил енамина может атаковать галогеналканы с образованием промежуточного соединения - соли алкилированного иминия, которое затем гидролизуется с регенерированием кетона (исходного материала в синтезе енамина). Эта реакция была впервые предложена Гилбертом Сторком и иногда упоминается по имени ее изобретателя. Аналогично эту реакцию можно использовать как эффективное средство ацилирования. В этой реакции можно использовать различные алкилирующие и ацилирующие агенты, включая бензиловые, аллильные галогениды. [13]
Ацилирование [ править ]
В реакции, очень похожей на алкилирование енаминов, енамины можно ацилировать с образованием конечного дикарбонильного продукта. Исходный енамин подвергается нуклеофильному присоединению к ацилгалогенидам с образованием промежуточной иминиевой соли, которая может гидролизоваться в присутствии кислоты. [14]
Металлоенамины [ править ]
Сильные основания, такие как LiNR2, можно использовать для депротонирования иминов и образования металлоенаминов. Металлоенамины могут оказаться синтетически полезными из-за их нуклеофильности (они более нуклеофильны, чем еноляты). Таким образом, они лучше способны реагировать с более слабыми электрофилами (например, их можно использовать для открытия эпоксидов. [15] ). Наиболее заметно, что эти реакции позволили асимметричное алкилирование кетонов через превращение в хиральные промежуточные металлоенамины. [16]
Галогенирование [ править ]
Соединения β-галогениммония могут быть синтезированы посредством реакции енаминов с галогенидами в растворителе на основе диэтилового эфира. Гидролиз приведет к образованию α-галогенкетонов. [17] Было показано, что хлорирование, бромирование и даже йодирование возможно. Общая реакция показана ниже:
Окислительная связь [ править ]
Енамины могут быть эффективно связаны с енольными силанами посредством обработки нитратом аммония Ce (IV). Об этих реакциях сообщила группа Нарасака в 1935 году, указав путь к стабильным енаминам, а также один пример 1,4-дикетона (полученного из реагента морфолинамина). [18] Позже эти результаты были использованы группой MacMillan при разработке органокатализатора, который использовал субстраты Narasaka для энантиоселективного получения 1,4-дикарбонилов с хорошими выходами. [19] Окислительная димеризация альдегидов в присутствии аминов протекает через образование енамина с последующим окончательным образованием пиррола. [20]Этот метод симметричного синтеза пиррола был разработан в 2010 году группой Jia как новый ценный путь синтеза пирролсодержащих природных продуктов. [21]
Аннулирование [ править ]
Химия енаминов была реализована с целью получения энантиоселективной версии аннуляции Робинсона с одним горшком . Робинсон кольчатость , опубликованный Роберт Робинсон в 1935 году, является базовой катализируемой реакцией , которая сочетает в себе кетон и метилвинилкетон (обычно сокращенно МКИ) , чтобы сформировать циклогексенон конденсированных кольцевой системы. Эта реакция может катализироваться пролином и проходить через промежуточные хиральные енамины, которые обеспечивают хорошую стереоселективность. [22] Это важно, в частности, в области синтеза природных продуктов, например, для синтеза кетона Виланда-Мешера - жизненно важного строительного блока для более сложных биологически активных молекул. [23] [24]
Реакционная способность [ править ]
Енамины действуют как нуклеофилы, которым для реакционной способности требуется меньшая кислотно-щелочная активация, чем их енолятные аналоги. Также было показано, что они обладают большей селективностью при меньшем количестве побочных реакций. Между различными типами енаминов существует градиент реакционной способности, при этом кетонные енамины обладают большей реакционной способностью, чем их альдегидные аналоги. [25]Циклические кетоновые енамины следуют тенденции реакционной способности, при которой пятичленное кольцо является наиболее реакционноспособным из-за его максимально плоской конформации у азота, следуя тенденции 5> 8> 6> 7 (семичленное кольцо является наименее реакционно-способным). Эту тенденцию приписывают количеству p-символа на орбитали неподеленной пары азота - более высокий p-символ соответствует большей нуклеофильности, потому что p-орбиталь допускает передачу на π-орбиталь алкена. Аналогично, если N неподеленная пара участвует в стереоэлектронных взаимодействиях на аминовом фрагменте, неподеленная пара выскочит из плоскости (будет пирамидализироваться) и нарушит передачу в соседнюю π CC-связь. [26] [27]
Есть много способов модулировать реакционную способность енамина в дополнение к изменению стерических / электронных компонентов в азотном центре, включая изменение температуры, растворителя, количества других реагентов и типа электрофила. Настройка этих параметров обеспечивает преимущественное образование енаминов E / Z, а также влияет на образование более / менее замещенного енамина из исходного материала кетона. [28]
См. Также [ править ]
- Прекращает реакцию алкилирования гидразона SAMP / RAMP
- Реакция Хайоса – Пэрриша – Эдера – Зауэра – Вихерта.
- Майкл Аддишн
- Синтез индола Неницеску
- Органокатализ
- Аннулирование Робинсона
- Алкилирование енамином аиста
- Торп реакция
- Флуоксиместерон
Ссылки [ править ]
- ^ Clayden, Джонатан (2001). Органическая химия . Оксфорд, Оксфордшир: Издательство Оксфордского университета. ISBN 978-0-19-850346-0.
- ^ Смит, Майкл Б .; Март, Джерри (2007), Расширенная органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Енамины: синтез: структура и реакции, второе издание, Гилберт Кук (редактор). 1988, Марсель Деккер, Нью-Йорк. ISBN 0-8247-7764-6
- ^ RB Woodward, IJ Пэчтер и ML Scheinbaum (1974). «2,2- (Триметилендитио) циклогексанон» . Органический синтез . 54 : 39.CS1 maint: несколько имен: список авторов ( ссылка ); Сборник , 5 , с. 1014
- ^ RD Burpitt и JG Thweatt (1968). «Циклодеканон» . Органический синтез . 48 : 56.; Сборник , 5 , с. 277
- ^ Имины и енамины | PharmaXChange.info
- ^ Капон, Брайан; У, Чжэнь Пин (апрель 1990 г.). «Сравнение таутомеризации и гидролиза некоторых вторичных и третичных енаминов». Журнал органической химии . 55 (8): 2317–2324. DOI : 10.1021 / jo00295a017 .
- ^ Локнер, Джеймс. "Стехиометрическая химия енаминов" (PDF) . Группа Баран, Исследовательский институт Скриппса . Проверено 26 ноября 2014 года .
- ^ Фермер, Стивен (2013-10-16). «Реакции энамина» . UC Davis Chem Wiki.
- ^ Карлсон, R; Нильссон, А (1984). «Улучшенная процедура синтеза тетрахлорида титана для синтеза енамина» . Acta Chemica Scandinavica . 38B : 49–53. DOI : 10.3891 / acta.chem.scand.38b-0049 .
- ^ Локнер, Джеймс. "Стехиометрическая химия енаминов" (PDF) . Группа Баран, Исследовательский институт Скриппса . Проверено 26 ноября 2014 года .
- ^ Белый, Уильям Эндрю; Вайнгартен, Гарольд (январь 1967). «Универсальный синтез нового енамина». Журнал органической химии . 32 (1): 213–214. DOI : 10.1021 / jo01277a052 .
- ^ Уэйд, LG (1999). Органическая химия . Река Сэдл, Нью-Джерси: Prentice Hall. С. 1019 .
- ^ Фермер, Стивен (2013-10-16). «Реакции энамина» . UC Davis Chem Wiki.
- ^ Эванс, Д. «Енолаты и металлоенамины II» (PDF) . Проверено 10 декабря 2014 . [ постоянная мертвая ссылка ]
- ^ Мейерс, AI; Уильямс, Дональд Р. (август 1978 г.). «Асимметричное алкилирование ациклических кетонов через хиральные металлоенамины. Влияние кинетических и термодинамических металлов». Журнал органической химии . 43 (16): 3245–3247. DOI : 10.1021 / jo00410a034 .
- ^ Seufert, Уолтер; Эйфенбергер, Франц (1979). "Zur Halogenierung von Enaminen - Darstellung von β-Halogen-iminium-halogeniden". Chemische Berichte . 112 (5): 1670–1676. DOI : 10.1002 / cber.19791120517 .
- ^ Ито, Y; Konoike, T; Саегуса, Т. (1975). «Синтез 1,4-дикетонов реакцией простого силиленольного эфира с оксидом серебра. Региоспецифическое образование промежуточных продуктов енолята серебра (I)». Журнал Американского химического общества . 97 (3): 649–651. DOI : 10.1021 / ja00836a034 .
- ^ Jang, HY; Hong, JB; Макмиллан, DWC (2007). «Энантиоселективная органокаталитическая активация одиночных молекулярных орбиталей: энантиоселективная альфа-еноляция альдегидов» (PDF) . Варенье. Chem. Soc . 129 (22): 7004–7005. DOI : 10.1021 / ja0719428 . PMID 17497866 .
- ^ Ли, Q; Вентилятор, А; Лу, З; Cui, Y; Линь, Вт; Цзя, Y (2010). «Однореакторный AgOAc-опосредованный синтез полизамещенных пирролов из первичных аминов и альдегидов: применение к полному синтезу пурпурона». Органические буквы . 12 (18): 4066–4069. DOI : 10.1021 / ol101644g . PMID 20734981 .
- ^ Го, Фэнхай; Клифт, Майкл Д .; Томсон, Риган Дж. (Сентябрь 2012 г.). «Окислительное связывание енолатов, енолсиланов и енаминов: методы и синтез природных продуктов» . Европейский журнал органической химии . 2012 (26): 4881–4896. DOI : 10.1002 / ejoc.201200665 . PMC 3586739 . PMID 23471479 .
- ^ Список, Бенджамин (2002). «Асимметричные реакции, катализируемые пролином». Тетраэдр . 58 (28): 5573–5590. DOI : 10.1016 / s0040-4020 (02) 00516-1 .
- ^ Буй, Томми; Барбас (2000). «Асимметричное аннулирование Робинсона, катализируемое пролином». Буквы тетраэдра . 41 (36): 6951–6954. DOI : 10.1016 / s0040-4039 (00) 01180-1 .
- ^ Винер, Джейк. «Энантиоселективный органический катализ: подходы, отличные от MacMillan» (PDF) . Архивировано из оригинального (PDF) 26 октября 2017 года . Проверено 29 ноября 2014 года .
- ^ Hickmott, Питер (май 1982 г.). «Енамины: последние достижения в синтетических, спектроскопических, механистических и стереохимических аспектах - II». Тетраэдр . 38 (23): 3363–3446. DOI : 10.1016 / 0040-4020 (82) 85027-8 .
- Перейти ↑ Mayr, H. (2003). «Связь структура-нуклеофильность для енаминов». Chem. Евро. Дж . 9 (10): 2209–18. DOI : 10.1002 / chem.200204666 . PMID 12772295 .
- ^ Hickmott, Питер (май 1982 г.). «Енамины: последние достижения в синтетических, спектроскопических, механистических и стереохимических аспектах - II». Тетраэдр . 38 (23): 3363–3446. DOI : 10.1016 / 0040-4020 (82) 85027-8 .
- ^ Локнер, Джеймс. "Стехиометрическая химия енаминов" (PDF) . Группа Баран, Исследовательский институт Скриппса . Проверено 26 ноября 2014 года .