| Амилорид-чувствительный натриевый канал | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
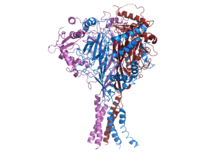 Структура ENaC человека. [1] | |||||||||||
| Идентификаторы | |||||||||||
| Символ | ASC | ||||||||||
| Pfam | PF00858 | ||||||||||
| ИнтерПро | IPR001873 | ||||||||||
| PROSITE | PDOC00926 | ||||||||||
| SCOP2 | 6BQN / SCOPe / SUPFAM | ||||||||||
| TCDB | 1.A.6 | ||||||||||
| OPM суперсемейство | 181 | ||||||||||
| Белок OPM | 4fz1 | ||||||||||
| |||||||||||
Эпителиального натриевого канала (сокращенно: ENaC , также: амилорид-чувствительных натриевых каналов ) представляет собой связанный с мембраной ионного канала , который селективно проницаемой для ионов из натрия ( Na+
) и который собран как гетеротример, состоящий из трех гомологичных субъединиц α или δ, β и γ, [2] Эти субъединицы кодируются четырьмя генами: SCNN1A , SCNN1B , SCNN1G и SCNN1D . Он участвует в основном в реабсорбции ионов натрия в собирательных трубочек в почках «ы нефронов .
Апикальные мембраны многих плотных эпителиев содержат натриевые каналы , которые в первую очередь характеризуются высоким сродством к блокатору диуретиков амилориду . [2] [3] [4] [5] Эти каналы обеспечивают первую стадию активной реабсорбции натрия, необходимой для поддержания гомеостаза солей и воды в организме. [3] У позвоночных каналы контролируют реабсорбцию натрия в почках, толстой кишке, легких и потовых железах; они также играют роль во вкусовом восприятии.
Эпителиальные натриевые каналы структурно и, вероятно, эволюционно связаны с пуринорецепторами P2X , болевыми рецепторами, которые активируются при обнаружении АТФ.
Расположение и функции [ править ]
ENaC находится в апикальной мембране поляризованных эпителиальных клеток, в частности, в почках (в первую очередь в собирательных трубочках), легких , коже [6], мужских и женских репродуктивных трактах и толстой кишке . [2] [7] [8] Эпителиальные натриевые каналы способствуют реабсорбции Na2 через апикальные мембраны эпителия в дистальных отделах нефрона , дыхательных и репродуктивных трактах и экзокринных железах . Поскольку концентрация ионов Na⁺ является основным определяющим фактором осмолярности внеклеточной жидкости , изменения концентрации Na⁺ влияют на движение жидкостей и, следовательно, на объем жидкости и кровяное давление. Активность ENaC в толстой кишке и почках модулируется минеральным кортикоидом альдостероном . Он может быть заблокирован триамтереном или амилоридом , которые используются в медицине как диуретики . В почках он ингибируется предсердным натрийуретическим пептидом , вызывая натрийурез и диурез.
Эпителиальные Na + каналы (ENaC) в головном мозге играют важную роль в регуляции кровяного давления. [9] Вазопрессин (VP) нейроны играют ключевую роль в координации нейроэндокринных и вегетативных реакций для поддержания сердечно-сосудистого гомеостаза. Высокое потребление соли с пищей вызывает увеличение экспрессии и активности ENaC, что приводит к устойчивой деполяризации нейронов VP. [9] Это один из механизмов, лежащих в основе того, как потребление соли с пищей влияет на активность нейронов VP через активность ENaC. Каналы ENaC в головном мозге участвуют в реакции артериального давления на пищевой натрий.
Исследования иммунофлуоресценции с высоким разрешением показали, что в дыхательных путях и женских репродуктивных путях ENaC располагается по всей длине ресничек, которые покрывают поверхность мультиресничных клеток. [7] Следовательно, в этих эпителиях с подвижными ресничками ENaC функционирует как регулятор осмолярности перицилиарной жидкости, и его функция важна для поддержания объема жидкости на глубине, необходимой для подвижности ресничек. В дыхательных путях это движение необходимо для очистки поверхности слизистой оболочки , а в женских половых путях подвижность ресничек важна для движения ооцитов. [7]
В отличие от ENaC, CFTR, который регулирует транспорт хлорид-ионов, не обнаруживается на ресничках. Эти данные противоречат предыдущей гипотезе о том, что ENaC подавляется прямым взаимодействием с CFTR. У пациентов с муковисцидозом (CF) CFTR не может подавлять ENaC, вызывая гиперабсорбцию в легких и рецидивирующие легочные инфекции. Было высказано предположение, что это может быть ионный канал, управляемый лигандом . [10]
В эпидермальных слоях кожи ENaC экспрессируется в кератиноцитах, сальных железах и гладкомышечных клетках. [6] В этих клетках ENaC в основном располагается в цитоплазме. [6] В эккринных потовых железах ENaC преимущественно располагается в апикальной мембране, обращенной к просвету потовых протоков. [6] Основная функция ENaC в этих протоках - повторное поглощение ионов Na⁺, которые выводятся с потом. У пациентов с мутациями ENaC, вызывающими системный псевдогипоальдостеронизм I типа, пациенты могут терять значительное количество ионов Na⁺, особенно в жарком климате.
ENaC также находится во вкусовых рецепторах , где играет важную роль в восприятии солености . У грызунов практически весь солевой вкус опосредуется ENaC, тогда как у людей он, по-видимому, играет менее значительную роль: около 20% могут быть отнесены к эпителиальному натриевому каналу.
Ионная селективность [ править ]
Исследования показывают, что канал ENaC проницаем для Na+
и Ли+ионов, но имеет очень небольшую проницаемость для K+, Cs+или Rb+ионы. [11] [12]
Транспортная реакция [ править ]
Обобщенная транспортная реакция для Na+
каналы это:
- Na+
(уходит) → Na+
(в)
Что для дегенеринов:
- Катион (выход) → катион (в)
Структура [ править ]
ENaC состоит из трех различных субъединиц: α, β, γ. [2] [13] Все три субъединицы необходимы для транспорта мембранных функциональных каналов на мембране. [14] С-конец каждой субъединицы ENaC содержит мотив PPXY, который при мутации или делеции в β- или γ-субъединице ENaC приводит к синдрому Лиддла, аутосомно-доминантной форме гипертензии у человека. CryoEM структура ENaC указывает на то, что канал представляет собой гетеротримерный белок , как ионный канал кислоты зондирования 1 (ASIC1) , который принадлежит к тому же семейству. [15] [16]Каждая из субъединиц состоит из двух трансмембранных спиралей и внеклеточной петли. Амино- и карбоксиконцы всех трех полипептидов расположены в цитозоле .
Кристаллическая структура ASIC1 и исследования сайт-направленного мутагенеза позволяют предположить, что ENaC имеет центральный ионный канал, расположенный вдоль центральной оси симметрии между тремя субъединицами. [12] [17]
С точки зрения структуры, белки, принадлежащие к этому семейству, состоят из примерно 510–920 аминокислотных остатков. Они состоят из внутриклеточной N-концевой области, за которой следует трансмембранный домен, большая внеклеточная петля, второй трансмембранный сегмент и С-концевой внутриклеточный хвост. [18]
δ-субъединица [ править ]
Кроме того, существует четвертая, так называемая δ-субъединица, которая имеет значительное сходство последовательностей с α-субъединицей и может образовывать функциональный ионный канал вместе с β- и γ-субъединицами. Такие δ-, β-, γ-ENaC появляются в поджелудочной железе , семенниках , легких и яичниках . Их функция пока неизвестна.
Семьи [ править ]
Члены эпителиального Na+
Канал (ENaC) делится на четыре подсемейства, называемых альфа, бета, гамма и дельта. [4] Белки имеют одинаковую очевидную топологию, каждый с двумя трансмембранными (ТМ) -протяжными сегментами (ТМС), разделенными большой внеклеточной петлей. В большинстве белков ENaC, изученных на сегодняшний день, внеклеточные домены высококонсервативны и содержат многочисленные остатки цистеина с фланкирующими С-концевыми амфипатическими областями TM, которые, как предполагается, вносят вклад в формирование гидрофильных пор белковых комплексов олигомерных каналов. Считается, что хорошо законсервированные внеклеточные домены служат рецепторами для контроля активности каналов.
Белки ENaC позвоночных из эпителиальных клеток плотно сгруппированы вместе на филогенетическом дереве; Нечувствительные к напряжению гомологи ENaC также обнаруживаются в головном мозге. Многие секвенированные белки C. elegans, в том числе дегенерины червей, имеют отдаленное родство с белками позвоночных, а также друг с другом. Белки ENaC позвоночных сходны с дегенеринами Caenorhabditis elegans : [18] deg-1, del-1, mec-4, mec-10 и unc-8. Эти белки могут подвергаться мутации, вызывая деградацию нейронов, и также считается, что они образуют натриевые каналы.
Надсемейство [ править ]
Эпителиальный натрий ( Na+
) channel (ENaC) принадлежит к суперсемейству ENaC / P2X. [19] Рецепторы ENaC и P2X имеют схожую трехмерную структуру и гомологичны. [20]
Гены [ править ]
Экзон-интронная архитектура трех генов, кодирующих три субъединицы ENaC, остается высококонсервативной, несмотря на расхождение их последовательностей. [21]
- SCNN1A , SCNN1B , SCNN1G , SCNN1D
Существует четыре связанных натриевых канала, чувствительных к амилориду:
- ACCN1 , ACCN2 , ACCN3 , ACCN4
Клиническое значение [ править ]
Взаимодействие ENaC с CFTR имеет важное патофизиологическое значение при муковисцидозе . CFTR представляет собой трансмембранный канал, ответственный за транспорт хлоридов, и дефекты этого белка вызывают кистозный фиброз, частично за счет активации канала ENaC в отсутствие функционального CFTR.
В дыхательных путях CFTR способствует секреции хлорида, а ионы натрия и вода пассивно следуют за ним. Однако в отсутствие функционального CFTR канал ENaC активируется и дополнительно снижает секрецию соли и воды за счет реабсорбции ионов натрия. Таким образом, респираторные осложнения при муковисцидозе вызваны не только недостатком секреции хлоридов, но и увеличением реабсорбции натрия и воды. Это приводит к отложению густой обезвоженной слизи, которая собирается в дыхательных путях, препятствуя газообмену и позволяя собирать бактерии. [22] Тем не менее, повышающая регуляция CFTR не корректирует влияние высокоактивного ENaC. [23]Вероятно, для поддержания функционального ионного гомеостаза в эпителиальной ткани легких необходимы другие взаимодействующие белки, такие как калиевые каналы, аквапорины или Na / K-АТФаза. [24]
В потовых железах CFTR отвечает за реабсорбцию хлоридов в потовых протоках. Ионы натрия пассивно проходят через ENaC в результате электрохимического градиента, вызванного потоком хлоридов. Это снижает потерю соли и воды. В отсутствие потока хлоридов при муковисцидозе ионы натрия не проходят через ENaC, что приводит к большей потере соли и воды. (Это верно, несмотря на усиление регуляции канала ENaC, поскольку поток в потовых протоках ограничивается электрохимическим градиентом, создаваемым потоком хлорида через CFTR.) Таким образом, кожа пациентов имеет соленый вкус, и это обычно используется для диагностики болезнь, как в прошлом, так и сегодня по современным электрическим испытаниям. [25]
Усиление функциональных мутаций β- и γ-субъединиц связано с синдромом Лиддла . [26]
Амилорид и триамтерен - это калийсберегающие диуретики, которые действуют как блокаторы эпителиальных натриевых каналов .
Ссылки [ править ]
- ^ Норенг, Сигрид; Бхарадвадж, Арпита; Позерт, Ричард; Йошиока, Крейг; Баконги, Изабель (25 сентября 2018). «Структура натриевого канала эпителия человека с помощью криоэлектронной микроскопии» . eLife . 7 : e39340. DOI : 10.7554 / eLife.39340 . ISSN 2050-084X . PMC 6197857 . PMID 30251954 .
- ^ a b c d Ханукоглу I, Ханукоглу A (январь 2016 г.). «Семейство эпителиальных натриевых каналов (ENaC): филогения, структура-функция, распределение тканей и связанные наследственные заболевания» . Джин . 579 (2): 95–132. DOI : 10.1016 / j.gene.2015.12.061 . PMC 4756657 . PMID 26772908 .
- ^ a b Гарти Х (май 1994). «Молекулярные свойства эпителиальных, блокирующих амилоридом Na + каналов». Журнал FASEB . 8 (8): 522–8. DOI : 10.1096 / fasebj.8.8.8181670 . PMID 8181670 . S2CID 173677 .
- ^ a b Le T, Saier MH (1996). «Филогенетическая характеристика семейства эпителиальных Na + каналов (ENaC)». Молекулярная мембранная биология . 13 (3): 149–57. DOI : 10.3109 / 09687689609160591 . PMID 8905643 .
- ^ Waldmann R, G Шампиньи, Bassilana Ж, Voilley Н, Lazdunski М (ноябрь 1995). «Молекулярное клонирование и функциональная экспрессия нового амилорид-чувствительного Na + канала» . Журнал биологической химии . 270 (46): 27411–4. DOI : 10.1074 / jbc.270.46.27411 . PMID 7499195 .
- ^ а б в г Ханукоглу I, Боггула В.Р., Вакнин Х., Шарма С., Клейман Т., Ханукоглу А. (январь 2017 г.). «Экспрессия эпителиального натриевого канала (ENaC) и CFTR в эпидермисе человека и эпидермальных придатках» . Гистохимия и клеточная биология . 147 (6): 733–748. DOI : 10.1007 / s00418-016-1535-3 . PMID 28130590 . S2CID 8504408 .
- ^ a b c Энука Й, Ханукоглу I, Эдельхейт О, Вакнин Х, Ханукоглу А (март 2012 г.). «Эпителиальные натриевые каналы (ENaC) равномерно распределены на подвижных ресничках в яйцеводе и дыхательных путях». Гистохимия и клеточная биология . 137 (3): 339–53. DOI : 10.1007 / s00418-011-0904-1 . PMID 22207244 . S2CID 15178940 .
- ↑ Sharma S, Hanukoglu A, Hanukoglu I (февраль 2018 г.). «Локализация эпителиального натриевого канала (ENaC) и CFTR в зародышевом эпителии яичка, клетках Сертоли и сперматозоидах». Журнал молекулярной гистологии . 49 (2): 195–208. DOI : 10.1007 / s10735-018-9759-2 . PMID 29453757 . S2CID 3761720 .
- ^ a b Шарма К., Хак М., Гидри Р., Уэта И., Теруяма Р. (сентябрь 2017 г.). «+ каналы (ENaC) в магноцеллюлярных нейросекреторных нейронах вазопрессина в супраоптическом ядре крысы» . Журнал физиологии . 595 (17): 5857–5874. DOI : 10,1113 / JP274856 . PMC 5577521 . PMID 28714095 .
- ^ Horisberger JD, Chraïbi A (2004). "Эпителиальный натриевый канал: канал, управляемый лигандом?" . Физиология нефрона . 96 (2): 37–41. DOI : 10.1159 / 000076406 . PMID 14988660 . S2CID 24608792 .
- ^ Happle R (октябрь 1990). «Птихотропизм как кожный признак ДЕТСКОГО синдрома». Журнал Американской академии дерматологии . 23 (4 Pt 1): 763–6. DOI : 10.1016 / 0190-9622 (90) 70285-р . PMID 2229513 .
- ^ а б Ханукоглу I (2017). «Натриевые каналы типа ASIC и ENaC: конформационные состояния и структуры фильтров ионной селективности» . Журнал FEBS . 284 (4): 525–545. DOI : 10.1111 / febs.13840 . PMID 27580245 . S2CID 24402104 .
- ^ Loffing Дж, Шильд л (ноябрь 2005 г.). «Функциональные домены эпителиального натриевого канала» . Журнал Американского общества нефрологов . 16 (11): 3175–81. DOI : 10,1681 / ASN.2005050456 . PMID 16192417 .
- ^ Edelheit О, Hanukoglu я, Dascal N, Hanukoglu А (апрель 2011). «Идентификация роли консервативных заряженных остатков во внеклеточном домене субъединицы эпителиального натриевого канала (ENaC) с помощью аланинового мутагенеза». Американский журнал физиологии. Почечная физиология . 300 (4): F887-97. DOI : 10,1152 / ajprenal.00648.2010 . PMID 21209000 .
- ^ Норенг, Сигрид; Бхарадвадж, Арпита; Позерт, Ричард; Йошиока, Крейг; Баконги, Изабель (25 сентября 2018). «Структура натриевого канала эпителия человека с помощью криоэлектронной микроскопии» . eLife . 7 : e39340. DOI : 10.7554 / eLife.39340 . ISSN 2050-084X . PMC 6197857 . PMID 30251954 .
- ^ Jasti Дж, Furukawa Н, Гонзэйлс Е.Б., Gouaux Е (2007). «Структура кислоточувствительного ионного канала 1 при разрешении 1,9 Å и низком pH». Природа . 449 (7160): 316–322. Bibcode : 2007Natur.449..316J . DOI : 10,1038 / природа06163 . PMID 17882215 .
- ^ Edelheit О, Бен-Шахар R, Dascal Н, Hanukoglu А, Hanukoglu я (апрель 2014). «Консервативные заряженные остатки на поверхности и границе раздела эпителиальных субъединиц натриевых каналов - роли в экспрессии на клеточной поверхности и реакции самоингибирования натрия». Журнал FEBS . 281 (8): 2097–111. DOI : 10.1111 / febs.12765 . PMID 24571549 . S2CID 5807500 .
- ^ a b Снайдер PM, McDonald FJ, Stokes JB, Welsh MJ (сентябрь 1994 г.). «Мембранная топология амилорид-чувствительного эпителиального натриевого канала». Журнал биологической химии . 269 (39): 24379–83. PMID 7929098 .
- ^ "ATP-gated P2X Receptor Cation Channel (P2X Receptor) Family" . Функциональная и филогенетическая классификация белков мембранного транспорта . Saier Lab. Group, UCSD и SDSC.
- ↑ Chen JS, Reddy V, Chen JH, Shlykov MA, Zheng WH, Cho J, Yen MR, Saier MH (2011). «Филогенетическая характеристика суперсемейств транспортных белков: превосходство программ SuperfamilyTree над программами, основанными на множественном выравнивании» . J. Mol. Microbiol. Biotechnol . 21 (3–4): 83–96. DOI : 10.1159 / 000334611 . PMC 3290041 . PMID 22286036 .
- ^ Саксен A, Hanukoglu I, Strautnieks SS, Томпсон RJ, Гардинер RM, Hanukoglu A (ноябрь 1998). «Генная структура человеческой амилорид-чувствительной эпителиальной бета-субъединицы натриевого канала». Сообщения о биохимических и биофизических исследованиях . 252 (1): 208–13. DOI : 10.1006 / bbrc.1998.9625 . PMID 9813171 .
- ^ Mall M, Грабб BR, Harkema JR, О'Нил WK, Boucher RC (май 2004). «Повышенная абсорбция Na + эпителиальными дыхательными путями вызывает у мышей заболевание легких, подобное муковисцидозу». Природная медицина . 10 (5): 487–93. DOI : 10.1038 / nm1028 . PMID 15077107 . S2CID 45366866 .
- ^ Грабб BR, О'Нил WK, Ostrowski LE, Kreda SM, кнопка B, Boucher RC (январь 2012). «Трансгенная экспрессия hCFTR не может исправить заболевание легких у мышей с β-ENaC» . Американский журнал физиологии. Клеточная и молекулярная физиология легких . 302 (2): L238-47. DOI : 10,1152 / ajplung.00083.2011 . PMC 3349361 . PMID 22003093 .
- ^ Toczyłowska-Mamińska R, Dołowy K (февраль 2012). «Ион-транспортирующие белки эпителия бронхов человека». Журнал клеточной биохимии . 113 (2): 426–32. DOI : 10.1002 / jcb.23393 . PMID 21975871 . S2CID 31970069 .
- ^ Бердиев BK, Кадри YJ, Benos DJ (февраль 2009). «Оценка ассоциации CFTR и ENaC» . Молекулярные биосистемы . 5 (2): 123–7. DOI : 10.1039 / B810471A . PMC 2666849 . PMID 19156256 .
- ^ Заболевания ионных каналов
Внешние ссылки [ править ]
- Эпителиальный + натриевый + канал в медицинских предметных рубриках Национальной медицинской библиотеки США (MeSH)