Ведущий раздел этой статьи может быть слишком коротким, чтобы адекватно резюмировать ее ключевые моменты . ( Ноябрь 2016 г. ) |
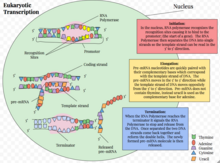
Эукариотическая транскрипция - это сложный процесс, который эукариотические клетки используют для копирования генетической информации, хранящейся в ДНК, в единицы переносимой комплементарной реплики РНК . [1] Транскрипция генов происходит как в эукариотических, так и в прокариотических клетках. В отличие от прокариотической РНК-полимеразы, которая инициирует транскрипцию всех различных типов РНК, РНК-полимераза у эукариот (включая человека) бывает трех разновидностей, каждая из которых транслирует разные типы гена. У эукариотической клетки есть ядро, которое разделяет процессы транскрипции и трансляции . Эукариотическая транскрипция происходит в ядре, где ДНК упакована в нуклеосомы.и структуры хроматина более высокого порядка . Сложность генома эукариот требует большого разнообразия и сложности контроля экспрессии генов.
Транскрипция эукариот происходит в три последовательных этапа: инициация, удлинение и завершение. [1]
Транскрибируемые РНК выполняют различные функции. Например, структурные компоненты рибосомы транскрибируются РНК-полимеразой I. Гены, кодирующие белок, транскрибируются РНК-полимеразой II в информационные РНК (мРНК), которые переносят информацию от ДНК к месту синтеза белка. [1] Более широко используются так называемые некодирующие РНК, на которые приходится большая часть транскрипционного выхода клетки. [2] Эти некодирующие РНК выполняют множество важных клеточных функций. [2]
РНК-полимераза [ править ]
У эукариот есть три ядерные РНК-полимеразы, каждая из которых имеет разные роли и свойства. [3] [4]
| Имя | Место расположения | Товар |
| РНК-полимераза I (Pol I, Pol A) | ядрышко | большая рибосомная РНК ( рРНК ) ( 28S , 18S , 5,8S ) |
| РНК-полимераза II (Pol II, Pol B) | ядро | информационная РНК ( мРНК ), большинство малых ядерных РНК ( мяРНК ), малые интерферирующие РНК ( миРНК ) и микроРНК ( миРНК ). |
| РНК-полимераза III (Pol III, Pol C) | ядро (и, возможно, интерфейс ядрышко- нуклеоплазма ) | переносящая РНК ( тРНК ), другие малые РНК (включая малую 5S рибосомную РНК (5s рРНК) , мяРНК U6, РНК частиц распознавания сигнала (SRP РНК) и другие стабильные короткие РНК |
РНК-полимераза I (Pol I) катализирует транскрипцию всех генов рРНК, кроме 5S. [3] [4] Эти гены рРНК организованы в единую транскрипционную единицу и транскрибируются в непрерывный транскрипт. Затем этот предшественник процессируется в три рРНК: 18S, 5,8S и 28S. Транскрипция генов рРНК происходит в специальной структуре ядра, называемой ядрышком [5], где транскрибируемые рРНК объединяются с белками с образованием рибосом . [6]
РНК-полимераза II (Pol II) отвечает за транскрипцию всех мРНК, некоторых мяРНК, миРНК и всех миРНК. [3] [4] Многие транскрипты Pol II временно существуют в виде однонитевых РНК-предшественников (пре-РНК), которые в дальнейшем процессируются с образованием зрелых РНК. [1] Например, мРНК-предшественники (пре-мРНК) интенсивно процессируются перед выходом в цитоплазму через ядерную пору для трансляции белка.
РНК-полимераза III (Pol III) транскрибирует небольшие некодирующие РНК, включая тРНК, 5S рРНК, U6 snRNA, SRP RNA и другие стабильные короткие РНК, такие как РНК рибонуклеазы P. [7]
РНК-полимеразы I, II и III содержат 14, 12 и 17 субъединиц соответственно. [8] Все три эукариотические полимеразы имеют пять основных субъединиц, которые проявляют гомологию с субъединицами β, β ', α I , α II и ω РНК-полимеразы E. coli. Идентичная ω-подобная субъединица (RBP6) используется всеми тремя эукариотическими полимеразами, в то время как одни и те же α-подобные субъединицы используются Pol I и III. Три эукариотические полимеразы разделяют между собой четыре другие общие субъединицы. Остальные субъединицы уникальны для каждой РНК-полимеразы. Дополнительные субъединицы, обнаруженные в Pol I и Pol III относительно Pol II, гомологичны факторам транскрипции Pol II. [8]
Кристаллические структуры РНК-полимераз I [9] и II [10] дают возможность понять взаимодействия между субъединицами и молекулярный механизм эукариотической транскрипции в атомных деталях.
Концевой карбоксильной домен (CTD) из RPB1 , самая большая субъединица РНК - полимеразы II, играет важную роль в объединении механизм необходим для синтеза и обработки транскриптов Pol II. [11] Длинный и структурно неупорядоченный CTD содержит несколько повторов гептапептидной последовательности YSPTSPS, которые подвергаются фосфорилированию и другим посттрансляционным модификациям в течение цикла транскрипции. Эти модификации и их регуляция составляют функциональный код CTD для контроля инициации, удлинения и терминации транскрипции и для связывания транскрипции и процессинга РНК. [11]
Инициирование [ править ]
Инициирование транскрипции гена у эукариот происходит на определенных этапах. [1] Во-первых, РНК-полимераза вместе с общими факторами транскрипции связывается с промоторной областью гена, образуя замкнутый комплекс, называемый преинициационным комплексом . Последующий переход комплекса из закрытого состояния в открытое состояние приводит к плавлению или разделению двух цепей ДНК и позиционированию цепи матрицы к активному центру РНК-полимеразы. Без необходимости в праймере РНК-полимераза может инициировать синтез новой цепи РНК, используя цепь ДНК-матрицы для управления выбором рибонуклеотидов и химией полимеризации. [1]Однако многие из инициированных синтезов прерываются до того, как транскрипты достигают значительной длины (~ 10 нуклеотидов). Во время этих прерванных циклов полимераза продолжает создавать и выделять короткие транскрипты до тех пор, пока не сможет произвести транскрипт, длина которого превышает десять нуклеотидов. Как только этот порог достигнут, РНК-полимераза проходит промотор, и транскрипция переходит к фазе элонгации. [1]
Эукариотические промоторы и общие факторы транскрипции [ править ]
Гены, транскрибируемые Pol II, содержат область в непосредственной близости от сайта начала транскрипции (TSS), которая связывает и позиционирует преинициативный комплекс. Эта область называется коровым промотором из-за ее важной роли в инициации транскрипции. [12] [13] В промоторах обнаружены различные классы элементов последовательности. Например, ТАТА-бокс представляет собой высококонсервативную последовательность распознавания ДНК для связывающего ТАТА-бокса белка, ТВР , связывание которого инициирует сборку комплекса транскрипции во многих генах.
Гены эукариот также содержат регуляторные последовательности за пределами корового промотора. Эти цис-действующие контрольные элементы связывают активаторы или репрессоры транскрипции для увеличения или уменьшения транскрипции с основного промотора. Хорошо охарактеризованные регулирующие элементы включают усилители , глушители и изоляторы . Эти регуляторные последовательности могут быть распределены на большом геномном расстоянии, иногда в сотнях килобаз от основных промоторов. [1]
Общие факторы транскрипции - это группа белков, участвующих в инициации и регуляции транскрипции. [1] Эти факторы обычно имеют ДНК-связывающие домены, которые связывают определенные элементы последовательности основного промотора и помогают рекрутировать РНК-полимеразу в сайт начала транскрипции. Общие факторы транскрипции для РНК-полимеразы II включают TFIID , TFIIA , TFIIB , TFIIF , TFIIE и TFIIH . [1] [14] [15]
Сборка преинициативного комплекса [ править ]
Транскрипция, полный набор общих факторов транскрипции и РНК-полимераза должны быть собраны на кор-промоторе, чтобы сформировать преинициативный комплекс ~ 2,5 миллиона дальтон. [16] Например, для промоторов, которые содержат TATA-бокс рядом с TSS, распознавание TATA-бокса субъединицей TBP TFIID инициирует сборку транскрипционного комплекса. Следующие белки, которые нужно ввести, - это TFIIA и TFIIB, которые стабилизируют комплекс ДНК-TFIID и привлекают Pol II вместе с TFIIF и дополнительными факторами транскрипции. TFIIF служит мостом между TATA-связанным TBP и полимеразой. Одним из последних факторов транскрипции, которые будут задействованы в преинициационном комплексе, является TFIIH, который играет важную роль в плавлении и ускользании промотора. [17]
Промотор плавления и образования открытого комплекса [ править ]
Для генов, транскрибируемых pol II, и в отличие от бактериальной РНК-полимеразы, плавление промотора требует гидролиза АТФ и опосредуется TFIIH. [17] TFIIH представляет собой белок из десяти субъединиц, включающий активность как АТФазы, так и протеинкиназы . [18] В то время как вышележащая промоторная ДНК удерживается в фиксированном положении с помощью TFIID, TFIIH втягивает нижележащую двухцепочечную ДНК в расщелину полимеразы, вызывая разделение цепей ДНК и переход преинициативного комплекса из закрытого в открытое состояние. . TFIIB способствует образованию открытых комплексов, связывая расплавленную ДНК и стабилизируя пузырек транскрипции .
Неудачное инициирование [ править ]
Как только комплекс инициации открывается, первый рибонуклеотид вводится в активный сайт, чтобы инициировать реакцию полимеризации в отсутствие праймера. [1] Это генерирует зарождающуюся цепь РНК, которая образует гетеродуплекс с цепью матричной ДНК. Однако перед вступлением в фазу элонгации полимераза может преждевременно завершиться и высвободить короткий усеченный транскрипт. Этот процесс называется преждевременным инициированием. [19] Многие циклы прерванной инициации могут произойти до того, как транскрипт вырастет до достаточной длины, чтобы способствовать уходу полимеразы от промотора. На протяжении циклов прерванной инициации РНК-полимераза остается связанной с промотором и тянет вниз по течению ДНК в свою каталитическую щель, как бы сжимая движение. [19]
Побег промоутера [ править ]
Когда транскрипт достигает пороговой длины в десять нуклеотидов, он попадает в канал выхода РНК. [1] Полимераза нарушает свои взаимодействия с промоторными элементами и любыми регуляторными белками, связанными с комплексом инициации, которые ей больше не нужны. [20] Ускользание промотора у эукариот требует гидролиза АТФ и, в случае Pol II, фосфорилирования CTD. Между тем пузырек транскрипции схлопывается до 12-14 нуклеотидов, обеспечивая кинетическую энергию, необходимую для побега. [1]
Удлинение [ править ]
После выхода из промотора и высвобождения большинства факторов транскрипции для инициации полимераза приобретает новые факторы для следующей фазы транскрипции: элонгации. [21] [22] Удлинение транскрипции - это процессный процесс. Двухцепочечная ДНК, которая входит спереди фермента, расстегивается, чтобы использовать матричную цепь для синтеза РНК. Для каждой пары оснований ДНК, разделенных продвигающейся полимеразой, немедленно образуется одна гибридная пара оснований РНК: ДНК. Нити ДНК и возникающая цепь РНК выходят из отдельных каналов; две нити ДНК воссоединяются на заднем конце пузыря транскрипции, в то время как однониточная РНК появляется одна.
Факторы удлинения [ править ]
Среди белков, задействованных в полимеразе, есть факторы элонгации, называемые так потому, что они стимулируют удлинение транскрипции. [23] Существуют разные классы факторов удлинения. Некоторые факторы могут увеличить общую скорость транскрипции, некоторые могут помочь полимеразе через временные сайты паузы, а некоторые могут помочь полимеразе транскрибироваться через хроматин. [24] Один из факторов удлинения, P-TEFb , особенно важен. [25] P-TEFb фосфорилирует второй остаток (Ser-2) повторов CTD (YSPTSPS) связанного Pol II. P-TEFb также фосфорилирует и активирует SPT5 и TAT-SF1. SPT5 - универсальный фактор транскрипции, который помогает задействовать 5'-кэппингфермент Pol II с CTD, фосфорилированным по Ser-5. TAF-SF1 привлекает компоненты аппарата сплайсинга РНК к Ser-2-фосфорилированному CTD. P-TEFb также помогает подавить временную паузу полимеразы, когда она встречает определенные последовательности сразу после инициации. [25]
Точность транскрипции [ править ]
Точность транскрипции достигается за счет нескольких механизмов. РНК-полимеразы выбирают правильный нуклеозидтрифосфатный субстрат (NTP) для предотвращения ошибок транскрипции. Только NTP, который правильно спаривает основание с кодирующим основанием в ДНК, допущен к активному центру. [26] [27] РНК-полимераза выполняет две известные функции проверочного считывания для обнаружения и удаления неправильно включенных нуклеотидов: пирофосфорилитическое редактирование и гидролитическое редактирование. [1] Первый удаляет неправильно вставленный рибонуклеотид путем простого обращения реакции полимеризации, в то время как второй включает обратное отслеживание полимеразы и отщепление сегмента РНК-продукта, содержащего ошибку. Коэффициент удлинения TFIIS ( InterPro : IPR006289; TCEA1 , TCEA2 , TCEA3 ) стимулирует присущую полимеразе рибонуклеазную активность, позволяя удалять неправильно включенные основания за счет ограниченной локальной деградации РНК. [28] Обратите внимание, что все реакции (синтез фосфодиэфирной связи, пирофосфоролиз, гидролиз фосфодиэфирной связи) осуществляются РНК-полимеразой с использованием одного активного центра. [29]
Пауза, балансировка и возврат [ править ]
Элонгация транскрипции - это не плавный путь вдоль двухцепочечной ДНК, поскольку РНК-полимераза претерпевает обширную котранскрипционную паузу во время элонгации транскрипции. [30] [31] Как правило, РНК-полимераза II не транскрибируется через ген с постоянной скоростью. Скорее он периодически приостанавливается на определенных последовательностях, иногда на длительные периоды времени, прежде чем возобновить транскрипцию. [32] Эта пауза особенно выражена в нуклеосомах и частично возникает из-за того, что полимераза входит в транскрипционно некомпетентное состояние обратного отслеживания. [30] Продолжительность этих пауз колеблется от секунд до минут или дольше, и выходу из долгоживущих пауз могут способствовать факторы удлинения, такие как TFIIS. [33]
Эта пауза также иногда используется для корректуры; здесь полимераза копирует, стирает часть уже созданной РНК и делает еще один шаг по транскрипции. [1] В крайних случаях, например, когда полимераза встречает поврежденный нуклеотид, она полностью останавливается. Чаще удлиняющаяся полимераза останавливается возле промотора. [32] Пауза в проксимальном направлении к промотору во время ранней элонгации является обычно используемым механизмом для регуляции генов, готовых к быстрой или скоординированной экспрессии. Пауза опосредуется комплексом, называемым NELF (отрицательный фактор удлинения), в сотрудничестве с DSIF (фактор, вызывающий чувствительность к DRB, содержащий SPT4 / SPT5). [34]Блокировка снимается, как только полимераза получает сигнал активации, такой как фосфорилирование Ser-2 хвоста CTD с помощью P-TEFb. Другие факторы удлинения, такие как ELL и TFIIS, стимулируют скорость удлинения, ограничивая продолжительность паузы полимеразы. [1]
Обработка РНК [ править ]
Удлиняющая полимераза связана с набором белковых факторов, необходимых для различных типов процессинга РНК. [1] мРНК кэпируется, как только выходит из канала выхода РНК полимеразы. После кэппинга дефосфорилирование Ser-5 в CTD-повторах может быть ответственным за диссоциацию кэппингового аппарата. Дальнейшее фосфорилирование Ser-2 вызывает задействование аппарата сплайсинга РНК, который катализирует удаление некодирующих интронов с образованием зрелой мРНК. [1] Альтернативный сплайсинг расширяет белковые комплементы у эукариот. Так же, как с 5'-кэппингом и сплайсингом, хвост CTD участвует в рекрутировании ферментов, ответственных за 3'-полиаденилирование , последнее событие процессинга РНК, которое связано с прекращением транскрипции.[1]
Прекращение действия [ править ]
Последней стадией транскрипции является терминация, которая приводит к диссоциации полного транскрипта и высвобождению РНК-полимеразы из матричной ДНК. Процесс отличается для каждой из трех РНК-полимераз. [35] Механизм терминации является наименее понятным из трех стадий транскрипции.
Фактор-зависимый [ править ]
Прекращение транскрипции генов пре-рРНК полимеразой Pol I осуществляется системой, которой необходим специфический фактор терминации транскрипции. [3] Используемый механизм имеет некоторое сходство с rho-зависимой терминацией у прокариот. [36] Эукариотические клетки содержат сотни повторов рибосомной ДНК, иногда распределенных по нескольким хромосомам. Терминация транскрипции происходит в рибосомной межгенной спейсерной области, которая содержит несколько сайтов терминации транскрипции перед сайтом паузы Pol I. По еще неизвестному механизму 3'-конец транскрипта расщепляется, образуя большую первичную молекулу рРНК, которая далее процессируется в зрелые 18S, 5.8S и 28S рРНК.
Когда Pol II достигает конца гена, два белковых комплекса, переносимые CTD, CPSF (фактор специфичности расщепления и полиаденилирования) и CSTF (фактор стимуляции расщепления), распознают сигнал поли-A в транскрибируемой РНК. [35] CPSF и CSTF, связанные с поли-А, привлекают другие белки для выполнения расщепления РНК, а затем полиаденилирования. Поли-А-полимераза добавляет примерно 200 аденинов к расщепленному 3'-концу РНК без матрицы. [35] Длинный поли-A-хвост уникален для транскриптов, созданных Pol II.
В процессе прекращения транскрипции с помощью Pol I и Pol II комплекс элонгации не растворяется сразу после расщепления РНК. Полимераза продолжает двигаться по матрице, генерируя вторую молекулу РНК, связанную с комплексом элонгации. [1] Были предложены две модели, чтобы объяснить, как наконец достигается прекращение действия. [35] Аллостерическая модель утверждает, что когда транскрипция происходит через последовательность терминации, она вызывает разборку факторов элонгации и / или сборку факторов терминации, которые вызывают конформационные изменения комплекса элонгации. [36] [37] Модель торпеды предполагает, что экзонуклеаза размером от 5 'до 3'деградирует вторую РНК по мере ее выхода из комплекса элонгации. Полимераза высвобождается по мере того, как высоко процессивная экзонуклеаза догоняет ее. Предлагается, что новая точка зрения будет выражать слияние этих двух моделей. [37]
Факторно-независимый [ править ]
РНК-полимераза III может эффективно прекращать транскрипцию без участия дополнительных факторов. Сигнал терминации Pol III состоит из отрезка тиминов (на неэлементной цепи), расположенного в пределах 40 п.н. ниже 3'-конца зрелой РНК. [35] Сигнал завершения poly-T приостанавливает Pol III.
Контроль транскрипции эукариот [ править ]
Регуляции экспрессии генов у эукариот достигаются за счетом взаимодействия нескольких уровней управления , который действует как локально , так, чтобы включить или выключить отдельные гены в ответ на специфическую клеточные потребности и на глобальном уровне, чтобы поддерживать хроматин масштаба паттерна экспрессии генов , которые формируют идентичность клеток . [1] [38] Поскольку эукариотический геном обернут вокруг гистонов с образованием нуклеосом и структур хроматина более высокого порядка, субстраты для транскрипционного аппарата, как правило, частично скрыты. [1]Без регуляторных белков многие гены экспрессируются на низком уровне или не экспрессируются вообще. Транскрипция требует смещения позиционированных нуклеосом, чтобы позволить транскрипционному аппарату получить доступ к ДНК. [39]
Все этапы транскрипции в определенной степени регулируются. [1] Инициация транскрипции, в частности, является первичным уровнем, на котором регулируется экспрессия генов. Ориентация на начальный этап, ограничивающий скорость, является наиболее эффективным с точки зрения затрат на энергию для ячейки. Инициация транскрипции регулируется цис-действующими элементами ( энхансерами , сайленсерами , изоляторами) в регуляторных областях ДНК и специфичными для последовательности транс-действующими факторами, которые действуют как активаторы или репрессоры. [1] Транскрипция генов также может регулироваться после инициации путем нацеливания на движение удлиняющейся полимеразы. [40]
Глобальный контроль и эпигенетическая регуляция [ править ]
Геном эукариот организован в компактную структуру хроматина, которая обеспечивает только регулируемый доступ к ДНК. Структура хроматина может быть глобально «открытой» и более транскрипционно пермиссивной или глобально «конденсированной» и транскрипционно неактивной. Первый ( эухроматин ) слегка упакован и богат генами при активной транскрипции. Последний ( гетерохроматин ) включает бедные генами области, такие как теломеры и центромеры, но также области с нормальной плотностью генов, но транскрипционно заглушенные. Транскрипцию можно заглушить модификацией гистонов ( деацетилированием и метилированием ), интерференцией РНК и / илиМетилирование ДНК . [41]
Паттерны экспрессии генов, определяющие идентичность клеток, наследуются через деление клеток. [1] Этот процесс называется эпигенетической регуляцией . Метилирование ДНК надежно наследуется за счет действия поддерживающих метилаз, которые модифицируют зарождающуюся цепь ДНК, генерируемую репликацией. [1] В клетках млекопитающих метилирование ДНК является основным маркером транскрипционно подавленных областей. Специализированные белки могут распознавать маркер и привлекать гистоновые деацетилазы и метилазы для восстановления молчания. Модификации гистонов нуклеосом также могут быть унаследованы во время деления клеток, однако неясно, может ли это работать независимо без направления метилирования ДНК. [1]
Активация гена [ править ]
Две основные задачи инициации транскрипции - предоставить РНК-полимеразе доступ к промотору и собрать общие факторы транскрипции с полимеразой в комплекс инициации транскрипции. Были идентифицированы разнообразные механизмы инициации транскрипции за счет подавления тормозных сигналов на промоторе гена. [1] Эукариотические гены приобрели обширные регуляторные последовательности, которые охватывают большое количество сайтов связывания с регуляторами и распространяют общие килобазы (иногда сотни килобаз) от промотора - как вверх, так и вниз по течению. [1] Сайты связывания регуляторов часто объединяются в единицы, называемые энхансерами. Энхансеры могут способствовать высоко-кооперативному действию нескольких факторов транскрипции (которые составляют энхансомы). Удаленные энхансеры позволяют регулировать транскрипцию на расстоянии. Инсуляторы, расположенные между энхансерами и промоторами, помогают определить гены, на которые энхансер может или не может влиять.
У эукариотических активаторов транскрипции есть отдельные ДНК-связывающие и активирующие функции. [1] Связываясь со своим цис-элементом, активатор может напрямую рекрутировать полимеразу или рекрутировать другие факторы, необходимые для транскрипционного аппарата. Активатор также может привлекать модификаторы нуклеосом, которые изменяют хроматин в непосредственной близости от промотора и тем самым способствуют инициации. Множественные активаторы могут работать вместе, либо задействуя общий или два взаимозависимых компонента транскрипционного аппарата, либо помогая друг другу связываться со своими участками ДНК. [1] Эти взаимодействия могут синергизировать множественные входные сигналы и производить сложные транскрипционные ответы для удовлетворения клеточных потребностей.
Репрессия, специфичная для генов [ править ]
Репрессоры транскрипции эукариот имеют общие механизмы, используемые их прокариотическими аналогами. Например, связываясь с сайтом на ДНК, который перекрывается с сайтом связывания активатора, репрессор может ингибировать связывание активатора. Но чаще репрессоры эукариот подавляют функцию активатора, маскируя его активирующий домен, предотвращая его ядерную локализацию, способствуя его деградации или инактивируя его посредством химических модификаций. [1] Репрессоры могут напрямую ингибировать инициацию транскрипции, связываясь с сайтом выше промотора и взаимодействуя с аппаратом транскрипции. Репрессоры могут косвенно подавлять транскрипцию путем привлечения модификаторов гистонов (деацетилазы и метилазы) или ферментов ремоделирования нуклеосом, которые влияют на доступность ДНК.[1] Репрессия гистонов и модификаций ДНК также является основой подавления транскрипции, которое может распространяться по хроматину и выключать несколько генов. [42]
Контроль удлинения и прекращения [ править ]
Фаза удлинения начинается после завершения сборки комплекса удлинения и продолжается до тех пор, пока не встретится последовательность завершения. [1] Пост-инициация движения РНК-полимеразы является мишенью другого класса важных регуляторных механизмов. Например, активатор транскрипции Tat влияет на удлинение, а не на инициацию во время регуляции транскрипции ВИЧ . [43] Фактически, многие эукариотические гены регулируются путем высвобождения блока для удлинения транскрипции, называемого промотор-проксимальной паузой. [44]Пауза может влиять на структуру хроматина на промоторах, чтобы способствовать активности генов и приводить к быстрым или синхронным ответам транскрипции, когда клетки подвергаются воздействию сигнала активации. [32] Пауза связана со связыванием двух отрицательных факторов элонгации, DSIF (SPT4 / SPT5) и NELF, с комплексом элонгации. Другие факторы также могут влиять на стабильность и продолжительность приостановленной полимеразы. [45] Пауза высвобождения запускается рекрутированием киназы P-TEFb. [40]
Терминация транскрипции также стала важной областью регуляции транскрипции. Прекращение действия связано с эффективным повторным использованием полимеразы. [46] Факторы, связанные с терминацией транскрипции, также могут опосредовать образование петель гена и тем самым определять эффективность повторной инициации.
Реставрация ДНК, связанная с транскрипцией [ править ]
Когда транскрипция останавливается из-за наличия повреждения в транскрибируемой цепи гена, белки репарации ДНК привлекаются к остановившейся РНК-полимеразе, чтобы инициировать процесс, называемый репарацией, связанной с транскрипцией. [47] Центральным в этом процессе является общий фактор транскрипции TFIIH, который обладает АТФазной активностью. TFIIH вызывает конформационное изменение полимеразы, обнажая захваченный внутри пузырек транскрипции, чтобы ферменты репарации ДНК получили доступ к поражению. [48] Таким образом, РНК-полимераза служит в клетке как белок, чувствительный к повреждению, и направляет ферменты репарации на гены, которые активно транскрибируются.
Сравнение прокариотической и эукариотической транскрипции [ править ]
Транскрипция эукариот более сложна, чем транскрипция прокариот . Например, у эукариот генетический материал (ДНК) и, следовательно, транскрипция, в первую очередь локализованы в ядре, где он отделен от цитоплазмы (в которой происходит трансляция) ядерной мембраной. Это обеспечивает временную регуляцию экспрессии генов за счет секвестрации РНК в ядре и позволяет избирательно переносить зрелые РНК в цитоплазму. Бактерии не имеют отдельного ядра, которое отделяет ДНК от рибосомы, и мРНК транслируется в белок, как только она транскрибируется. Связь между двумя процессами обеспечивает важный механизм регуляции прокариотических генов. [1]
На уровне инициации РНК-полимераза у прокариот (в частности, бактерий) прочно связывается с промоторной областью и инициирует высокую базальную скорость транскрипции. Гидролиз АТФ не требуется для перехода от близкого к открытому, плавление промотора происходит за счет реакций связывания, которые благоприятствуют расплавленной конформации. Хроматин сильно затрудняет транскрипцию у эукариот. Сборка большого мультибелкового преинициативного комплекса необходима для промотор-специфической инициации. У эукариот плавление промотора требует гидролиза АТФ. В результате эукариотические РНК-полимеразы демонстрируют низкую базальную скорость инициации транскрипции. [42]
Регулирование транскрипции при раке [ править ]
У позвоночных большинство промоторов генов содержат островок CpG с многочисленными сайтами CpG . [49] Когда многие промоторные сайты CpG гена метилированы, ген заглушается. [50] Колоректальный рак обычно имеет от 3 до 6 мутаций водителя и от 33 до 66 мутаций автостопщика или пассажира. [51] Однако подавление транскрипции может иметь большее значение, чем мутации, в развитии рака. Например, при колоректальном раке от 600 до 800 генов транскрипционно подавляются метилированием CpG-островков (см. Регуляцию транскрипции при раке).). Репрессия транскрипции при раке также может происходить за счет других эпигенетических механизмов, таких как измененная экспрессия микроРНК . [52] При раке груди репрессия транскрипции BRCA1 может происходить чаще за счет чрезмерной экспрессии микроРНК-182, чем за счет гиперметилирования промотора BRCA1 (см. Низкая экспрессия BRCA1 при раке груди и яичников ).
См. Также [ править ]
- Бактериальная транскрипция
- Регулирование экспрессии генов
- РНК-полимераза
- Транскрипционная регуляция
- Фактор транскрипции
- Транскрипционная память
Ссылки [ править ]
- ^ Б с д е е г ч я J к л м п о р Q R сек т у V ш х у г аа аЬ ас объявления аи аф ага ах д.в. Уотсон Дж, Бейкер Т.А., Белл С.П., Ганна А, Левин М , Лосик Р., Харрисон СК (2014). Молекулярная биология гена (7-е изд.). Издательство Бенджамин-Каммингс. ISBN 978-0-321-76243-6.
- ^ a b Mattick JS (ноябрь 2001 г.). «Некодирующие РНК: архитекторы эукариотической сложности» . EMBO Reports . 2 (11): 986–91. DOI : 10.1093 / embo-reports / kve230 . PMC 1084129 . PMID 11713189 .
- ^ a b c d Lodish H, Berk A, Kaiser CA, Krieger M, Bretscher A, Ploegh H, Amon A, Scott MP (2012-05-02). Молекулярная клеточная биология (7-е изд.). Нью-Йорк: ISBN WH Freeman and Co. 9781429234139.
- ^ a b c Крамер П., Армаш К. Дж., Баумли С., Бенкерт С., Брюкнер Ф, Бухен С., Дамсма Г. Е., Денгл С., Гейгер С. Р., Ясиак А. Дж., Джавари А., Йеннебах С., Каменски Т., Кеттенбергер Н., Кун С. Д., Леманн E, Leike K, Sydow JF, Vannini A (2008). «Структура эукариотических РНК-полимераз». Ежегодный обзор биофизики . 37 : 337–52. DOI : 10.1146 / annurev.biophys.37.032807.130008 . hdl : 11858 / 00-001M-0000-0015-7BF0-E . PMID 18573085 . S2CID 8818814 .
- ^ Sirri В, Urcuqui-Inchima S, Руссель Р, Hernandez-Вердун D (январь 2008 г.). «Ядрышко: завораживающее ядерное тело» . Гистохимия и клеточная биология . 129 (1): 13–31. DOI : 10.1007 / s00418-007-0359-6 . PMC 2137947 . PMID 18046571 .
- ^ Fromont-Расин M, Зенгер B, C Saveanu, Fasiolo F (август 2003). «Сборка рибосом у эукариот». Джин . 313 : 17–42. DOI : 10.1016 / S0378-1119 (03) 00629-2 . PMID 12957375 .
- ^ Dieci G, Fiorino G, Кастельнуово M, Teichmann M, Пагано A (декабрь 2007). «Расширяющийся транскриптом РНК-полимеразы III». Тенденции в генетике . 23 (12): 614–22. DOI : 10.1016 / j.tig.2007.09.001 . PMID 17977614 .
- ^ a b Картер Р., Друин Г. (май 2010 г.). «Увеличение количества субъединиц в эукариотической РНК-полимеразе III по сравнению с РНК-полимеразой II связано с постоянным привлечением общих факторов транскрипции» . Молекулярная биология и эволюция . 27 (5): 1035–43. DOI : 10.1093 / molbev / msp316 . PMID 20026480 .
- ^ Фернандес-Торнеро С, Морено-Морсильо М, Рашид UJ, Тейлор Н.М., Руис FM, Gruene Т, Р Legrand, Steuerwald U, Мюллер CW (октябрь 2013 г. ). «Кристаллическая структура 14-субъединичной РНК-полимеразы I». Природа . 502 (7473): 644–9. Bibcode : 2013Natur.502..644F . DOI : 10,1038 / природа12636 . PMID 24153184 . S2CID 205235881 .
- Перейти ↑ Cramer P, Bushnell DA, Kornberg RD (июнь 2001 г.). «Структурная основа транскрипции: РНК-полимераза II с разрешением 2,8 ангстрем» (PDF) . Наука . 292 (5523): 1863–76. DOI : 10.1126 / science.1059493 . hdl : 11858 / 00-001M-0000-0015-8729-F . PMID 11313498 . S2CID 4993438 .
- ^ a b Corden JL (ноябрь 2013 г.). «С-концевой домен РНК-полимеразы II: привязка транскрипции к транскрипту и матрице» . Химические обзоры . 113 (11): 8423–55. DOI : 10.1021 / cr400158h . PMC 3988834 . PMID 24040939 .
- ^ Butler JE, Kadonaga JT (октябрь 2002). «Основной промотор РНК-полимеразы II: ключевой компонент в регуляции экспрессии генов» . Гены и развитие . 16 (20): 2583–92. DOI : 10,1101 / gad.1026202 . PMID 12381658 .
- ^ Lenhard B, Sandelin A, Carninci P (март 2012). «Промоторы Metazoan: новые характеристики и понимание регуляции транскрипции» . Обзоры природы. Генетика . 13 (4): 233–45. DOI : 10.1038 / nrg3163 . PMID 22392219 . S2CID 39948639 .
- ^ Orphanides G, Т Лагранжа, Reinberg D (ноябрь 1996 года). «Общие факторы транскрипции РНК-полимеразы II» . Гены и развитие . 10 (21): 2657–83. DOI : 10,1101 / gad.10.21.2657 . PMID 8946909 .
- ↑ Roeder RG (сентябрь 1996 г.). «Роль общих факторов инициации в транскрипции РНК-полимеразой II». Направления биохимических наук . 21 (9): 327–35. DOI : 10.1016 / S0968-0004 (96) 10050-5 . PMID 8870495 .
- ^ Он Y, Fang J, Taatjes DJ, Ногалс E (март 2013). «Структурная визуализация ключевых этапов инициации транскрипции человека» . Природа . 495 (7442): 481–6. Bibcode : 2013Natur.495..481H . DOI : 10.1038 / nature11991 . PMC 3612373 . PMID 23446344 .
- ^ a b Holstege FC, Fiedler U, Timmers HT (декабрь 1997 г.). «Три перехода в транскрипционном комплексе РНК-полимеразы II во время инициации» . Журнал EMBO . 16 (24): 7468–80. DOI : 10.1093 / emboj / 16.24.7468 . PMC 1170346 . PMID 9405375 .
- ^ Svejstrup JQ, Vichi P, Egly JM (сентябрь 1996). «Множественные роли фактора транскрипции / репарации TFIIH». Направления биохимических наук . 21 (9): 346–50. DOI : 10.1016 / S0968-0004 (96) 10046-3 . PMID 8870499 .
- ^ a b Ревякин А., Лю С., Эбрайт Р. Х., Стрик Т. Р. (ноябрь 2006 г.). «Прерывистая инициация и продуктивная инициация с помощью РНК-полимеразы включают сжатие ДНК» . Наука . 314 (5802): 1139–43. Bibcode : 2006Sci ... 314.1139R . DOI : 10.1126 / science.1131398 . PMC 2754787 . PMID 17110577 .
- ^ Dvir A (сентябрь 2002). «Ускользание промотора с помощью РНК-полимеразы II». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена . 1577 (2): 208–223. DOI : 10.1016 / S0167-4781 (02) 00453-0 . PMID 12213653 .
- ^ Похолок DK, Hannett Н.М., Young RA (апрель 2002). «Обмен факторов инициации и удлинения РНК-полимеразы II во время экспрессии генов in vivo». Молекулярная клетка . 9 (4): 799–809. DOI : 10.1016 / S1097-2765 (02) 00502-6 . PMID 11983171 .
- ^ Wade JT, Struhl K (апрель 2008). «Переход от инициации транскрипции к удлинению» . Текущее мнение в области генетики и развития . 18 (2): 130–6. DOI : 10.1016 / j.gde.2007.12.008 . PMC 2563432 . PMID 18282700 .
- Перейти ↑ Saunders A, Core LJ, Lis JT (август 2006). «Устранение барьеров на пути удлинения транскрипции». Обзоры природы. Молекулярная клеточная биология . 7 (8): 557–67. DOI : 10.1038 / nrm1981 . PMID 16936696 . S2CID 29242830 .
- Перейти ↑ Arndt KM, Kane CM (октябрь 2003 г.). «Запуск с РНК-полимеразой: удлинение транскрипта эукариот». Тенденции в генетике . 19 (10): 543–50. DOI : 10.1016 / j.tig.2003.08.008 . PMID 14550628 .
- ^ a b Brès V, Yoh SM, Jones KA (июнь 2008 г.). «Многозадачный комплекс П-ТЭФб» . Текущее мнение в клеточной биологии . 20 (3): 334–40. DOI : 10.1016 / j.ceb.2008.04.008 . PMC 2628440 . PMID 18513937 .
- ^ Уэстовер KD, Bushnell DA, Корнберг RD (ноябрь 2004). «Структурные основы транскрипции: отбор нуклеотидов вращением в активном центре РНК-полимеразы II». Cell . 119 (4): 481–9. DOI : 10.1016 / j.cell.2004.10.016 . PMID 15537538 . S2CID 11068662 .
- Перейти ↑ Wang D, Bushnell DA, Westover KD, Kaplan CD, Kornberg RD (декабрь 2006 г.). «Структурные основы транскрипции: роль триггерной петли в субстратной специфичности и катализе» . Cell . 127 (5): 941–54. DOI : 10.1016 / j.cell.2006.11.023 . PMC 1876690 . PMID 17129781 .
- ^ Ван Д., Бушнелл Д.А., Хуанг Х, Вестовер К.Д., Левитт М., Корнберг Р.Д. (май 2009 г.). «Структурная основа транскрипции: обратная РНК-полимераза II с разрешением 3,4 ангстрем» . Наука . 324 (5931): 1203–6. Bibcode : 2009Sci ... 324.1203W . DOI : 10.1126 / science.1168729 . PMC 2718261 . PMID 19478184 .
- ^ Сосунов В, Сосунова Э, Мустаев А, Бас I, Никифоров В, Гольдфарб А (май 2003 г.). «Единый двухметаллический механизм синтеза и деградации РНК РНК-полимеразой» . Журнал EMBO . 22 (9): 2234–44. DOI : 10,1093 / emboj / cdg193 . PMC 156065 . PMID 12727889 .
- ^ a b Ходжес, Кортни; Бинту, Лакрамиоара; Лубковская, Люцина; Кашлев Михаил; Бустаманте, Карлос (31.07.2009). «Нуклеосомные колебания определяют динамику транскрипции РНК-полимеразы II» . Наука . 325 (5940): 626–628. Bibcode : 2009Sci ... 325..626H . DOI : 10.1126 / science.1172926 . ISSN 1095-9203 . PMC 2775800 . PMID 19644123 .
- ^ Черчман, Л. Стирлинг; Вайсман, Джонатан С. (20 января 2011 г.). «Секвенирование зарождающегося транскрипта визуализирует транскрипцию при разрешении нуклеотидов» . Природа . 469 (7330): 368–373. Bibcode : 2011Natur.469..368C . DOI : 10,1038 / природа09652 . ISSN 1476-4687 . PMC 3880149 . PMID 21248844 .
- ^ a b c Адельман К., Лис Дж. Т. (октябрь 2012 г.). «Промотор-проксимальная пауза РНК-полимеразы II: новые роли у многоклеточных животных» . Обзоры природы. Генетика . 13 (10): 720–31. DOI : 10.1038 / nrg3293 . PMC 3552498 . PMID 22986266 .
- ^ Galburt, Эрик A .; Гриль, Стефан В .; Видманн, Анна; Лубковская, Люцина; Чой, Джейсон; Ногалес, Ева; Кашлев Михаил; Бустаманте, Карлос (2007-04-12). «Обратное отслеживание определяет силовую чувствительность RNAP II в зависимости от факторов». Природа . 446 (7137): 820–823. Bibcode : 2007Natur.446..820G . DOI : 10,1038 / природа05701 . ISSN 1476-4687 . PMID 17361130 . S2CID 4310108 .
- ^ Missra A, Гилмор DS (июнь 2010). «Взаимодействие между DSIF (фактор, вызывающий чувствительность DRB), NELF (отрицательный фактор элонгации) и комплексом элонгации транскрипции РНК-полимеразы II дрозофилы» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (25): 11301–6. Bibcode : 2010PNAS..10711301M . DOI : 10.1073 / pnas.1000681107 . PMC 2895096 . PMID 20534440 .
- ^ а б в г д Ричард П., Мэнли Дж. Л. (июнь 2009 г.). «Прерывание транскрипции ядерными РНК-полимеразами» . Гены и развитие . 23 (11): 1247–69. DOI : 10,1101 / gad.1792809 . PMC 2763537 . PMID 19487567 .
- ^ a b Clancey S (2008). «Транскрипция ДНК» . Природное образование . 1 (41) . Проверено 27 ноября 2013 года .
- ^ a b Розонина Е., Канеко С., Мэнли Дж. Л. (май 2006 г.). «Прерывание стенограммы: расстаться тяжело» . Гены и развитие . 20 (9): 1050–6. DOI : 10,1101 / gad.1431606 . PMID 16651651 .
- ^ Shandilya J, Roberts SG (май 2012). «Цикл транскрипции в эукариотах: от продуктивной инициации до рециклинга РНК-полимеразы II». Biochimica et Biophysica Acta (BBA) - механизмы регуляции генов . 1819 (5): 391–400. DOI : 10.1016 / j.bbagrm.2012.01.010 . PMID 22306664 .
- ^ Кулаева О. И., Gaykalova Д.А., Студитский В.М. (май 2007). «Транскрипция через хроматин с помощью РНК-полимеразы II: замещение и обмен гистонов» . Мутационные исследования . 618 (1-2): 116-29. DOI : 10.1016 / j.mrfmmm.2006.05.040 . PMC 1924643 . PMID 17313961 .
- ^ a b Петерлин Б.М., Price DH (август 2006 г.). «Контроль фазы элонгации транскрипции с помощью P-TEFb». Молекулярная клетка . 23 (3): 297–305. DOI : 10.1016 / j.molcel.2006.06.014 . PMID 16885020 .
- ↑ Bannister AJ, Kouzarides T (март 2011 г.). «Регуляция хроматина модификациями гистонов» . Клеточные исследования . 21 (3): 381–95. DOI : 10.1038 / cr.2011.22 . PMC 3193420 . PMID 21321607 .
- ^ а б Браун Т.А. (2002). Геномы . Нью-Йорк: Вили-Лисс. ISBN 978-0-471-25046-3.
- ^ Као SY, Кальман А.Ф., Луцив П.А., Peterlin BM (3 декабря 1987). «Анти-терминация транскрипции в длинном концевом повторе ВИЧ-1 с помощью продукта гена tat». Природа . 330 (6147): 489–93. Bibcode : 1987Natur.330..489K . DOI : 10.1038 / 330489a0 . PMID 2825027 . S2CID 4311235 .
- Перейти ↑ Lis J (1998). «Промотор-ассоциированная пауза в архитектуре промотора и постинициационной регуляции транскрипции». Симпозиумы Колд-Спринг-Харбор по количественной биологии . 63 : 347–56. DOI : 10.1101 / sqb.1998.63.347 . PMID 10384299 .
- ↑ Cheng B, Li T, Rahl PB, Adamson TE, Loudas NB, Guo J, Varzavand K, Cooper JJ, Hu X, Gnatt A, Young RA, Price DH (январь 2012 г.). «Функциональная ассоциация Gdown1 с РНК-полимеразой II на генах человека» . Молекулярная клетка . 45 (1): 38–50. DOI : 10.1016 / j.molcel.2011.10.022 . PMC 3259526 . PMID 22244331 .
- ^ Feige MJ, Хендершот LM (апрель 2011). «Дисульфидные связи в сворачивании белка ER и гомеостазе» . Текущее мнение в клеточной биологии . 23 (2): 167–75. DOI : 10.1016 / j.ceb.2010.10.012 . PMC 3078216 . PMID 21144725 .
- ^ Mellon I, Спивак G, Hanawalt PC (октябрь 1987). «Селективное удаление повреждений ДНК, блокирующих транскрипцию, с транскрибируемой цепи гена DHFR млекопитающих». Cell . 51 (2): 241–9. DOI : 10.1016 / 0092-8674 (87) 90151-6 . PMID 3664636 . S2CID 2879958 .
- ^ Саркер АГ, Tsutakawa SE, Костек S, Нг С, Шин DS, Перис М, Е Кампо, Tainer JA, Ногалс Е, Купер ПК (октябрь 2005 г.). «Распознавание РНК-полимеразы II и пузырей транскрипции с помощью XPG, CSB и TFIIH: понимание транскрипционно-связанной репарации и синдрома Кокейна». Молекулярная клетка . 20 (2): 187–98. DOI : 10.1016 / j.molcel.2005.09.022 . PMID 16246722 .
- ^ Saxonov S, P Berg, Brutlag DL (январь 2006). «Полногеномный анализ динуклеотидов CpG в геноме человека позволяет выделить два различных класса промоторов» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (5): 1412–7. Bibcode : 2006PNAS..103.1412S . DOI : 10.1073 / pnas.0510310103 . PMC 1345710 . PMID 16432200 .
- ↑ Bird A (январь 2002 г.). «Паттерны метилирования ДНК и эпигенетическая память» . Гены и развитие . 16 (1): 6–21. DOI : 10,1101 / gad.947102 . PMID 11782440 .
- ^ Фогельштейна B, Пападопулос N, Velculescu В.Е., Чжоу S, Диас LA, Кинзлер KW (март 2013 г. ). «Пейзажи генома рака» . Наука . 339 (6127): 1546–58. Bibcode : 2013Sci ... 339.1546V . DOI : 10.1126 / science.1235122 . PMC 3749880 . PMID 23539594 .
- ^ Tessitore А, Cicciarelli О Дель Веккио Ж, Гаджано А, Verzella Д, Fischietti М, Vecchiotti Д, Capece Д, Zazzeroni Ж, Alesse Е (2014). «МикроРНК в сети повреждения / восстановления ДНК и рака» . Международный журнал геномики . 2014 : 820248. дои : 10,1155 / 2014/820248 . PMC 3926391 . PMID 24616890 .