| Гамма-секретаза | ||||||||
|---|---|---|---|---|---|---|---|---|
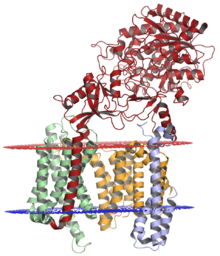 Комплекс гамма-секретазы с никастрином (красный), пресенилином-1 (оранжевый), PEN-2 (синий) и APH-1 (зеленый); просветная мембрана показана красным цветом, а цитоплазматическая мембрана - синим. Структура решена методом криоэлектронной микроскопии . [1] | ||||||||
| Идентификаторы | ||||||||
| Символ | Гамма-секретаза | |||||||
| Pfam | PF05450 | |||||||
| ИнтерПро | IPR008710 | |||||||
| OPM суперсемейство | 244 | |||||||
| Белок OPM | [5fn5 [ | |||||||
| Мембранома | 155 | |||||||
| ||||||||
Гамма-секретаза представляет собой комплекс протеаз из нескольких субъединиц , который сам является интегральным мембранным белком , который расщепляет однопроходные трансмембранные белки по остаткам в трансмембранном домене. Протеазы этого типа известны как внутримембранные протеазы . Самым известным субстратом гамма-секретазы является белок-предшественник амилоида , большой интегральный мембранный белок, который при расщеплении как гамма-, так и бета-секретазой производит короткий 37-43 ( требуется проверка ) аминокислотный пептид, называемый бета-амилоидом , который аномально свернут.фибриллярная форма является основным компонентом амилоидных бляшек, обнаруживаемых в головном мозге пациентов с болезнью Альцгеймера . Гамма-секретаза также имеет решающее значение в связанном процессинге некоторых других интегральных мембранных белков типа I, таких как Notch , [2] ErbB4 , [3] E-кадгерин , [4] N-кадгерин , [5] эфрин-B2 , [6] ] или CD44 . [7]
Подразделения и сборки [ править ]
Гамма-секретазный комплекс состоит из четырех отдельных белков: PSEN1 (пресенилин-1), [8] никастрин , APH-1 (передний дефект глотки 1) и PEN-2 (усилитель пресенилина 2). [9] Недавние данные свидетельствуют о том, что пятый белок, известный как CD147 , является второстепенным регулятором комплекса, отсутствие которого увеличивает активность. [10] [11] Пресенилин , аспартилпротеаза , является каталитической субъединицей; Мутации в гене пресенилина являются основным генетическим фактором риска болезни Альцгеймера [12].и модулирует активность иммунных клеток. [13] В геноме человека были идентифицированы две формы пресенилина и две формы APH-1 ; один из гомологов APH может также экспрессироваться в двух изоформах посредством альтернативного сплайсинга , что приводит по крайней мере к шести различным возможным комплексам гамма-секретазы, которые могут обладать тканевой или клеточной специфичностью. [14]
Белки в комплексе гамма-секретазы сильно модифицируются протеолизом во время сборки и созревания комплекса; необходимая стадия активации заключается в автокаталитическом расщеплении пресенилина на N- и C-концевые фрагменты. Основная роль никастрина заключается в поддержании стабильности собранного комплекса и регулировании внутриклеточного перемещения белков. [15] PEN-2 связывается с комплексом посредством связывания трансмембранного домена пресенилина [16] и, среди других возможных ролей, помогает стабилизировать комплекс после того, как протеолиз пресенилина генерирует активированные N-концевые и C-концевые фрагменты. [17]APH-1, который необходим для протеолитической активности, связывается с комплексом через консервативный мотив взаимодействия с альфа-спиралью и помогает инициировать сборку преждевременных компонентов. [18]
Недавние исследования показали, что взаимодействие комплекса гамма-секретазы с белком, активирующим γ-секретазу, облегчает гамма-расщепление белка-предшественника амилоида на β-амилоид . [19]
Сотовый трафик [ править ]
Считается, что комплекс гамма-секретазы собирается и созревает посредством протеолиза в раннем эндоплазматическом ретикулуме . [20] Комплексы затем транспортируются в поздний ER, где они взаимодействуют и расщепляют свои субстратные белки. [21] Комплексы гамма-секретазы также были обнаружены в митохондриях , где они могут играть роль в развитии апоптоза . [22]
Функция [ править ]
Гамма-секретаза - это внутренняя протеаза, которая расщепляет внутри мембранного домена свои субстратные белки, включая белок-предшественник амилоида (APP) и Notch . Субстрат распознавание происходит через никастрину эктодомна связывание с N-концом мишени, который затем передаются через плохо понимаемый процесс между двумя фрагментами пресенилина к воде отработанных активному сайта , где каталитический аспартат находится остаток. Активный центр должен содержать воду для проведения гидролиза в гидрофобной среде внутри клеточной мембраны., хотя не совсем понятно, как происходит обмен воды и протонов , и пока нет рентгеновской кристаллографии структуры гамма-секретазы. [23] Реконструкции с помощью электронной микроскопии низкого разрешения позволили визуализировать предполагаемые внутренние поры размером около 2 нанометров. [24] В 2014 году трехмерная структура интактного комплекса гамма-секретазы человека была определена с помощью одночастичного криоэлектронного микроскопического анализа с разрешением 4,5 ангстрем [25], а в 2015 году - криоанализа с атомным разрешением (3,4 ангстрем). Сообщается о структуре ЭМ. [1]
Комплекс гамма-секретазы необычен среди протеаз тем, что он имеет «неаккуратный» сайт расщепления на С-концевом сайте в генерации бета-амилоида ; гамма-секретаза может расщеплять АРР в любом из множества сайтов с образованием пептида переменной длины, чаще всего длиной от 39 до 42 аминокислот, причем Aβ40 является наиболее распространенной изоформой, а Aβ42 наиболее восприимчивым к конформационным изменениям, ведущим к фибриллогенезу амилоида . Определенные мутации в АРР и обоих типах пресенилина человека связаны с повышенной продукцией Aβ42 и ранним началом генетической формы семейной болезни Альцгеймера . [26]Хотя более старые данные предполагают, что разные формы комплекса гамма-секретазы могут по-разному отвечать за образование разных изоформ бета-амилоида, [27] текущие данные указывают на то, что С-конец бета-амилоида продуцируется серией расщеплений одного остатка одним и тем же гамма-секретазный комплекс. [28] [29] [30] Более ранние сайты расщепления производили пептиды длиной 46 (дзета-расщепление) и 49 (эпсилон-расщепление). [29]
См. Также [ править ]
- ДАПТ (химический) , ингибитор γ-секретазы
Ссылки [ править ]
- ^ а б Бай, Сяо-чен; Ян, Чуангье; Ян, Гуанхуэй; Лу, Пэйлонг; Ма, Дэн; Солнце, Линьфэн; Чжоу, Руи; Scheres, Sjors HW ; Ши, Игун (17 августа 2015 г.). «Атомная структура гамма-секретазы человека» . Природа . 525 (7568): 212–217. DOI : 10,1038 / природа14892 . PMC 4568306 . PMID 26280335 .
- ^ Де Строопер Б., Аннаерт В., Куперс П., Сафтиг П., Краессертс К., Мумм Дж. С., Шрётер Э. Х., Шрайверс В., Вулф М. С., Рэй В. Дж., Гоут А., Копан Р. (1999). «Пресенилин-1-зависимая гамма-секретаза-подобная протеаза опосредует высвобождение внутриклеточного домена Notch». Природа . 398 (6727): 518–22. DOI : 10,1038 / 19083 . PMID 10206645 .
- ^ Ni CY, Murphy MP, Golde TE, Карпентер G (2001). «Расщепление гамма-секретазой и ядерная локализация тирозинкиназы рецептора ErbB-4». Наука . 294 (5549): 2179–81. DOI : 10.1126 / science.1065412 . PMID 11679632 .
- ^ Марамбауд П., Шиои Дж., Сербан Г., Георгакопулос А., Сарнер С., Надь В., Баки Л., Вен П., Эфтимиопулос С., Шао З., Вишневски Т., Робакис Н. К. (2002). «Расщепление пресенилин-1 / гамма-секретазой высвобождает внутриклеточный домен E-кадгерина и регулирует разборку слипчивых соединений» . EMBO J . 21 (8): 1948–56. DOI : 10.1093 / emboj / 21.8.1948 . PMC 125968 . PMID 11953314 .
- ^ Marambaud Р, Вэнь PH, Датта А, Shioi Дж, Такашима А, Симан R, Robakis Н. К. (2003). «Связывающий CBP репрессор транскрипции, продуцируемый PS1 / эпсилон-расщеплением N-кадгерина, ингибируется мутациями PS1 FAD». Cell . 114 (5): 635–45. DOI : 10.1016 / j.cell.2003.08.008 . PMID 13678586 .
- ^ Георгакопулос A, Помет C, Герси E, Баки L, Сюй C, Сербан G, Робакис NK (2006). «Обработка ephrinB металлопротеиназой / пресенилином1 регулирует EphB-индуцированное фосфорилирование Src и передачу сигналов» . EMBO J . 25 (6): 1242–52. DOI : 10.1038 / sj.emboj.7601031 . PMC 1422162 . PMID 16511561 .
- ^ Lammich S, Okochi M, Takeda M, Kaether C, Capell A, Zimmer AK, Edbauer D, Walter J, Steiner H, Haass C (2002). «Пресенилин-зависимый внутримембранный протеолиз CD44 приводит к высвобождению его внутриклеточного домена и секреции Abeta-подобного пептида» . J Biol Chem . 277 (47): 44754–9. DOI : 10.1074 / jbc.M206872200 . PMID 12223485 .
- ^ Собханифар, S; Шнайдер, Б; Löhr, F; Gottstein, D; Икея, Т; Млынарчик, К; Пулавски, В; Ghoshdastider, U; Колинский, М; Филипек, S; Güntert, P; Бернхард, Ф; Dötsch, V (25 мая 2010 г.). «Структурное исследование С-концевого каталитического фрагмента пресенилина 1» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (21): 9644–9. DOI : 10.1073 / pnas.1000778107 . PMC 2906861 . PMID 20445084 .
- ^ Kaether C, Хаас C, Steiner H (2006). «Сборка, торговля и функции гамма-секретазы» (PDF) . Neurodegener Dis . 3 (4–5): 275–83. DOI : 10.1159 / 000095267 . PMID 17047368 .
- ^ Чжоу S, Чжоу H, Walian PJ, Jap BK (апрель 2006). «Открытие и роль CD147 как субъединицы гамма-секретазного комплекса». Перспектива новостей о наркотиках . 19 (3): 133–8. DOI : 10.1358 / dnp.2006.19.3.985932 . PMID 16804564 .
- ^ Чжоу S, Чжоу H, Walian PJ, Jap BK (май 2005). «CD147 представляет собой регуляторную субъединицу комплекса γ-секретазы в продукции амилоидного β-пептида при болезни Альцгеймера» . Proc. Natl. Акад. Sci. США . 102 (21): 7499–504. DOI : 10.1073 / pnas.0502768102 . PMC 1103709 . PMID 15890777 .
- ^ Chen F, Hasegawa H, Schmitt-Ulms G, Kawarai T, Bohm C, Katayama T, Gu Y, Sanjo N, Glista M, Rogaeva E, Wakutani Y, Pardossi-Piquard R, Ruan X, Tandon A, Checler F, Марамбо П., Хансен К., Вестэвей Д., Сент-Джордж-Хислоп П., Фрейзер П. (апрель 2006 г.). «TMP21 - это компонент комплекса пресенилина, который модулирует активность гамма-секретазы, но не активность эпсилон-секретазы». Природа . 440 (7088): 1208–12. DOI : 10,1038 / природа04667 . PMID 16641999 .
- ^ Мачеха Г, Д Trudler, Segev-Amzaled N, Galron R, R Штейн, Я.И. D (ноябрь 2010 г.). «Компонент g-секретазы пресенилин важен для очистки микроглии от β-амилоида». Анналы неврологии . 69 (1): 170–80. DOI : 10.1002 / ana.22191 . PMID 21280087 .
- ^ Shirotani К, Д Edbauer, Прокоп S, Хаас С, Н Штайнер (2004). «Идентификация различных комплексов гамма-секретазы с различными вариантами APH-1» . J Biol Chem . 279 (40): 41340–5. DOI : 10.1074 / jbc.M405768200 . PMID 15286082 .
- ↑ Zhang YW, Luo WJ, Wang H, Lin P, Vetrivel KS, Liao F, Li F, Wong PC, Farquhar MG, Thinakaran G, Xu H (апрель 2005 г.). «Никастрин имеет решающее значение для стабильности и незаконного оборота, но не для ассоциации других компонентов пресенилина / γ-секретазы» . J. Biol. Chem . 280 (17): 17020–6. DOI : 10.1074 / jbc.M409467200 . PMC 1201533 . PMID 15711015 .
- ↑ Watanabe N, Tomita T, Sato C, Kitamura T, Morohashi Y, Iwatsubo T (декабрь 2005 г.). «Pen-2 включается в комплекс гамма-секретаза посредством связывания с трансмембранным доменом 4 пресенилина 1» . J. Biol. Chem . 280 (51): 41967–75. DOI : 10.1074 / jbc.M509066200 . PMID 16234244 .
- ^ Прокоп S, Shirotani К, Д Edbauer, Хаас С, Н Штайнер (май 2004 г.). «Необходимость PEN-2 для стабилизации гетеродимера N- / C-концевого фрагмента пресенилина в гамма-секретазном комплексе» . J. Biol. Chem . 279 (22): 23255–61. DOI : 10.1074 / jbc.M401789200 . PMID 15039426 .
- Перейти ↑ Lee SF, Shah S, Yu C, Wigley WC, Li H, Lim M, Pedersen K, Han W, Thomas P, Lundkvist J, Hao YH, Yu G (февраль 2004 г.). «Консервативный мотив GXXXG в APH-1 имеет решающее значение для сборки и активности комплекса гамма-секретаза» . J. Biol. Chem . 279 (6): 4144–52. DOI : 10.1074 / jbc.M309745200 . PMID 14627705 .
- ↑ He G, Luo W, Li P, Remmers C, Netzer WJ, Hendrick J, Bettayeb K, Flajolet M, Gorelick F, Wennogle LP, Greengard P (сентябрь 2010). «Белок, активирующий гамма-секретазу, терапевтическая мишень для болезни Альцгеймера» . Природа . 467 (2): 95–98. DOI : 10,1038 / природа09325 . PMC 2936959 . PMID 20811458 . Краткое содержание - New York Times .
- ^ Капель А, D Бехер, Прокоп S, Штайнер Н, Kaether С, Ширмен МС, Хаас С (февраль 2005 г.). «Сборка комплекса гамма-секретазы на раннем секреторном пути» . J. Biol. Chem . 280 (8): 6471–8. DOI : 10.1074 / jbc.M409106200 . PMID 15591316 .
- ^ Ким SH, Инь YI, Li YM, Sisodia SS (ноябрь 2004). «Доказательства того, что сборка активного комплекса гамма-секретаза происходит в ранних отделах секреторного пути» . J. Biol. Chem . 279 (47): 48615–9. DOI : 10.1074 / jbc.C400396200 . PMID 15456788 .
- ^ Ханссон СА, Frykman S, Фармери МР, Tjernberg ЛО, Nilsberth С, Pursglove С.Е., Ито А, Winblad В, Cowburn РФ, Thyberg Дж, Ankarcrona М (декабрь 2004 г.). «Никастрин, пресенилин, APH-1 и PEN-2 образуют в митохондриях активные комплексы гамма-секретазы» . J. Biol. Chem . 279 (49): 51654–60. DOI : 10.1074 / jbc.M404500200 . PMID 15456764 .
- Перейти ↑ Wolfe MS (июль 2006 г.). «Гамма-секретазный комплекс: мембранно-встроенный протеолитический ансамбль». Биохимия . 45 (26): 7931–9. DOI : 10.1021 / bi060799c . PMID 16800619 .
- ^ Lazarov В.К., Fraering PC, Е. W, Wolfe MS, Selkoe DJ, Li H (май 2006). «Электронно-микроскопическая структура очищенной активной γ-секретазы показывает водную внутримембранную камеру и две поры» . Proc. Natl. Акад. Sci. США . 103 (18): 6889–94. DOI : 10.1073 / pnas.0602321103 . PMC 1458989 . PMID 16636269 .
- ^ Лу Р, Бай ХС, М Д, С Т, Ян С, вс л, Ян G, Чжао У, Чжоу R, Scheres SH, Ши Y (августа 2014). «Трехмерная структура γ-секретазы человека» . Природа . 512 (7513): 166–170. DOI : 10,1038 / природа13567 . PMC 4134323 . PMID 25043039 .
- ^ Wiley JC, Hudson M, Kanning KC, Schecterson LC, Ботуэлл M (сентябрь 2005). «Семейные мутации болезни Альцгеймера ингибируют опосредованное гамма-секретазой высвобождение карбоксиконцевого фрагмента белка-предшественника бета-амилоида» . J. Neurochem . 94 (5): 1189–201. DOI : 10.1111 / j.1471-4159.2005.03266.x . PMID 15992373 .
- ^ Янковский ДЛ, Fadale ди - джей, Андерсон Дж, Сю Г.М., Гонзэйлс В, Дженкинс Н.А., Copeland Н.Г., Ли М.К., Younkin ЛГ, Вагнер С.Л., Younkin С.Г., Borchelt ДР (январь 2004 г.). «Мутантные пресенилины специфически повышают уровни бета-амилоидного пептида с 42 остатками in vivo: доказательства увеличения 42-специфической гамма-секретазы» . Гул. Мол. Genet . 13 (2): 159–70. DOI : 10,1093 / HMG / ddh019 . PMID 14645205 .
- Перейти ↑ Zhao G, Tan J, Mao G, Cui MZ, Xu X (март 2007). «Одна и та же гамма-секретаза отвечает за множественные внутримембранные расщепления АРР» . J. Neurochem . 100 (5): 1234–46. DOI : 10.1111 / j.1471-4159.2006.04302.x . PMID 17241131 .
- ^ а б Чжан, H; Ма, Q; Чжан, Ю.В.; Сюй, Х (январь 2012 г.). «Протеолитический процессинг белка-предшественника β-амилоида Альцгеймера» . Журнал нейрохимии . 120 Дополнение 1: 9–21. DOI : 10.1111 / j.1471-4159.2011.07519.x . PMC 3254787 . PMID 22122372 .
- ^ Хаасс, C; Кетер, С; Thinakaran, G; Sisodia, S (май 2012 г.). «Торговля и протеолитический процессинг APP» . Перспективы Колд-Спринг-Харбор в медицине . 2 (5): а006270. DOI : 10.1101 / cshperspect.a006270 . PMC 3331683 . PMID 22553493 .