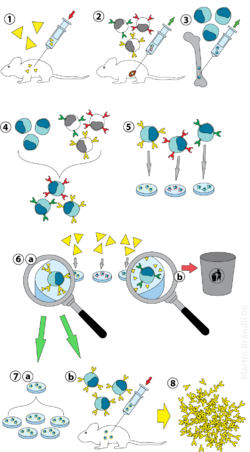
Гибридомная технология - это метод получения большого количества идентичных антител (также называемых моноклональными антителами ). Этот процесс начинается с введения мыши (или другого млекопитающего) антигена, который вызывает иммунный ответ. Тип белых кровяных телец, В-клетки , вырабатывает антитела, которые связываются с введенным антигеном. Эти продуцирующие антитела В-клетки затем собирают у мышей и, в свою очередь, сливают с бессмертными В-клеточными раковыми клетками, миеломой , [ требуется пояснение ] для получения гибридной клеточной линии, называемой гибридомой, который обладает как способностью B-клетки продуцировать антитела, так и долговечностью и воспроизводимостью миеломы. Гибридомы можно выращивать в культуре, причем каждая культура начинается с одной жизнеспособной клетки гибридомы, продуцируя культуры, каждая из которых состоит из генетически идентичных гибридом, которые продуцируют одно антитело на культуру (моноклональные), а не смеси различных антител (поликлональные). Линия клеток миеломы, которая используется в этом процессе, выбирается по ее способности расти в культуре ткани и по отсутствию синтеза антител. В отличие от поликлональных антител , которые представляют собой смеси многих различных молекул антител, все моноклональные антитела, продуцируемые каждой линией гибридомы, химически идентичны.
Производство моноклональных антител было изобретено Сезаром Мильштейном и Жоржем Дж. Ф. Келером в 1975 году. Они разделили Нобелевскую премию 1984 года по медицине и физиологии с Нильсом Кай Йерне , который внес и другой вклад в иммунологию. Термин гибридома был введен Леонардом Герценбергом во время его творческого отпуска в лаборатории Сезара Мильштейна в 1976–1977 годах. [1]
Метод [ править ]
Лабораторные животные ( млекопитающие , например, мыши) сначала подвергаются воздействию антигена, против которого должно быть образовано антитело. Обычно это делается серией инъекций рассматриваемого антигена в течение нескольких недель. За этими инъекциями обычно следует электропорация in vivo , которая значительно усиливает иммунный ответ. После выделения спленоцитов из селезенки млекопитающего В-клетки сливаются с иммортализованными клетками миеломы. Слияние В-клеток с миеломными клетками можно осуществить с помощью электрослияния. Электросварказаставляет В-клетки и клетки миеломы выравниваться и сливаться под действием электрического поля. В качестве альтернативы, B-клетки и миеломы можно заставить слиться с помощью химических протоколов, чаще всего с использованием полиэтиленгликоля . Клетки миеломы отбираются заранее, чтобы убедиться, что они сами не секретируют антитела и что в них отсутствует ген гипоксантин-гуанинфосфорибозилтрансферазы (HGPRT), что делает их чувствительными к среде HAT (см. Ниже).
Гибридные клетки инкубируют в среде HAT ( гипоксантин - аминоптерин - тимидин среда) в течение примерно от 10 до 14 дней. Аминоптерин блокирует путь, обеспечивающий синтез нуклеотидов. Следовательно, неслитые миеломные клетки умирают, поскольку они не могут производить нуклеотиды de novo или путями спасения.потому что им не хватает HGPRT. Удаление неслитых миеломных клеток необходимо, потому что они могут перерасти другие клетки, особенно слабо укоренившиеся гибридомы. Неслитые В-клетки умирают, поскольку имеют короткую продолжительность жизни. Таким образом, выживают только гибриды В-клетки и миеломы, поскольку ген HGPRT, исходящий из В-клеток, является функциональным. Эти клетки вырабатывают антитела (свойство В-клеток) и бессмертны (свойство миеломных клеток). Затем инкубированную среду разводят в многолуночных планшетах до такой степени, чтобы каждая лунка содержала только одну клетку. Поскольку антитела в лунке продуцируются одной и той же В-клеткой, они будут направлены к одному и тому же эпитопу и, следовательно, являются моноклональными антителами.
Следующим этапом является процесс быстрого первичного скрининга, который идентифицирует и отбирает только те гибридомы, которые продуцируют антитела соответствующей специфичности. Первый используемый метод скрининга называется ELISA . Затем инкубируют супернатант культуры гибридомы, конъюгат, меченный вторичным ферментом, и хромогенный субстрат, и образование окрашенного продукта указывает на положительную гибридому. В качестве альтернативы также можно использовать иммуноцитохимический [2] вестерн-блоттинг и иммунопреципитационно-масс-спектрометрический скрининг. В отличие от вестерн-блоттинга, иммунопреципитационно-масс-спектрометрия облегчает скрининг и ранжирование клонов, которые связываются с нативными (неденатурированными) формами антигенных белков. [3]
B-клетка, продуцирующая желаемые антитела, может быть клонирована для получения множества идентичных дочерних клонов. Для этого этапа необходимы дополнительные среды, содержащие интерлейкин-6 (например, бриклон ). Как только колония гибридомы создана, она будет постоянно расти в такой культуральной среде, как RPMI-1640 (с антибиотиками и фетальной бычьей сывороткой), и производить антитела. [2]
Многолуночные планшеты первоначально используются для выращивания гибридом, а после отбора их заменяют на более крупные колбы для тканевых культур. Это поддерживает благополучие гибридом и обеспечивает достаточное количество клеток для криоконсервации и супернатанта для последующих исследований. Супернатант культуры может давать от 1 до 60 мкг / мл моноклонального антитела, которое поддерживается при -20 ° C или ниже, пока не потребуется. [2]
Используя культуральный супернатант или препарат очищенного иммуноглобулина, можно провести дополнительный анализ гибридомы, продуцирующей моноклональные антитела, с точки зрения реактивности, специфичности и перекрестной реактивности. [2]
Приложения [ править ]
Моноклональные антитела используются во многих случаях, включая профилактику, диагностику и лечение заболеваний. Например, моноклональные антитела могут различать подмножества В-клеток и Т-клеток , что помогает в идентификации различных типов лейкемии . Кроме того, специфические моноклональные антитела использовались для определения маркеров клеточной поверхности на лейкоцитах и других типах клеток. Это привело к кластеру дифференцированных серий маркеров. Их часто называют маркерами CD, и они определяют несколько сотен различных компонентов клеточной поверхности клеток, каждый из которых определяется связыванием определенного моноклонального антитела. Такие антитела чрезвычайно полезны для сортировки клеток с активацией флуоресценции., специфическая изоляция определенных типов клеток.
В диагностической гистопатологии [ править ]
С помощью моноклональных антител ткани и органы можно классифицировать на основе их экспрессии определенных определенных маркеров, которые отражают тканевой или клеточный генезис. Специфический антиген простаты , плацентарная щелочная фосфатаза , хорионический гонадотропин человека , α-фетопротеин и другие являются органо-ассоциированными антигенами, и выработка моноклональных антител против этих антигенов помогает определить природу первичной опухоли. [2]
Моноклональные антитела особенно полезны для различения морфологически сходных поражений, таких как мезотелиома плевры и брюшины , аденокарцинома , а также для определения органного или тканевого происхождения недифференцированных метастазов . Выбранные моноклональные антитела помогают в обнаружении скрытых метастазов ( рака неизвестного первичного происхождения ) с помощью иммуно-цитологического анализа костного мозга, аспиратов других тканей, а также лимфатических узлов и других тканей и могут иметь повышенную чувствительность по сравнению с обычным гистопатологическим окрашиванием . [2]
В одном исследовании [4] был проведен чувствительный иммуно-гистохимический анализ аспиратов костного мозга 20 пациентов с локализованным раком простаты. В анализе использовали три моноклональных антитела (T16, C26 и AE-1), способные распознавать мембранные и цитоскелетные антигены, экспрессируемые эпителиальными клетками, для обнаружения опухолевых клеток. Аспират костного мозга у 22% пациентов с локализованным раком простаты (стадия B, 0/5; стадия C, 2/4) и у 36% пациентов с метастатическим раком простаты (стадия D1, 0/7 пациентов; стадия D2, 4 / 4 пациента) имели антиген-положительные клетки в костном мозге. Был сделан вывод, что иммуно-гистохимическое окрашивание аспиратов костного мозга очень полезно для обнаружения скрытых метастазов в костном мозге у пациентов с явно локализованным раком простаты.
Хотя иммуноцитохимия с использованием связанных с опухолью моноклональных антител привела к улучшенной способности обнаруживать клетки скрытого рака молочной железы в аспиратах костного мозга и периферической крови, необходима дальнейшая разработка этого метода, прежде чем его можно будет использовать в повседневной практике. [5] Одним из основных недостатков иммуно-цитохимии является то, что используются только опухоль-ассоциированные, а не опухолеспецифические моноклональные антитела, и в результате может возникнуть некоторая перекрестная реакция с нормальными клетками. [6]
Чтобы эффективно определить стадию рака груди и оценить эффективность режимов очистки перед инфузией аутологичных стволовых клеток, важно обнаружить даже небольшое количество клеток рака груди. Иммуно-гистохимические методы идеально подходят для этой цели, поскольку они просты, чувствительны и довольно специфичны. Франклин и др. [7] провели чувствительный иммуно-цитохимический анализ, используя комбинацию четырех моноклональных антител (260F9, 520C9, 317G5 и BrE-3) против гликопротеинов поверхности опухолевых клеток для идентификации клеток опухоли груди в костном мозге и периферической крови. На основании результатов они пришли к выводу, что иммуно-цитохимическое окрашивание костного мозга и периферической крови является чувствительным и простым способом обнаружения и количественной оценки клеток рака груди.
Одна из основных причин метастатического рецидива у пациентов с солидными опухолями - раннее распространение злокачественных клеток. Использование моноклональных антител (mAb), специфичных для цитокератинов, может идентифицировать диссеминированные отдельные эпителиальные опухолевые клетки в костном мозге.
В одном исследовании [8] сообщается о разработке иммуно-цитохимической процедуры для одновременного мечения цитокератинового компонента № 18 (CK18) и специфический антиген простаты (PSA). Это могло бы помочь в дальнейшей характеристике диссеминированных отдельных эпителиальных опухолевых клеток у пациентов с раком простаты. Двенадцать контрольных аспиратов от пациентов с доброкачественной гипертрофией предстательной железы показали отрицательное окрашивание, что дополнительно подтверждает специфичность СК18 в обнаружении эпителиальных опухолевых клеток в костном мозге.
В большинстве случаев злокачественного заболевания, осложненного выпотом, неопластические клетки легко распознаются. Однако в некоторых случаях злокачественные клетки не так легко увидеть или их присутствие слишком сомнительно, чтобы назвать это положительным результатом. Использование иммуно-цитохимических методов повышает точность диагностики в этих случаях.
Гош, Мейсон и Сприггс [9] проанализировали 53 образца плевральной или перитонеальной жидкости от 41 пациента со злокачественным заболеванием. Обычное цитологическое исследование не выявило опухолевых клеток. Три моноклональных антитела (анти-CEA, Ca 1 и HMFG-2) были использованы для поиска злокачественных клеток. Иммуноцитохимическое маркирование проводилось на неокрашенных мазках, которые хранились при -20 ° C до 18 месяцев. В двенадцати из сорока одного случая иммуноцитохимического окрашивания были выявлены злокачественные клетки. Результатом стало повышение диагностической точности.примерно 20%. В исследовании сделан вывод о том, что у пациентов с подозрением на злокачественное заболевание иммуно-цитохимическая маркировка должна использоваться в повседневной практике при исследовании цитологически отрицательных образцов и имеет важное значение для ведения пациентов.
Другое применение иммуноцитохимического окрашивания - обнаружение двух антигенов в одном мазке. Двойное окрашивание антителами к легкой цепи и маркерами Т- и В-клеток может указывать на неопластическое происхождение лимфомы. [10]
В одном исследовании сообщается о выделении линии клеток гибридомы (клон 1E10), которая продуцирует моноклональные антитела (IgM, изотип k). Это моноклональное антитело показывает специфическое иммуно-цитохимическое окрашивание ядрышек. [11]
С помощью моноклональных антител можно классифицировать ткани и опухоли на основе экспрессии в них определенных маркеров. Они помогают различать морфологически похожие поражения и определять органное или тканевое происхождение недифференцированных метастазов. Иммуно-цитологический анализ костного мозга, тканевых аспиратов, лимфатических узлов и т. Д. С использованием отдельных моноклональных антител помогает в обнаружении скрытых метастазов. Моноклональные антитела повышают чувствительность при обнаружении даже небольших количеств инвазивных или метастатических клеток. Моноклональные антитела (mAb), специфичные для цитокератинов, могут обнаруживать диссеминированные отдельные эпителиальные опухолевые клетки в костном мозге.
Ссылки [ править ]
- Перейти ↑ Milstein, C (1999). «Гибридомная революция: ответвление фундаментальных исследований». BioEssays . 21 (11): 966–73. DOI : 10.1002 / (SICI) 1521-1878 (199911) 21:11 <966 :: AID-BIES9> 3.0.CO; 2-Z . PMID 10517870 .
- ^ a b c d e f Нельсон, ПН; Рейнольдс, GM; Waldron, EE; Уорд, E; Giannopoulos, K; Мюррей, PG (2000). «Демистифицировано ...: Моноклональные антитела» . Молекулярная патология . 53 (3): 111–7. DOI : 10.1136 / mp.53.3.111 . PMC 1186915 . PMID 10897328 .
- ^ Корбакис, D; Brinc, D; Schiza, C; Soosaipillai, A; Ярви, К; Драбович А.П .; Диамандис, Э (2015). «Скрининг мониторинга реакций, выбранных с помощью иммунозахвата, облегчает разработку ELISA для измерения нативного TEX101 в биологических жидкостях» . Молекулярная и клеточная протеомика . 14 (6): 1517–1526. DOI : 10.1074 / mcp.M114.047571 . PMC 4458717 . PMID 25813379 .
- ^ Бреттон, PR; Меламед, MR; Ярмарка, WR; Кот, RJ (1994). «Обнаружение скрытых микрометастазов в костном мозге у больных карциномой простаты». Простаты . 25 (2): 108–14. DOI : 10.1002 / pros.2990250208 . PMID 7518596 .
- ^ Kvalheim, G (1996). «Обнаружение скрытых опухолевых клеток в костном мозге и крови у больных раком груди - методы и клиническое значение» . Acta Oncol . 35 : 13–18. DOI : 10.3109 / 02841869609098516 . PMID 9073044 .
- ^ Kvalheim, G (1998). «Диагностика минимальной остаточной болезни костного мозга и крови у онкологических больных - методы и клиническое значение». Acta Oncologica . 37 (5): 455–62. DOI : 10.1080 / 028418698430403 . PMID 9831374 .
- ^ Франклин, Вашингтон; Shpall, EJ; Арчер, П; Джонстон, CS; Гарза-Уильямс, S; Хами, L; Горький, Массачусетс; Bast, RC; Джонс, РБ (1996). «Иммуноцитохимическое обнаружение клеток рака груди в костном мозге и периферической крови пациентов, проходящих химиотерапию высокими дозами с использованием аутологичных стволовых клеток». Лечение рака груди Res . 41 (1): 1–13. DOI : 10.1007 / BF01807031 . PMID 8932871 .
- ^ Ризенберг, R; Обернедер, Р. Kriegmair, M; Эпп, М; Bitzer, U; Hofstetter, A; Браун, S; Riethmüller, G; Пантель, К. (1993). «Иммуноцитохимическое двойное окрашивание цитокератина и простатического специфического антигена в индивидуальных опухолевых клетках простаты». Гистохимия . 99 (1): 61–6. DOI : 10.1007 / BF00268022 . PMID 7682210 .
- ^ Гош, AK; Мейсон, Д.Ю .; Сприггс, AI (1983). «Иммуноцитохимическое окрашивание моноклональными антителами в цитологически« отрицательных »серозных выпотах от больных злокачественными новообразованиями» . J Clin Pathol . 36 (10): 1150–53. DOI : 10.1136 / jcp.36.10.1150 . PMC 498493 . PMID 6194182 .
- ^ Гош, AK; Сприггс, AI; Тейлор-Пападимитриу, Дж ; Мейсон, Д. Ю. (1983). «Иммуноцитохимическое окрашивание клеток плеврального и перитонеального выпота с панелью моноклональных антител» . J Clin Pathol . 36 (10): 1154–64. DOI : 10.1136 / jcp.36.10.1154 . PMC 498494 . PMID 6194183 .
- ^ Vissers, CJ; Flohil, CC; Де Йонг, AA; Диндженс, Вашингтон; Босман, FT (1996). «Новое моноклональное антитело для специфического иммуноцитохимического окрашивания ядрышек». Acta histochemica . 98 (2): 113–21. DOI : 10.1016 / S0065-1281 (96) 80028-6 . PMID 8739296 .
Внешние ссылки [ править ]
- Гибридомы в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- «Технология гибридом» . Понимание серии рака: иммунная система . Национальный институт рака . Архивировано из оригинала на 5 октября 2014 года.
- «Культура гибридомных клеток» .