 | |
 | |
| Идентификаторы | |
|---|---|
3D модель ( JSmol ) | |
| ChemSpider | |
PubChem CID | |
CompTox Dashboard ( EPA ) | |
| |
| |
| Характеристики | |
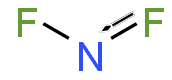
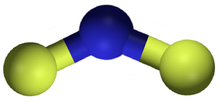
| NF 2 | |
| Родственные соединения | |
Родственные фториды азота | Трифторид азота, тетрафторид азота, монофторид азота |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Дифторид азота , также известный как дифторамино, представляет собой реактивную радикальную молекулу с формулой NF 2 . Эта небольшая молекула находится в равновесии со своим димером тетрафторида диазота . [2]
- N 2 F 4 ⇌ 2 NF 2 •
С повышением температуры доля NF 2 увеличивается. [3]
Молекула необычна тем, что имеет нечетное количество электронов, но при этом достаточно устойчива для экспериментального изучения. [4]
Свойства [ править ]
Энергия, необходимая для разрыва связи NN в N 2 F 4, составляет 20,8 ккал / моль с изменением энтропии 38,6 eu . [5] Для сравнения, энергия диссоциации связи NN составляет 14,6 ккал / моль в N 2 O 4 , 10,2 ккал / моль в N 2 O 2 и 60 ккал / моль в N 2 H 4 . Энтальпия образования из N 2 F 4 (H ф ) является 34,421 кДж / моль. [6]
При комнатной температуре N 2 F 4 в основном связан только с 0,7% в форме NF 2 при давлении 5 мм рт. Ст. Когда температура повышается до 225 ° C, он в основном диссоциирует на 99% в форме NF 2 . [5]
В NF 2 длина связи N – F составляет 1,3494 Å, а угол, образованный FNF, составляет 103,33 °. [7]
В инфракрасном спектре связь NF в NF 2 имеет симметричную частоту растяжения 1075 см -1 . Для сравнения: 1115 в NF, 1021 в NF 3 и 998 в N 2 F 4 . [5]
В микроволновом спектре видны многочисленные линии, обусловленные спиновыми переходами с ядерными спиновыми переходами или без них. Линии образуют набор из двух троек для антисимметричного синглета или двух троек для симметричного триплета. Линии появляются в районе 14-15, 24, 25, 26, 27, 28-29, 33, 60, 61, 62, 65 ГГц. Постоянные вращения молекулы NF 2 составляют A = 70496 МГц, B = 11872,2 МГц и C = 10136,5 МГц. Инерционный дефект Δ = 0,1204 м u Å 2 . Константы центробежных искажений: τ aaaa = −7,75, τ bbbb = −0,081, τ aabb = 0,30 и τ abab = −0,13. [7]
Дипольный момент составляет 0,13 Д (4,5 × 10 -31 См⋅м). [7]
Основное электронное состояние молекулы 2 B 1 . [7]
Газ часто загрязнен NO или N 2 O. [5]
Используйте [ редактировать ]
Дифторид азота образуется во время работы эксимерного ксенонового монофторидного лазера. Трифторид азота представляет собой галогенидный газ-носитель, который выделяет фторид-ионы при воздействии электронов: [1]
- НФ 3 + е - → НФ 2 + F -
Свободный ион фтора продолжает реагировать с катионами ксенона. [1]
Дифторид азота можно дополнительно расходовать с образованием монофторида азота .
- NF 2 + e - → NF + F - [1]
Ссылки [ править ]
- ^ a b c d Трейнор, Дэниел В. (февраль 1989 г.). «Диссоциативное присоединение электронов к радикалам дифторида азота». Журнал физической химии . 93 (3): 1134–1136. DOI : 10.1021 / j100340a022 .
- ↑ Jager, Susanne; фон Жуан, Йорн; Келлер-Рудек, Ханнелор; Кошель, Дитер; Кун, Питер; Мерле, Питер; Рупехт, Сигрид; Ванечек, Ганс; Вагнер, Иоахим (1986). Кошель, Дитер; Кун, Питер; Мерле, Питер; Рупрехт, Сигрид; Вагнер, Иоахим (ред.). F Фтор: соединения с кислородом и азотом . Справочник Гмелина по неорганической химии. 4 . Берлин: Springer. п. 162. DOI : 10.1007 / 978-3-662-06339-2 . ISBN 978-3-662-06341-5. Проверено 29 августа 2015 года .
- ^ Джонсон, Фредерик А .; Колберн, Чарльз Б. (июль 1961 г.). "Радикальное равновесие тетрафторгидразин-дифторамино". Журнал Американского химического общества . 83 (14): 3043–3047. DOI : 10.1021 / ja01475a018 .
- ^ Браун, RD; Бремя, FR; Hart, BT; Уильямс, GR (1973). «Электронная структура радикала NF2». Теоретика Chimica Acta . 28 (4): 339–353. DOI : 10.1007 / BF00529015 . S2CID 100649705 .
- ^ a b c d Бон, Роберт К .; Бауэр, Саймон Харви (февраль 1967). «Электронографическое исследование структур NF 2 и N 2 F 4 ». Неорганическая химия . 6 (2): 304–309. DOI : 10.1021 / ic50048a024 . размеры и углы молекул
- ^ "Дифторид азота NF 2 (г)" .
- ^ а б в г Браун, РД; Бремя, FR; Годфри, Полицейский; Гиллард, И. Р. (август 1974 г.). «Микроволновый спектр НФ 2 ». Журнал молекулярной спектроскопии . 52 (2): 301–321. Bibcode : 1974JMoSp..52..301B . DOI : 10.1016 / 0022-2852 (74) 90121-0 .
Дополнительное чтение [ править ]
- Добрый друг, PL; Вудс, HP (январь 1964 г.). «Спектр поглощения NF2». Журнал молекулярной спектроскопии . 13 (1–4): 63–66. Bibcode : 1964JMoSp..13 ... 63G . DOI : 10.1016 / 0022-2852 (64) 90055-4 .
- Jacox, Мэрилин Э .; Миллиган, Dolphus E .; Guillory, William A .; Смит, Джерри Дж. (Август 1974 г.). «Матрично-изоляционное исследование вакуумно-ультрафиолетового фотолиза NF3». Журнал молекулярной спектроскопии . 52 (2): 322–327. Bibcode : 1974JMoSp..52..322J . DOI : 10.1016 / 0022-2852 (74) 90122-2 .
- Хайднер, РФ; Хелваджян, Генри; Коффенд, Дж. Брук (август 1987 г.). «Настраиваемый УФ-лазерный фотолиз NF2: квантовый выход для производства NF (a1Δ)» . Журнал химической физики . 87 (3): 1520–1524. Bibcode : 1987JChPh..87.1520H . DOI : 10.1063 / 1.453262 .
- Папакондилис, Аристотель; Мавридис, Аристидес (декабрь 1993 г.). «Электронно-геометрическая структура радикала NF2» (PDF) . Письма по химической физике . 216 (1–2): 167–172. Bibcode : 1993CPL ... 216..167P . DOI : 10.1016 / 0009-2614 (93) E1254-E .
- Cai, Z.-L .; Sha, G.-H .; Zhang, C.-H .; Хуанг, М.-Б. (Март 1991 г.). «Ab initio исследование низколежащих электронных состояний радикала NF2». Письма по химической физике . 178 (2–3): 273–278. Bibcode : 1991CPL ... 178..273C . DOI : 10.1016 / 0009-2614 (91) 87068-M .