Диоксид азота при −196 ° C, 0 ° C, 23 ° C, 35 ° C и 50 ° C. ( НЕТ 2) превращается в бесцветный четырехокись азота ( N 2О 4) при низких температурах и возвращается к NO 2 при более высоких температурах. | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Тетраоксид диазота | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.031.012 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1067 | ||
CompTox Dashboard ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| N 2 O 4 | |||
| Молярная масса | 92,011 г / моль | ||
| Внешность | Бесцветная жидкость, оранжевый газ | ||
| Плотность | 1,44246 г / см 3 (жидкость, 21 ° C) | ||
| Температура плавления | -11,2 ° C (11,8 ° F, 261,9 K) и разлагается до NO 2 | ||
| Точка кипения | 21,69 ° С (71,04 ° F, 294,84 К) | ||
| Реагирует с образованием азотистой и азотной кислот. | |||
| Давление газа | 96 кПа (20 ° C) [1] | ||
| −23,0 · 10 −6 см 3 / моль | |||
Показатель преломления ( n D ) | 1,00112 | ||
| Структура | |||
| Планар, Д 2ч | |||
| маленький, ненулевой | |||
| Термохимия | |||
Стандартная мольная энтропия ( S | 304,29 Дж / комоль [2] | ||
Std энтальпия формации (Δ F H ⦵ 298 ) | +9,16 кДж / моль [2] | ||
| Опасности | |||
| Паспорт безопасности | Внешний паспорт безопасности материалов | ||
Классификация ЕС (DSD) (устарела) | Т + С | ||
| R-фразы (устаревшие) | R26 , R34 | ||
| S-фразы (устарели) | (S1 / 2) , S9 , S26 , S28 , S36 / 37/39 , S45 | ||
| NFPA 704 (огненный алмаз) | [3] [4]  0 3 0 OX | ||
| точка возгорания | Негорючий | ||
| Родственные соединения | |||
Связанные оксиды азота |
| ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Четырехокись азота , обычно называемая тетроксидом азота (NTO) , а иногда, как правило, среди ракетных инженеров из бывшего СССР / России, как амил , представляет собой химическое соединение N 2 O 4 . Это полезный реагент в химическом синтезе. Образует равновесную смесь с диоксидом азота .
Тетроксид диазота является мощным окислителем, который гиперголичен (самопроизвольно реагирует) при контакте с различными формами гидразина , что сделало эту пару обычным двухкомпонентным топливом для ракет.
Структура и свойства [ править ]
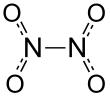
Четырехокись азота можно рассматривать как две связанные вместе нитрогруппы (-NO 2 ). Образует равновесную смесь с диоксидом азота . [5] Молекула плоская с расстоянием связи NN 1,78 Å и расстоянием NO 1,19 Å. Расстояние NN соответствует слабой связи, так как оно значительно больше, чем средняя длина одинарной связи NN, составляющая 1,45 Å. [6]
В отличие от NO 2 , N 2 O 4 является диамагнитным , так как он не имеет неспаренных электронов. [7] Жидкость также бесцветна, но может выглядеть как коричневато-желтая жидкость из-за присутствия NO 2 в соответствии со следующим равновесием:
- N 2 O 4 ⇌ 2 NO 2
Более высокие температуры сдвигают равновесие в сторону диоксида азота. Неизбежно некоторое количество тетроксида диазота является компонентом смога, содержащего диоксид азота.
Производство [ править ]
Четырехокись азота производятся каталитическим окислением из аммиака : пар используются в качестве разбавителя для уменьшения температуры сгорания. На первом этапе аммиак окисляется до оксида азота :
- 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O
Большая часть воды конденсируется, а газы дополнительно охлаждаются; образовавшийся оксид азота окисляется до диоксида азота, который затем димеризуется до четырехокиси азота:
- 2 НО + О 2 → 2 НЕТ 2
- 2 NO 2 ⇌ N 2 O 4
а остальная вода удаляется в виде азотной кислоты . Этот газ представляет собой по существу чистый диоксид азота, который конденсируется в четырехокись азота в ожижителе, охлаждаемом рассолом. [ необходима цитата ]
Четырехокись азота также можно получить реакцией концентрированной азотной кислоты и металлической меди. Этот синтез более практичен в лабораторных условиях и обычно используется в качестве демонстрации или эксперимента в химических лабораториях бакалавриата. Окисление меди азотной кислотой - сложная реакция с образованием различных оксидов азота различной стабильности, которая зависит от концентрации азотной кислоты, присутствия кислорода и других факторов. Нестабильные частицы далее реагируют с образованием диоксида азота, который затем очищается и конденсируется с образованием тетроксида диазота.
Использовать как ракетное топливо [ править ]
Четырехокись азота используется в качестве окислителя в одном из важнейших ракетных топлив, поскольку его можно хранить в жидком виде при комнатной температуре. В начале 1944 года немецкие ученые провели исследование возможности использования тетроксида диазота в качестве окислителя для ракетного топлива, хотя немцы использовали его лишь в очень ограниченной степени в качестве добавки к S-Stoff (дымящейся азотной кислоте). К концу 1950-х он стал предпочтительным окислителем для хранения многих ракет как в США, так и в СССР . Это гиперголическое ракетное топливо в сочетании с ракетным топливом на основе гидразина . Одно из первых применений этой комбинации было на ракетах семейства Titan, первоначально использовавшихся какМБР, а затем и в качестве ракет-носителей для многих космических кораблей. Используемый на американских космических кораблях Gemini и Apollo, а также на космических челноках, он по-прежнему используется в качестве топлива для удержания станций на большинстве геостационарных спутников и многих космических зондах. Он также является основным окислителем для российской ракеты « Протон» .
При использовании в качестве пропеллента тетроксид диазота обычно называют просто тетроксидом азота, и аббревиатура NTO широко используется. Кроме того, NTO часто используется с добавлением небольшого процента оксида азота , который препятствует коррозионному растрескиванию титановых сплавов, и в этой форме NTO для пропеллента называют смешанными оксидами азота ( MON ). Большинство космических аппаратов теперь используют MON вместо NTO; например, в системе управления реакцией Space Shuttle использовался MON3 (NTO, содержащий 3% NO по весу). [8]
Несчастный случай "Аполлона" и "Союза" [ править ]
24 июля 1975 года отравление NTO затронуло трех американских астронавтов во время последнего спуска на Землю после полета в рамках испытательного проекта "Аполлон-Союз" . Это произошло из-за того, что переключатель случайно оставлен в неправильном положении, что позволило двигателям управления ориентацией сработать после открытия воздухозаборника кабины, что позволило дымам NTO попасть в кабину. Один из членов экипажа во время спуска потерял сознание. После приземления экипаж был госпитализирован на пять дней из-за химической пневмонии и отека . [9] [10]
Производство электроэнергии с использованием N 2 O 4 [ править ]
Тенденция N 2 O 4 к обратимому превращению в NO 2 привела к исследованиям его использования в передовых системах выработки электроэнергии в качестве так называемого диссоциирующего газа. [11] «Холодный» четырехокись азота сжимается и нагревается, в результате чего он диссоциирует на двуокись азота с половинной молекулярной массой. Этот горячий диоксид азота расширяется через турбину, охлаждая ее и понижая давление, а затем дополнительно охлаждая в радиаторе, заставляя его рекомбинировать в четырехокись азота с исходной молекулярной массой. В этом случае намного проще сжать, чтобы снова начать весь цикл. Такие диссоциативные газовые циклы Брайтонаобладают потенциалом для значительного повышения эффективности оборудования для преобразования энергии. [12]
Химические реакции [ править ]
Промежуточный продукт в производстве азотной кислоты [ править ]
Азотная кислота производится в больших масштабах через N 2 O 4 . Этот вид реагирует с водой с образованием азотистой и азотной кислот :
- N 2 O 4 + H 2 O → HNO 2 + HNO 3
Побочный продукт HNO 2 при нагревании диспропорционирует до NO и более азотной кислоты. Под воздействием кислорода NO превращается обратно в диоксид азота:
- 2 НО + О 2 → 2 НЕТ 2
Образовавшиеся NO 2 и N 2 O 4 можно вернуть в цикл, чтобы снова получить смесь азотистой и азотной кислот.
Синтез нитратов металлов [ править ]
N 2 O 4 ведет себя как соль [NO + ] [NO 3 - ], первая из которых является сильным окислителем:
- 2 N 2 O 4 + M → 2 NO + M (НЕТ 3 ) 2
где M = Cu , Zn или Sn .
Если нитраты металлов получают из N 2 O 4 в полностью безводных условиях, ряд ковалентных нитратов металлов может быть образован со многими переходными металлами. Это потому, что существует термодинамическое предпочтение для нитрат-иона ковалентно связываться с такими металлами, а не образовывать ионную структуру. Такие соединения должны быть получены в безводных условиях, поскольку ион нитрата является гораздо более слабым лигандом, чем вода, и если вода присутствует, образуется простой гидратированный нитрат. Рассматриваемые безводные нитраты сами по себе ковалентны, и многие из них, например безводный нитрат меди, летучие при комнатной температуре. Безводный нитрат титана возгоняется в вакууме всего при 40 ° C. Многие из безводных нитратов переходных металлов имеют яркий цвет. Этот раздел химии был разработан Клиффом Аддисоном и Норманом Логаном в Ноттингемском университете в Великобритании в 1960-х и 1970-х годах, когда стали доступны высокоэффективные осушители и сушильные камеры .
Ссылки [ править ]
- ^ Международная карта химической безопасности https://www.ilo.org/dyn/icsc/showcard.display?p_lang=en&p_card_id=0930&p_version=2
- ^ а б П.В. Аткинс и Дж. Де Паула, Физическая химия (8-е изд., WH Freeman, 2006), стр.999.
- ^ «Химический лист данных: четырехокись азота» . CAMEO Chemicals NOAA . Проверено 8 сентября 2020 .
- ^ "Резюме соединения: тетроксид диазота" . PubChem . Проверено 8 сентября 2020 .
- ^ Бент, Генри А. (1963). «Димеры диоксида азота. II. Структура и связь». Неорганическая химия . 2 (4): 747–752. DOI : 10.1021 / ic50008a020 .
- ^ Петруччи, Ральф Х .; Харвуд, Уильям S .; Херринг, Ф. Джеффри (2002). Общая химия: принципы и современные приложения (8-е изд.). Река Аппер Сэдл, Нью-Джерси: Prentice Hall. п. 420 . ISBN 978-0-13-014329-7. LCCN 2001032331 . OCLC 46872308 .
- ^ Holleman, AF; Виберг, Э. "Неорганическая химия" Academic Press: Сан-Диего, 2001. ISBN 978-0-12-352651-9 .
- ^ "Индекс ракетного топлива" . Архивировано из оригинала на 2008-05-11 . Проверено 1 марта 2005 .
- ^ «Бренд берет на себя вину за утечку газа Аполлона» , Флоренция, Алабама - газета Times Daily , 10 августа 1975 г.
- ^ Сотос, Джон Г., доктор медицины. "Медицинские истории космонавтов и космонавтов" , 12 мая 2008 г., по состоянию на 1 апреля 2011 г.
- ^ Stochl, Роберт Дж (1979). Возможное повышение производительности за счет использования реагирующего газа (тетроксида азота) в качестве рабочего тела в замкнутом цикле Брайтона (PDF) (Технический отчет). НАСА . ТМ-79322.
- ^ Рагеб, Р. «Концепции ядерных реакторов и термодинамические циклы» (PDF) . Дата обращения 1 мая 2013 .
Внешние ссылки [ править ]
| Викискладе есть медиафайлы по теме тетроксид диазота . |
- Международная карта химической безопасности 0930
- Национальный реестр загрязнителей - информационный бюллетень по оксидам азота
- Карманный справочник NIOSH по химической опасности : тетроксид азота
- Энциклопедия газов Air Liquide: NO 2 / N 2 O 4
- Поляков, Мартын (2009). "Химия лунного взлета: наш выпуск к 40-летию Аполлона-11" . Периодическая таблица видео . Ноттингемский университет .