Хроморганическая химия - это отрасль металлоорганической химии, которая занимается органическими соединениями, содержащими связь хрома с углеродом, и их реакциями. [1] [2] Эта область имеет некоторое отношение к органическому синтезу . Соответствующие степени окисления для хроморганических комплексов охватывают весь диапазон возможных степеней окисления от –4 (d 10 ) в Na 4 [Cr –IV (CO) 4 ] до +6 (d 0 ) в оксоалкильных комплексах, таких как Cp * Cr VI (= O) 2 Me.
История [ править ]
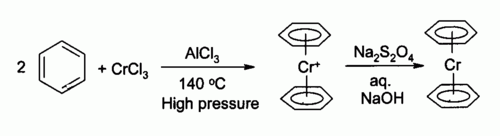
Первое хроморганическое соединение было описано в 1919 году Францем Хайном . [3] Он относился к фенилмагнийбромиду с хромом (III) хлоридом с получением нового продукта (после гидролиза) , которую он неправильно идентифицирован как ПЕНТАФЕНИЛ хром бромид (Ph 5 CrBr). Спустя годы, в 1957 г., HH Zeiss et al. повторил эксперименты Хейна и правильно пришел к сэндвичевому соединению катионного бисарена и хрома (Ar 2 Cr + ). [4] Сам бис (бензол) хром был открыт примерно в то же время в 1956 году Эрнстом Отто Фишером в результате реакции хлорида хрома (III) ,бензол и хлорид алюминия . [5] [6] Родственный составной хромоцен был открыт несколькими годами ранее в 1953 году также Фишером. [7]
В другом случае Анет и Леблан также в 1957 году приготовили раствор бензилхрома из бензилбромида и перхлората хрома (II) . [8] Эта реакция включает одноэлектронное окислительное присоединение связи углерод-бром , процесс, который, как показал Кочи [9] [10], является случаем двойного переноса одного электрона , сначала с образованием бензильного свободного радикала, а затем к бензил- аниону .
G. Wilke et al. представила трис- (η-аллил) хром в 1963 году в качестве раннего катализатора Циглера-Натта (но безуспешно в долгосрочной перспективе) [11]. Хромоценовые соединения были впервые использованы в полимеризации этилена в 1972 году компанией Union Carbide [12] и продолжают использоваться сегодня используется в промышленном производстве полиэтилена высокого давления .
Хроморганическое соединение (фенилметоксикарбен) пентакарбонилхром, Ph (OCH 3 ) C = Cr (CO) 5, было первым карбеновым комплексом, кристаллографически охарактеризованным Фишером в 1967 году (теперь называемый карбеном Фишера ). [13] Первый карбин , также содержащий хром, дебютировал в 1973 году. [14]
Первый пример предложенной пятеркой связи металл-металл обнаружен в соединении типа [CrAr] 2 , где Ar представляет собой объемный арильный лиганд.
Приложения в органическом синтезе [ править ]
Хотя хроморганическая химия широко используется в промышленном катализе, для применения в органическом синтезе разработано относительно немного реагентов . Двумя из них являются реакция Нодзаки-Хияма-Киши (1977 г.) (трансметаллирование с использованием никелевоорганического промежуточного соединения) и олефинирование Такаи (1986 г.) (окисление Cr (II) до Cr (III) при замене галогенов). При использовании ниши определенные комплексы трикарбонил (арен) хрома проявляют бензильную активацию .
Хроморганические соединения [ править ]
Хроморганические соединения можно разделить на эти широкие классы соединений:
- Сэндвич-соединения : хромоцены Cp 2 Cr и бис (бензол) производные хрома (ArH) 2 Cr. Чаще всего изучаются полусэндвич-комплексы, такие как (ArH) Cr (CO) 3 .
- Карбены хрома (R 1 ) (R 2 ) C :: CrL n и карбины (R ::: CrL n )
- Комплексы хрома (III) RCrL 5 . [15]
Полимеризация и олигомеризация этилена [ править ]
Хромовые катализаторы играют важную роль в полимеризации этилена . [16] катализатор Филлипса получает пропитку хрома (VI) , оксид на двуокиси кремния с последующей активацией в сухом воздухе при высоких температурах. Ярко-желтый катализатор восстанавливается этиленом с образованием вероятных разновидностей Cr (II), которые являются каталитически активными. [17] Родственные каталитические системы, разработанные Union Carbide и DSM, также основаны на диоксиде кремния с хромоценом и другими комплексами хрома. Как работают эти катализаторы, неясно. Одна модельная система описывает это как координационную полимеризацию :
С двумя лигандами THF катализатор стабилен, но в дихлорметане один лиганд теряется с образованием хромового промежуточного соединения с 13 электронами. Это позволяет добавлять этиленовые звенья сбоку, и полимерная цепь может расти за счет мигрирующего введения .
Соединения хрома также катализируют тримеризацию этилена с образованием мономера 1-гексена . [18]
Ссылки [ править ]
- ^ Обзор: образования углерод-углеродных связей с участием хроморганических (III) реагентов Furstner, A. Chem. Rev .; (Рассмотрение); 1999 ; 99 (4); 991-1046. DOI : 10.1021 / cr9703360
- ^ Обзор: От Хайна до гексена: последние достижения в химии хроморганических комплексов Jolly, PW Acc. Chem. Res. ; (Статья); 1996 ; 29 (11); 544-551. DOI : 10.1021 / ar9502588
- ^ Notiz über Chromorganoverbindungen (p 195-196) F. Hein Berichte der deutschen chemischen Gesellschaft (серии A и B) Том 52, выпуск 1, страницы 195 - 196 1919 doi : 10.1002 / cber.19190520126
- ^ π-Комплексы переходных металлов. Полиароматические соединения хрома I. Hein Harold H. Zeiss, Minoru Tsutsui J. Am. Chem. Soc. ; 1957 ; 79 (12); 3062-3066. DOI : 10.1021 / ja01569a019
- ^ Zur Frage der Struktur der Chrom-phenyl-Verbindungen. Über Aromatenkomplexe von Metallen VI (стр. 1809-1815) Э. Отто Фишер, Dietlinde Seus Chemische Berichte, том 89, выпуск 8, страницы 1809 - 1815 1956 doi : 10.1002 / cber.19560890803
- ^ Zur Frage der Struktur der Chrom-phenyl-Verbindungen. Bemerkungen zur Abhandlung von EO Fischer und D. Seus (p 1816-1821) Fr. Hein Chemische Berichte, том 89, выпуск 8, страницы 1816 - 1821 1956 doi : 10.1002 / cber.19560890804
- ^ Фишер, EO; Хафнер, WZ Naturforsch. 1953, 8б, 444.
- ^ FAL Anet, E. Leblanc "Новое хроморганическое соединение" J. Am. Chem. Soc. ; 1957 ; 79 (10), 2649-2650. DOI : 10.1021 / ja01567a080
- ^ Восстановление органических галогенидов хромом (II). Механизм образования иона бензилхрома Джей К. Кочи, Деннис Д. Дэвис J. Am. Chem. Soc. ; 1964 ; 86 (23); 5264-5271. DOI : 10.1021 / ja01077a044
- ^ Стереохимия восстановительного элиминирования комплексами хрома (II) Джей К. Кочи, Дэвид М. Синглтон J. Am. Chem. Soc. ; 1968 ; 90 (6); 1582–1589. DOI : 10.1021 / ja01008a032
- ^ Wilke, G. Cyclooligomerisation von Butadien und Übergangsmetall - Komplexe Angewandte Chemie , 1963, том 75, стр. 10-20. DOI : 10.1002 / ange.19630750104
- ^ Фредерик Дж. Кароль, Джордж Л. Карапинка, Чизунг Ву, Алан В. Доу, Роберт Н. Джонсон, Уэйн Л. Каррик Хромоценовые катализаторы для полимеризации этилена: Объем журнала полимеризации Полимерной науки Часть A-1: Химия полимеров 1972 Том 10, выпуск 9, стр. 2621-2637. DOI : 10.1002 / pol.1972.150100910
- ^ Эрнст Отто Фишер, Альфред Maasböl Übergangsmetall-Carben-Komplexe, II. Фенилметоксикарбен- и метилметоксикарбен-пентакарбонил-хром, -молибден, -вольфрам и -циклопентадиенил-дикарбонил-манган Chemische Berichte 1967 Volume 100, pp. 2445-2456 doi : 10.1002 / cber.19671000744
- ^ Эрнст Отто Фишер, Герхард Крайс, Корнелиус Г. Крайтер, Йорн Мюлле, Готфрид Хуттнер, Ганс Лоренц транс-галогено-алкил (арил) карбин-тетракарбонил-Komplexe фон Хрома, Молибден и Вольфрам-Эйнберстюленг-Нойнер-Дунбин Нойердюлен Angewandte Chemie 1973 , том 85, выпуск 14, стр. 618-620. DOI : 10.1002 / ange.19730851407
- ^ Джеймс Х. Эспенсон Химия хроморганических (III) комплексов Acc. Chem. Res. ; 1992, том 25, стр. 222-227. DOI : 10.1021 / ar00017a003
- ^ Клаус Х. Теопольд Хроморганический (III) химия: пренебрежение степенью окисления Acc. Chem. Res. 1990 , том 23, стр. 263-270. DOI : 10.1021 / ar00176a005
- ^ Кеннет С. Уайтли, Т. Джеффри Хеггс, Хартмут Кох, Ральф Л. Мауэр, Вольфганг Иммель (2005). «Полиолефины». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a21_487 .CS1 maint: использует параметр авторов ( ссылка )
- ^ Джон Т. Диксон, Майк Дж. Грин, Фиона М. Хесс, Дэвид Х. Морган «Достижения в селективной тримеризации этилена - критический обзор» Журнал металлоорганической химии 2004 г., том 689, страницы 3641-3668. DOI : 10.1016 / j.jorganchem.2004.06.008