Эта статья требует дополнительных ссылок для проверки . ( декабрь 2019 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
 | |
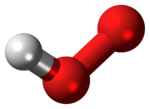 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Гидропероксил | |
| Систематическое название ИЮПАК Диоксиданил | |
| Другие названия Пероксильный радикал, супероксид водорода | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| 506 | |
PubChem CID | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| H O 2 | |
| Молярная масса | 33,006 г · моль -1 |
| Кислотность (p K a ) | 4.88 [1] |
| Основность (p K b ) | 9,12 (основность супероксид-иона) |
| Основание конъюгата | Супероксид анион |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Гидропероксильный радикал радикал , также известный как супероксид водорода , является протонированной формой супероксида с химической формулой HO 2 . Этот вид играет важную роль в атмосфере и как активный вид кислорода в клеточной биологии. [2]
Структура и реакции [ править ]
Молекула имеет изогнутую структуру. [3]
Супероксид-анион, O-
2, а гидропероксильный радикал находится в равновесии в водном растворе :
- О-
2+ H 2 O ⇌ HO 2 + OH -
Р К из HO 2 является 4,88. Следовательно, около 0,3% любого супероксида, присутствующего в цитозоле типичной клетки, находится в протонированной форме. [4]
Он окисляет оксид азота до диоксида азота: [2]
- НЕТ + НО 2 → НЕТ 2 + НО
Активные формы кислорода в биологии [ править ]
Вместе с супероксидом сопряженного основания гидропероксил является важным реактивным кислородом . В отличие от O-
2Обладая восстанавливающими свойствами, HO 2 может действовать как окислитель в ряде биологически важных реакций, таких как отщепление атомов водорода от токоферола и полиненасыщенных жирных кислот в липидном бислое . Таким образом, он может быть важным инициатором перекисного окисления липидов .
Значение для химии атмосферы [ править ]
Газообразный гидропероксил участвует в реакционных циклах, разрушающих стратосферный озон . Он также присутствует в тропосфере, где она по существу является побочным продуктом при окислении окиси углерода и от углеводородов с помощью гидроксильного радикала. [5]
Поскольку диэлектрическая проницаемость оказывает сильное влияние на p K a , а диэлектрическая проницаемость воздуха довольно низкая, супероксид, образующийся (фотохимически) в атмосфере, почти исключительно присутствует в виде H2O 2 . Поскольку H2O 2 является довольно реактивным, он действует как «очиститель» атмосферы, разлагая определенные органические загрязнители. Таким образом, химический состав HO 2 имеет большое геохимическое значение.
Ссылки [ править ]
- ^ "Реакционная способность HO 2 / O- 2Радикалы в водном растворе " . J. Phys. Chem. Ссылочные данные . 14 (4): 1041–1091, 1985. doi : 10.1063 / 1.555739 .
- ^ a b Слышал, Дуэйн Э .; Пиллинг, Майкл Дж. (2003). «Измерение OH и HO 2 в тропосфере». Химические обзоры . 103 (12): 5163–5198. DOI : 10.1021 / cr020522s . PMID 14664647 .
- ^ Лискоу, Дин Х .; Шефер, Генрих Ф. III; Бендер, Чарльз Ф. (1971). «Геометрия и электронная структура гидропероксильного радикала». Журнал Американского химического общества . 93 (25): 6734–7. DOI : 10.1021 / ja00754a003 .
- ^ Де Грей, Обри DNJ (2002). "HO 2 ·: Забытый радикал". ДНК и клеточная биология . 21 (4): 251–257. DOI : 10,1089 / 104454902753759672 . PMID 12042065 .
- ^ "Гидропероксильный радикал" . Глоссарий метеорологии . Американское метеорологическое общество. 25 апреля 2012 . Проверено 22 августа 2013 года .