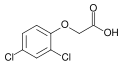
Феноксигербициды (или «фенокси») - это два семейства химических веществ, которые были разработаны как коммерчески важные гербициды , широко используемые в сельском хозяйстве . Они имеют частичную структуру феноксиуксусной кислоты .
Ауксины [ править ]
Первая открытая группа действует, имитируя гормон роста индолуксусную кислоту (ИУК). [1] При опрыскивании широколиственных растений они вызывают быстрый неконтролируемый рост («рост до смерти»). Таким образом, при применении к однодольным ( травяным ) культурам, таким как пшеница или кукуруза , они избирательно уничтожают широколиственные сорняки , оставляя посевы относительно незатронутыми.
Эти гербициды, представленные в 1946 году, к середине 1950-х годов широко использовались в сельском хозяйстве. Наиболее известными феноксигербицидами являются (4-хлор-2-метилфенокси) уксусная кислота ( MCPA ), 2,4-дихлорфеноксиуксусная кислота (2,4-D) и 2,4,5-трихлорфеноксиуксусная кислота (2,4,5- Т). [2] Аналоги каждого из этих трех соединений с дополнительной метильной группой, присоединенной рядом с карбоновой кислотой, впоследствии были коммерциализированы как мекопроп , дихлорпроп и фенопроп . Добавление метильной группы создает хиральнуюцентр в этих молекулах, и биологическая активность обнаруживается только в (2R) -изомере (проиллюстрировано для дихлорпропа). [3]
Другие члены этой группы включают 4- (2,4-дихлорфенокси) масляную кислоту ( 2,4-DB ) и 4- (4-хлор-2-метилфенокси) масляную кислоту ( MCPB ), которые действуют как пропестициды для 2,4- D и MCPA соответственно: то есть они превращаются в растениях в эти активные ингредиенты. [4] Все ауксиновые гербициды сохраняют активность при применении в виде солей и сложных эфиров, поскольку они также способны продуцировать исходную кислоту in situ .
Использование гербицидов в сельском хозяйстве США составлено Геологической службой США. В 2017 году, это последняя дата, на которую имеются данные, 2,4-D был наиболее часто используемым из ауксинов. В том году было распылено 40 000 000 фунтов (18 000 000 кг) [5] по сравнению с 2 000 000 фунтов (910 000 кг) следующего по интенсивности применения, MCPA. [6] Единственным другим ауксином, используемым в сопоставимых количествах, является дикамба , где в 2017 году показатель составлял 18 000 000 фунтов (8 200 000 кг). [7] Это бензойная кислота, а не феноксиуксусная кислота.
Ингибиторы АССазы [ править ]
В 1970-х годах агрохимические компании работали над разработкой новых гербицидов, дополняющих ауксины. Цель состояла в том, чтобы найти материалы, которые позволили бы избирательно бороться с травяными сорняками у широколиственных культур, таких как хлопок и соя .
В 1973 году компания Hoechst AG подала патенты на новый класс соединений, арилоксфеноксипропионаты, которые показали такую селективность и привели к коммерциализации диклофопа. Затем японская компания Ishihara Sangyo Kaisha (ISK) обнаружила улучшенную биологическую активность у аналога хлоразифопа, который заменил арилокси-часть диклофопа пиридиновым кольцом, содержащим те же два заместителя хлора. Эта область исследований стала очень конкурентоспособной, и в течение трех недель одна за другой в 1977 году ISK, Dow Chemicals и Imperial Chemical Industries (ICI) все зарегистрировали патенты, охватывающие другую группу аналогов, на трифторметил (CF 3) вместо одного из атомов хлора в пиридине. Впоследствии ISK и ICI получили перекрестную лицензию на свою интеллектуальную собственность и впервые продали флуазифоп в качестве бутилового эфира в 1981 году под торговой маркой Fusilade, в то время как Dow продавала галоксифоп в качестве метилового эфира. [8] Все эти соединения имеют дополнительный кислород связан ароматическую группу в пара - положении в фенильном кольце с его OCH (CH 3 ) COOH группы , и как класс, называются «FOPS», ссылаясь на их общей fenoxy-фенокси [так в оригинале ] характерная черта. [9]
Эта группа гербицидов действует путем ингибирования растительной ацетил-КоА-карбоксилазы (АССазы), механизма действия , совершенно отличного от механизма действия ауксинов. [10] [11] Их селективность в отношении трав возникает потому , что они нацелены на пластиды изоформы из фермента присутствует только у этих видов, что делает их неэффективными на широколистных сорняков и других организмов , в том числе млекопитающих. [12] При применении в виде сложного эфира метаболизм целевого растения приводит к образованию исходной кислоты, которая отвечает за гербицидное действие. [8] [13] Это совпадение, что это (2R) стереоизомер который связывается с АССазой растений, точно так же, как этот изомер отвечает за активность дихлорпропа как ауксина.
Соли и сложные эфиры этого класса гербицидов активны благодаря их способности метаболизировать до соответствующей исходной кислоты. Например, феноксапроп-П-этил [14] был представлен Bayer Crop Science, а хизалофоп-П-этил - Nissan Chemical Corporation в 1989 году. [15] Флуазифоп-П-бутил [16] до сих пор широко используется в США. В 2017 году было внесено 180000 фунтов (82000 кг) - почти исключительно соевые бобы. [17] Буква «P» в названии этих материалов относится к их использованию в настоящее время в качестве отдельных энантиомеров .
Ссылки [ править ]
- ^ Гроссманн, К. (2010). «Ауксиновые гербициды: текущее состояние механизма и механизма действия». Наука о борьбе с вредителями . 66 (2): 2033–2043. DOI : 10.1002 / ps.1860 . PMID 19823992 .
- ^ Тройер, Джеймс (2001). «В начале: многократное открытие первых гормональных гербицидов». Наука о сорняках . 49 (2): 290–297. DOI : 10,1614 / 0043-1745 (2001) 049 [0290: ITBTMD] 2.0.CO; 2 .
- ^ Wendeborn, S .; Смитс, Х. (31 декабря 2012 г.). «Синтетические ауксины». В Эрике М. Каррейре; Хисаши Ямамото (ред.). Всеобъемлющая хиральность . ISBN 978-0-08-095168-3.
- ↑ Деккер, Джек; Герцог, Стивен О. (1995). Полевые культуры, устойчивые к гербицидам . Успехи в агрономии. 54 . С. 93–94. DOI : 10.1016 / S0065-2113 (08) 60898-6 . ISBN 9780120007547.
- ^ Геологическая служба США (2020-06-18). «Расчетное сельскохозяйственное использование 2,4-Д, 2017» . Проверено 1 марта 2021 .
- ^ Геологическая служба США (2020-06-18). «Предполагаемое сельскохозяйственное использование для МПООПТ, 2017 г.» . Проверено 1 марта 2021 .
- ^ Геологическая служба США (2020-06-18). «Расчетное использование Дикамбы в сельском хозяйстве, 2017 г.» . Проверено 1 марта 2021 .
- ^ а б Эванс, Д. (1992). «Разработка более эффективных гербицидов» (PDF) . Протоколы Первого Международного конгресса по борьбе с сорняками, Мельбурн . С. 37–38 . Проверено 27 февраля 2021 .
- ^ «арилоксифеноксипропионовые гербициды» . alanwood.net . Проверено 27 февраля 2021 .
- ^ Уокер, КА; Ридли, С. М.; Lewis, T .; Харвуд, Дж. Л. (1988). «Флуазифоп, гербицид, селективный для трав, который ингибирует ацетил-КоА-карбоксилазу у чувствительных видов растений» . Биохимический журнал . 254 (1): 307–310. DOI : 10.1042 / bj2540307 . PMC 1135074 . PMID 2902848 .
- ^ Lichtenthaler, Хартмут К. ( , 1990). «Механизм действия гербицидов, влияющих на ацетил-КоА-карбоксилазу и биосинтез жирных кислот» . Zeitschrift für Naturforschung С . 45 (5): 521–528. DOI : 10.1515 / ZnC-1990-0538 . S2CID 27124700 .
- ^ Цена, Линдси Дж .; Герберт, Дерек; Мосс, Стивен Р .; Коул, Дэвид Дж .; Харвуд, Джон Л. (2003). «Нечувствительность к граминицидам коррелирует с кооперативностью связывания гербицидов с изоформами ацетил-КоА-карбоксилазы» . Биохимический журнал . 375 (2): 415–423. DOI : 10.1042 / bj20030665 . PMC 1223688 . PMID 12859251 .
- ^ Уиттингем, Уильям Г. (2016). «Гербицидные арилоксифеноксипропионатные ингибиторы ацетил-КоА-карбоксилазы». Классы биоактивных карбоксильных соединений: фармацевтические и агрохимические препараты . С. 325–337. DOI : 10.1002 / 9783527693931.ch24 . ISBN 9783527339471.
- ^ База данных свойств пестицидов. «Феноксапроп-П-этил» . Университет Хартфордшира . Проверено 2 марта 2021 .
- ^ База данных свойств пестицидов. «Хизалофоп-П-этил» . Университет Хартфордшира . Проверено 2 марта 2021 .
- ^ База данных свойств пестицидов. «Флуазифоп-П-бутил» . Университет Хартфордшира . Проверено 2 марта 2021 .
- ^ Геологическая служба США. «Расчетное использование флуазифопа в сельском хозяйстве, 2017 г.» . Проверено 27 февраля 2021 .