| Фотосистема I | |||||||||
|---|---|---|---|---|---|---|---|---|---|
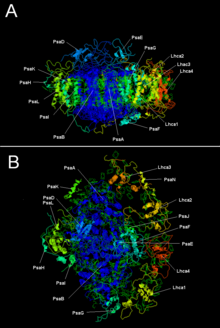 Фотосистема растений I с LHC I | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.97.1.12 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||

Фотосистемы I ( PSI или пластоцианин-ферредоксин оксидоредуктаза ) является одним из двух фотосистем в фотосинтезирующих световых реакциях от водорослей , растений и цианобактерий . Фотосистема I [1] представляет собой интегральный мембранный белковый комплекс, который использует световую энергию для катализирования переноса электронов через тилакоидную мембрану от пластоцианина к ферредоксину.. В конечном итоге электроны, переносимые Фотосистемой I, используются для производства высокоэнергетического носителя НАДФН . [2] Совместное действие всей фотосинтетической цепи переноса электронов также создает протонодвижущую силу, которая используется для генерации АТФ . PSI состоит из более чем 110 кофакторов , что значительно больше, чем Photosystem II . [3]
История [ править ]
Эта фотосистема известна как PSI, потому что она была открыта до Фотосистемы II , хотя будущие эксперименты показали, что Фотосистема II на самом деле является первым ферментом фотосинтетической цепи транспорта электронов. Аспекты PSI были открыты в 1950-х годах, но значение этих открытий еще не было известно. [4] Луи Дуйсенс впервые предложил концепции Фотосистем I и II в 1960 году, и в том же году предложение Фэй Бендалл и Роберта Хилла объединило ранее сделанные открытия в единую теорию последовательных фотосинтетических реакций. [4] Гипотеза Хилла и Бендалла была позже подтверждена в экспериментах, проведенных в 1961 году группами Дуйсенса и Витта. [4]
Компоненты и действие [ править ]
Две основные субъединицы PSI, PsaA и PsaB, являются тесно связанными белками, участвующими в связывании жизненно важных кофакторов переноса электронов P 700 , Acc, A 0 , A 1 и F x . PsaA и PsaB являются интегральными мембранными белками из 730-750 аминокислот, которые содержат 11 трансмембранных сегментов. Кластер [4Fe-4S] железо-сера, называемый F x , координируется четырьмя цистеинами ; каждый из двух цистеинов обеспечивается PsaA и PsaB. Два цистеина в каждом проксимальны и расположены в петле между девятым и десятым.трансмембранные сегменты. Лейциновая молния мотив , кажется, присутствуем [5] ниже по течению от цистеинов и может способствовать димеризациям PSAA / PsaB. Терминал акцепторов электронов Р и Р Б , а также [4Fe-4S] кластеры железа-серы , расположены в белке 9-кДа называется PSAC , который связывается с ядром PsaA / PsaB вблизи F X . [6] [7]
| Белковые субъединицы | Описание |
|---|---|
| PsaA | Родственные большие трансмембранные белки, участвующие в связывании P700, A0, A1 и Fx. Часть семейства белков фотосинтетического реакционного центра . |
| PsaB | |
| PsaC | Железно-серный центр; апопротеин для F a и F b |
| PsaD | Необходим для сборки, способствует связыванию ферредоксина. InterPro : IPR003685 |
| PsaE | InterPro : IPR003375 |
| Псай | Может стабилизировать PsaL. Стабилизирует связывание светособирающего комплекса II. [9] InterPro : IPR001302 |
| PsaJ | InterPro : IPR002615 |
| Псак | ИнтерПро : IPR035982 |
| PsaL | ИнтерПро : IPR036592 |
| PsaM | ИнтерПро : IPR010010 |
| PsaX | ИнтерПро : IPR012986 |
| цитохром b 6 f комплекс | Растворимый белок |
| F a | Из PsaC; В цепи переноса электронов (ETC) |
| F b | Из PsaC; В ETC |
| F x | Из PsaAB; В ETC |
| Ферредоксин | Электронный носитель в ETC |
| Пластоцианин | Растворимый белок |
| Липиды | Описание |
| МГДГ II | Липид моногалактозилдиглицерида |
| PG I | Фосфатидилглицерин фосфолипид |
| PG III | Фосфатидилглицерин фосфолипид |
| PG IV | Фосфатидилглицерин фосфолипид |
| Пигменты | Описание |
| Хлорофилл а | 90 молекул пигмента в антенной системе |
| Хлорофилл а | 5 молекул пигмента в ETC |
| Хлорофилл а 0 | Ранний акцептор электронов модифицированного хлорофилла в ETC |
| Хлорофилл а ' | 1 молекула пигмента в ETC |
| β-каротин | 22 молекулы каротиноидного пигмента |
| Коферменты и кофакторы | Описание |
| Q K -A | Ранний акцептор электронов витамин K 1 филлохинон в ETC |
| Q K -B | Ранний акцептор электронов витамин K 1 филлохинон в ETC |
| FNR | Ферредоксин- НАДФ+ фермент оксидоредуктаза |
| Ca2+ | Ион кальция |
| Mg2+ | Ион магния |
Фотон [ править ]
Фотовозбуждение молекул пигмента в антенном комплексе вызывает перенос электронов. [10]
Антенный комплекс [ править ]
Антенный комплекс состоит из молекул хлорофилла и каротиноидов, закрепленных на двух белках. [11] Эти молекулы пигмента передают резонансную энергию фотонов, когда они фотовозбуждены. Молекулы антенны могут поглощать все длины волн света в видимом спектре . [12] Количество этих молекул пигмента варьируется от организма к организму. Например, цианобактерия Synechococcus elongatus ( Thermosynechococcus elongatus ) содержит около 100 хлорофиллов и 20 каротиноидов, тогда как хлоропласты шпината содержат около 200 хлорофиллов и 50 каротиноидов.[12] [3] Внутри антенного комплекса PSI находятся молекулы хлорофилла, называемыереакционными центрами P700 . Энергия, передаваемая молекулами антенны, направляется в реакционный центр. В P700 может быть от 120 до 25 молекул хлорофилла. [13]
Центр реагирования P700 [ править ]
Р700 реакционный центр состоит из модифицированного хлорофилла а , который лучше всего поглощает свет при длине волны 700 нм , с более высокими длинами волн вызывает обесцвечивание. [14] P700 получает энергию от молекул антенны и использует энергию каждого фотона, чтобы поднять электрон на более высокий энергетический уровень. Эти электроны попарно перемещаются в процессе окисления / восстановления от P700 к акцепторам электронов. P700 имеет электрический потенциал около -1,2 вольт . Реакционный центр состоит из двух молекул хлорофилла и поэтому называется димером . [11] Считается, что димер состоит из одного хлорофилла а.молекула и одна молекула хлорофилла a '(P700, webber). Однако, если P700 образует комплекс с другими молекулами антенны, он больше не может быть димером. [13]
Модифицированный хлорофилл A 0 и A 1 [ править ]
Две модифицированные молекулы хлорофилла являются ранними акцепторами электронов в PSI. Они присутствуют по одному на каждой стороне PsaA / PsaB, образуя две ветви, по которым электроны могут достичь F x . A 0 принимает электроны от P700, передает их A 1 с той же стороны, который затем передает электрон хинону с той же стороны. Кажется, что разные виды имеют разные предпочтения к той или иной ветви A / B. [15]
Филлохинон [ править ]
Phylloquinone является следующим рано акцептором электронов в PSI. Филлохинон также иногда называют витамином K 1 . [16] Филлохинон окисляет A 1 , чтобы получить электрон, и, в свою очередь, уменьшает F x , чтобы передать электрон F b и F a . [16] [17] Уменьшение F x , по-видимому, ограничивает скорость. [15]
Железо-серный комплекс [ править ]
В ФСI обнаружены три белковых реакционных центра железо-сера . Обозначенные F x , F a и F b , они служат в качестве электронных реле. [18] F a и F b связаны с белковыми субъединицами комплекса PSI, а F x связан с комплексом PSI. [18] Различные эксперименты показали некоторое несоответствие между теориями ориентации кофактора железа и серы и порядком работы. [18] Одна из моделей состоит в том, что F x передает электрон F a , который передает его F b, чтобы достичь ферредоксина. [15]
Ферредоксин [ править ]
Ферредоксин (Fd) - растворимый белок, который способствует снижению НАДФ.+
в НАДФН. [19] Fd перемещается, чтобы переносить электрон либо к одиночному тилакоиду, либо к ферменту, который восстанавливает НАДФ.+
. [19] Тилакоидные мембраны имеют по одному сайту связывания для каждой функции Fd. [19] Основная функция Fd - переносить электрон от комплекса железо-сера к ферменту ферредоксин- НАДФ.+редуктаза . [19]
Ферредоксин - НАДФ+
редуктаза (FNR) [ править ]
Этот фермент передает электрон от восстановленного ферредоксина к НАДФ.+
для завершения восстановления до НАДФН. [20] FNR также может принимать электрон от NADPH, связываясь с ним. [20]
Пластоцианин [ править ]
Пластоцианин - это переносчик электронов, который переносит электрон от цитохрома b6f к кофактору P700 PSI. [10] [21]
Белковый домен Ycf4 [ править ]
Домен Ycf4 белка находится на тилакоидах мембраны и имеет жизненно важное значение для фотосистемы I. Это тилакоиды трансмембранного белок помогает собрать компоненты фотосистемы I, без него, фотосинтез будет неэффективным. [22]
Эволюция [ править ]
Молекулярные данные показывают, что PSI, вероятно, произошла от фотосистем зеленых серных бактерий . Фотосистемы зеленых серных бактерий и цианобактерий , водорослей и высших растений не совпадают, однако существует множество аналогичных функций и похожих структур. У разных фотосистем схожи три основных свойства. [23] Во-первых, окислительно-восстановительный потенциал достаточно отрицательный, чтобы снизить уровень ферредоксина. [23] Далее, электроноакцепторные реакционные центры включают белки железо-сера. [23] Наконец, окислительно-восстановительные центры в комплексах обеих фотосистем построены на димере белковой субъединицы. [23]Фотосистема зеленых серных бактерий даже содержит все те же кофакторы цепи переноса электронов в PSI. [23] Количество и степень сходства между двумя фотосистемами убедительно указывает на то, что PSI происходит от аналогичной фотосистемы зеленых серных бактерий.
См. Также [ править ]
- Биогибридный солнечный элемент
Ссылки [ править ]
- ^ Golbeck JH (1987). «Структура, функции и организация комплекса реакционного центра Фотосистемы I». Biochimica et Biophysica Acta (BBA) - Обзоры по биоэнергетике . 895 (3): 167–204. DOI : 10.1016 / s0304-4173 (87) 80002-2 . PMID 3333014 .
- ^ Yamori W, Shikanai T (апрель 2016). «Физиологические функции циклического транспорта электронов вокруг фотосистемы I в поддержании фотосинтеза и роста растений». Ежегодный обзор биологии растений . 67 : 81–106. DOI : 10,1146 / annurev-arplant-043015-112002 . PMID 26927905 .
- ^ a b Nelson N, Yocum CF (2006). «Строение и функции фотосистем I и II». Ежегодный обзор биологии растений . 57 : 521–65. DOI : 10.1146 / annurev.arplant.57.032905.105350 . PMID 16669773 .
- ^ a b c Фромм П., Матис П. (2004). «Раскрытие реакционного центра фотосистемы I: история или сумма многих усилий». Фотосинтез Исследования . 80 (1–3): 109–24. DOI : 10,1023 / Б: PRES.0000030657.88242.e1 . PMID 16328814 . S2CID 13832448 .
- Перейти ↑ Webber AN, Malkin R (май 1990 г.). «Белки реакционного центра Фотосистемы I содержат мотивы лейциновой молнии. Предполагаемая роль в образовании димеров» . Письма FEBS . 264 (1): 1–4. DOI : 10.1016 / 0014-5793 (90) 80749-9 . PMID 2186925 . S2CID 42294700 .
- ^ Jagannathan B, Golbeck JH (апрель 2009). «Нарушение биологической симметрии в мембранных белках: асимметричная ориентация PsaC на псевдо-C2 симметричном ядре Фотосистемы I». Клеточные и молекулярные науки о жизни . 66 (7): 1257–70. DOI : 10.1007 / s00018-009-8673-х . PMID 19132290 . S2CID 32418758 .
- ^ Jagannathan B, Golbeck JH (июнь 2009). «Понимание интерфейса связывания между PsaC и гетеродимером PsaA / PsaB в фотосистеме I». Биохимия . 48 (23): 5405–16. DOI : 10.1021 / bi900243f . PMID 19432395 .
- ^ Saenger W, Jordan P, Krauss N (апрель 2002). «Сборка белковых субъединиц и кофакторов в фотосистеме I». Текущее мнение в структурной биологии . 12 (2): 244–54. DOI : 10.1016 / S0959-440X (02) 00317-2 . PMID 11959504 .
- ^ Плехингер, Магдалена; Тораби, Салар; Рантала, Марджаана; Тикканен, Микко; Суорса, Марджаана; Дженсен, Пол-Эрик; Аро, Ева Мари; Мерер, Йорг (сентябрь 2016 г.). «Белок с низким молекулярным весом PsaI стабилизирует сайт фиксации светособирающего комплекса II фотосистемы I» . Физиология растений . 172 (1): 450–463. DOI : 10.1104 / pp.16.00647 . PMC 5074619 . PMID 27406169 .
- ^ a b Raven PH, Evert RF, Eichhorn SE (2005). «Фотосинтез, свет и жизнь». Биология растений (7-е изд.). Нью-Йорк: WH Freeman. С. 121–127 . ISBN 978-0-7167-1007-3.
- ^ а б Zeiger E, Taiz L (2006). «Глава 7: Тема 7.8: Фотосистема I» . Физиология растений (4-е изд.). Сандерленд, Массачусетс: Sinauer Associates. ISBN 0-87893-856-7.
- ^ а б «Фотосинтетический процесс» . Архивировано из оригинала на 2009-02-19.
- ^ a b Шубин В.В., Карапетян Н.В., Красновский А.А. (январь 1986 г.). «Молекулярное устройство пигментно-белкового комплекса фотосистемы 1». Фотосинтез Исследования . 9 (1–2): 3–12. DOI : 10.1007 / BF00029726 . PMID 24442279 . S2CID 26158482 .
- ^ Rutherford AW, Heathcote P (декабрь 1985). «Первичная фотохимия в фотосистеме-I». Фотосинтез Исследования . 6 (4): 295–316. DOI : 10.1007 / BF00054105 . PMID 24442951 . S2CID 21845584 .
- ^ a b c Grotjohann, I; Фромм, П. (2013). «Фотосистема I». Энциклопедия биологической химии (Второе изд.). Лондон. С. 503–507. DOI : 10.1016 / B978-0-12-378630-2.00287-5 . ISBN 978-0-12-378630-2.
- ^ а б Ито С, Иваки М (1989). «Витамин К 1 (филлохинон) восстанавливает обмен FeS-центров в частицах PSI шпината, экстрагированных эфиром» . Письма FEBS . 243 (1): 47–52. DOI : 10.1016 / 0014-5793 (89) 81215-3 . S2CID 84602152 .
- ↑ Palace GP, Franke JE, Warden JT (май 1987). «Является ли филлохинон облигатным переносчиком электронов в фотосистеме I?» . Письма FEBS . 215 (1): 58–62. DOI : 10.1016 / 0014-5793 (87) 80113-8 . PMID 3552735 . S2CID 42983611 .
- ^ a b c Васильев И.Р., Антонкин М.Л., Голбек Дж. Х. (октябрь 2001 г.). «Кластеры железо-сера в реакционных центрах I типа». Biochimica et Biophysica Acta (BBA) - Биоэнергетика . 1507 (1–3): 139–60. DOI : 10.1016 / S0005-2728 (01) 00197-9 . PMID 11687212 .
- ^ a b c d Forti G, Мария П., Грубас Г. (1985). «Два сайта взаимодействия ферредоксина с тилакоидами». Письма FEBS . 186 (2): 149–152. DOI : 10.1016 / 0014-5793 (85) 80698-0 . S2CID 83495051 .
- ^ a b Мадос Дж, Фернандес Ресио Дж, Гомес Морено С., Фернандес В.М. (ноябрь 1998 г.). «Исследование диафоразной реакции ферредоксина- НАДФ.+Редуктазы с помощью электрохимических методов» (PDF) . Биоэлектрохимия и биоэнергетики . 47 (1):. 179-183 DOI : 10.1016 / S0302-4598 (98) 00175-5 .
- ↑ Надежда AB (январь 2000 г.). «Электронные переходы между цитохромом f, пластоцианином и фотосистемой I: кинетика и механизмы». Biochimica et Biophysica Acta (BBA) - Биоэнергетика . 1456 (1): 5–26. DOI : 10.1016 / S0005-2728 (99) 00101-2 . PMID 10611452 .
- ^ Будро E, Takahashi Y, Лемье C, M Turmel, Роше JD (октябрь 1997). «Открытые рамки считывания хлоропластов ycf3 и ycf4 Chlamydomonas reinhardtii необходимы для накопления комплекса фотосистемы I» . Журнал EMBO . 16 (20): 6095–104. DOI : 10.1093 / emboj / 16.20.6095 . PMC 1326293 . PMID 9321389 .
- ^ a b c d e Lockau W, Nitschke W (1993). «Фотосистема I и ее бактериальные аналоги». Physiologia Plantarum . 88 (2): 372–381. DOI : 10.1111 / j.1399-3054.1993.tb05512.x .
Внешние ссылки [ править ]
- Фотосистема I: молекула месяца в банке данных о белках
- Фотосистема I в дополнении к физиологии растений
- Джеймс Барбер FRS Photosystems I и II
