 | |
| Имена | |
|---|---|
| Название ИЮПАК Оксид плутония (IV) | |
| Систематическое название ИЮПАК Оксид плутония (4+) | |
| Другие названия Диоксид плутония | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.031.840 |
| Номер ЕС |
|
PubChem CID | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| O 2 Pu | |
| Молярная масса | 276 г · моль -1 |
| Появление | Темно-желтые кристаллы |
| Плотность | 11,5 г см −3 |
| Температура плавления | 2744 ° С (4971 ° F, 3017 К) |
| Точка кипения | 2800 ° С (5070 ° F, 3070 К) |
| Состав | |
| Флюорит (кубический), cF12 | |
| Фм 3 м, №225 | |
| Тетраэдрический (O 2- ); кубический (Pu IV ) | |
| Опасности | |
| Основные опасности | Радиоактивный |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | негорючий |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Оксид плутония (IV) представляет собой химическое соединение с формулой PuO 2 . Это твердое вещество с высокой температурой плавления является основным соединением плутония . Цвет может варьироваться от желтого до оливково-зеленого, в зависимости от размера частиц, температуры и метода производства. [1]
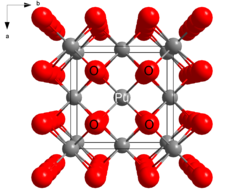
Структура [ править ]
PuO 2 кристаллизуется во флюоритовом мотиве, при этом центры Pu 4+ организованы в гранецентрированный кубический массив, а оксидные ионы занимают тетраэдрические дырки. [2] PuO 2 обязан своей полезностью в качестве ядерного топлива тому факту, что вакансии в октаэдрических дырках оставляют место для продуктов деления. При делении ядра один атом плутония распадается на два. Вакансия октаэдрических отверстий обеспечивает место для нового продукта и позволяет монолиту PuO 2 сохранять свою структурную целостность. [ необходима цитата ]
Свойства [ править ]
Диоксид плутония - это стабильный керамический материал с чрезвычайно низкой растворимостью в воде и высокой температурой плавления (2744 ° C). В 2011 году температура плавления была повышена на несколько сотен градусов на основании данных исследований быстрого лазерного плавления, позволяющих избежать загрязнения любым материалом контейнера. [3]
Из-за радиоактивного альфа-распада плутония PuO 2 теплый на ощупь. Как и все соединения плутония , он подлежит контролю в соответствии с Договором о нераспространении ядерного оружия .
Синтез [ править ]
Металлический плутоний самопроизвольно окисляется до PuO 2 в атмосфере кислорода. Диоксид плутония в основном получают прокаливанием оксалата плутония (IV), Pu (C 2 O 4 ) 2 · 6H 2 O, при 300 ° C. Оксалат плутония получается при переработке ядерного топлива, когда плутоний растворяется в HNO 3 / HF. [4] Диоксид плутония также может быть извлечен из реакторов-размножителей с расплавом солей путем добавления карбоната натрия к топливной соли после того, как любой оставшийся уран будет удален из соли в виде его гексафторида.
Приложения [ править ]
PuO 2 , наряду с UO 2 , используется в МОКС-топливе для ядерных реакторов . Двуокись плутония-238 используется в качестве топлива для нескольких космических аппаратов дальнего космоса, таких как зонды Cassini , Voyager , Galileo и New Horizons Pluto, а также марсоходов Curiosity и Perseverance на Марсе . Изотоп распадается, испуская α-частицы, которые затем выделяют тепло (см. Радиоизотопный термоэлектрический генератор). Высказывались опасения, что случайное возвращение в атмосферу Земли с орбиты может привести к поломке и / или возгоранию космического корабля, что приведет к рассеянию плутония либо по большому участку поверхности планеты, либо к в верхних слоях атмосферы. Однако, хотя по крайней мере два космических корабля с РИТЭГами из PuO 2 повторно вошли в атмосферу Земли и сгорели («Нимбус В-1» в мае 1968 г. и лунный модуль « Аполлон-13» в апреле 1970 г.) [5] [6] РИТЭГи с обоих космических кораблей уцелели. повторный вход и удар не повреждены, и ни в одном случае не было отмечено никакого загрязнения окружающей среды; в любом случае РИТЭГи с середины 1960-х годов проектировались таким образом, чтобы они оставались неповрежденными в случае повторного входа в атмосферу и удара после неудачного запуска в 1964 году.Транзит 5-БН-3 (находящийся на борту плутоний-металлический РИТЭГ раннего поколения распался при входе в атмосферу и выбросил радиоактивный материал в атмосферу к северу от Мадагаскара , что привело к модернизации всех американских РИТЭГов, которые в то время использовались или разрабатывались). [7]
Физик Питер Циммерман, следуя предложению Теда Тейлора , продемонстрировал, что ядерное оружие малой мощности (1 килотонна ) можно относительно легко сделать из оксида плутония. [8] Бомба из оксида плутония имела бы значительно большую критическую массу, чем бомба, сделанная из металлического плутония (почти в три раза больше, даже с оксидом с максимальной кристаллической плотностью; если бы оксид был в форме порошка, как это часто встречается, критическая масса будет намного выше), как из-за более низкой плотности плутония в PuO 2 по сравнению с металлическим плутонием, так и из-за добавленной инертной массы содержащегося кислорода. [9]
Токсикология [ править ]
Поведение оксида плутония в организме зависит от способа его приема. Поскольку он нерастворим, при проглатывании очень большой процент его довольно быстро выводится из организма с выделениями. [10] В виде частиц оксид плутония с размером частиц менее 10 микрометров (0,01 мм) [11] токсичен при вдыхании из-за своего альфа-излучения. [12]
См. Также [ править ]
- Международное агентство по атомной энергии
Ссылки [ править ]
- ^ «Обработка азотной кислоты» . Лос-Аламосская лаборатория.
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1984). Химия элементов . Оксфорд: Pergamon Press . п. 1471. ISBN 978-0-08-022057-4.
- ^ Де Брюйкер, Ф .; Boboridis, K .; Pöml, P .; Eloirdi, R .; Konings, RJM; Манара, Д. (2011). "Поведение при плавлении диоксида плутония: исследование лазерного нагрева". Журнал ядерных материалов . 416 (1–2): 166–172. Bibcode : 2011JNuM..416..166D . DOI : 10.1016 / j.jnucmat.2010.11.030 .
- ^ Джеффри А. Каталенич Майкл Р. Хартман Роберт С. О'Брайен Стивен Д. Хау (февраль 2013 г.). «Изготовление микросфер из оксида церия и урана для применения в космической ядерной энергетике» (PDF) . Труды по ядерным и новейшим космическим технологиям 2013 : 2.
- ↑ А. Анджело-младший и Д. Буден (1985). Космическая ядерная энергетика . Krieger Publishing Company. ISBN 0-89464-000-3.
- ^ «Общие соображения безопасности» (конспекты лекций в формате PDF) . Институт технологии термоядерного синтеза Университета Висконсин-Мэдисон . Весна 2000 г.
- ^ «Транзит» . Энциклопедия Astronautica . Проверено 7 мая 2013 .
- ^ Майкл Сингер; Дэвид Вейр и Барбара Ньюман Кэнфилд (26 ноября 1979 г.). «Ядерный кошмар: сбылись худшие опасения Америки». Журнал "Нью-Йорк".
- ^ Sublette, Кэри. «4.1 Элементы конструкции оружия деления» . Архив ядерного оружия . 4.1.7.1.2.1 Оксид плутония . Проверено 20 октября 2017 года .
Критическая масса реакторного плутония составляет около 13,9 кг (неотраженный) или 6,1 кг (10 см естественного U) при плотности 19,4.
Таким образом, прессованный порошок с плотностью 8 будет иметь критическую массу, которая в (19,4 / 8) ^ 2 раза выше: 82 кг (неотраженный) и 36 кг (отраженный), не считая веса кислорода (который добавляет еще 14 кг). %).
При сжатии до кристаллической плотности эти значения падают до 40 кг и 17,5 кг.
- ^ Комиссия по ядерному регулированию США, Информационный бюллетень по плутонию (по состоянию на 29 ноября 2013 г.)
- ↑ World Nuclear Society, Plutonium (по состоянию на 29 ноября 2013 г.)
- ^ «Токсикологический профиль плутония» (PDF) . Министерство здравоохранения и социальных служб США. 2007-09-27 . Проверено 23 апреля 2009 .
Внешние ссылки [ править ]
- Безопасность космических радиоизотопных энергетических систем
