 | |
| Имена | |
|---|---|
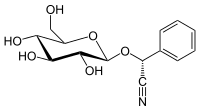
| Предпочтительное название IUPAC (2 R ) -Фенил {[(2 R , 3 R , 4 S , 5 S , 6 R ) -3,4,5-тригидрокси-6- (гидроксиметил) оксан-2-ил] окси} ацетонитрил | |
| Другие имена ( R ) -Прунасин D -Прунасин D- Манделонитрил-β- D- глюкозид Прулауразин Лауроцеразин Самбунигрин | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.002.489 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C 14 H 17 N O 6 | |
| Молярная масса | 295,291 г · моль -1 |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
( R ) -прунасин представляет собой цианогенный гликозид, родственный амигдалину . По химическому составу это глюкозид ( R ) - манделонитрила .
Природные явления [ править ]
Прунасин встречается у видов рода Prunus, таких как Prunus japonica или P. maximowiczii, а также в горьком миндале . [1] Он также обнаружен в листьях и стеблях Olinia ventosa , O. radiata , O. emarginata и O. rochetiana [2] и у Acacia greggii . Это биосинтетический предшественник и промежуточный продукт в биосинтезе амигдалина , химического соединения, ответственного за вкус горького миндаля .
Он также содержится в кофе из одуванчиков , заменителе кофе.
Самбунигрин [ править ]
Самбунигрин, диастереомер пруназина, полученный из ( S ) -манделонитрила вместо ( R ) -изомера, был выделен из листьев бузины ( Sambucus nigra ). [3] Самбунигрин присутствует в листьях и стеблях бузины в соотношении 1: 3 самбунигрина к пруназину и 2: 5 в незрелых семенах. [4] Его нет в корне. [4]
Биосинтез [ править ]
Обзор [ править ]
( R ) -прунасин начинается с общей аминокислоты фенилаланина , который в растениях продуцируется путем шикимата в первичном метаболизме . Этот путь катализируется в основном двумя ферментами цитохрома P450 (CYP) и UDP-глюкозилтрансферазой ( UGT ). После образования ( R ) -пруназина он либо превращается в амигдалин с помощью дополнительной UDP-глюкозилтрансферазы, либо разлагается на бензальдегид и цианистый водород.
Исследователи показали, что накопление (или отсутствие) пруназина и амигдалина в ядре миндаля является причиной сладких и горьких генотипов. [1] Поскольку амигдалин отвечает за горький миндальный вкус, производители миндаля выбрали генотипы, которые минимизируют биосинтез амидгалина. Ферменты CYP, ответственные за образование prunasin, консервативны у всех видов Prunus . [5] Существует корреляция между высокой концентрацией чернослива в вегетативных регионах растения и сладостью миндаля, что имеет отношение к миндальной сельскохозяйственной отрасли. В миндале, то амигдалин биосинтетических гены , которые выражаютсяна разных уровнях тегумента (материнская ткань или внешняя часть) и семядоли (ядра или отцовской ткани) и значительно различаются в онтогенезе миндаля . [1] [6] [7] Биосинтез прунасина происходит в тегументе, затем транспортируется в другие ткани для преобразования в амигдалин или деградации. [1] [5]
Биосинтез ( R ) -прунасина [ править ]
Биосинтез ( R ) -пруназина в Prunus dulcis [ править ]
L-фенилаланин сначала гидроксилируется CYP79D16 с последующим декарбоксилированием и дегидратацией с образованием фенилацетальдоксима E- оксима. [8] Далее, CYP71AN24 катализирует перегруппировку E- оксима в Z- оксим с последующей дегидратацией и гидроксилированием с образованием манделонитрила. [8] Наконец, UGT85A19 или UGT94AF3 используют UDP-глюкозу для гликозилирования манделонитрила с образованием ( R ) -пруназина. [1]
После образования ( R ) -прунасина продукт далее гликозилируется в амидгалин либо изоформой UGT94AF1, либо UGT94AF2. [1] Экспрессия UGTAF1 / 2 и пруназин гидролаз приводит к низкой общей концентрации ( R ) -пруназина в тканях миндаля. Важно отметить, что альфа- глюкозидаза или пруназингидролаза могут превращать ( R ) -пруназин в его предшественник минделонитрил, который затем может спонтанно или ферментативно гидролизоваться до бензальдегида и цианистого водорода. [9]
Биосинтез ( R ) -пруназина в Eucalyptus cladocalyx [ править ]
Было показано , что биосинтез ( R ) -пруназина в E. cladocalyx , дереве сахарной камеди , синтезирует ( R ) -пруназин с использованием дополнительного промежуточного соединения, фенилацетонитрила , с использованием CYP706C55. [10] Путь протекает аналогично пути у видов Prunus , где многофункциональный CYP79A125 катализирует превращение L-фенилаланина в фенилацетальдоксим. Затем CYP706C55 катализирует дегидратацию фенилацетальдоксима до фенилацетонитрила. Фенилацетонитрили затем гидроксилируют по CYP71B103 в миндальном . После образования миндонитрила UGT85A59 переводит глюкозу в выход ( R) -прунасин. [10]
Взаимодействия метаболических путей [ править ]
Поскольку ( R ) -пруназин является продуктом вторичного метаболизма, его образование и распад влияют на несколько метаболических путей, потребляя L-фенилаланин или увеличивая количество бензальдегида и токсичного цианистого водорода через деградацию пруназина.
Метаболическое профилирование миндаля, маниоки и сорго выявило потенциальный механизм рециркуляции, при котором ( R ) -пруназин и другие цианогликозиды могут использоваться для хранения азота и рециркуляции азота без образования HCN. [11] В 2017 году исследователи использовали метку стабильных изотопов, чтобы продемонстрировать, что 13 C-меченый L-фенилаланин, включенный в ( R ) -прунасин, может быть преобразован в бензальдегид и салициловую кислоту с использованием манделонитрила в качестве промежуточного соединения. [12]
Токсичность [ править ]
Токсичность пруназина основана на продуктах его распада: ( R ) -прунасин гидролизуется с образованием бензальдегида и цианистого водорода , что вызывает токсичность. Следовательно, растения, содержащие чернослив, могут быть токсичными для животных, особенно для жвачных . [13]
Чтобы расщепить амигдалин до пруназина, амигдалин-бета-глюкозидаза гидролизует дисахарид с образованием ( R ) -пруназина и D- глюкозы. Затем пруназин бета-глюкозидазы использования ( R ) -prunasin и водой для получения D - глюкозы и миндальной кислоты . После генерации агликоновый миндальной , затем миндальной лиазы может ухудшить соединение в бензальдегид и цианистый водород .
Ссылки [ править ]
- ^ a b c d e f Санчес-Перес, Ракель; Бельмонте, Фара Саес; Борх, Йонас; Дисента, Федерико; Мёллер, Биргер Линдберг; Йоргенсен, Кирстен (апрель 2012 г.). «Гидролазы пруназина во время развития плодов сладкого и горького миндаля» . Физиология растений . 158 (4): 1916–1932. DOI : 10.1104 / pp.111.192021 . ISSN 0032-0889 . PMC 3320195 . PMID 22353576 .
- ^ Nahrstedt, Адольф; Рокенбах, Юрген (1993). «Встречаемость цианогенного глюкозида prunasin и II соответствующего амида глюкозида миндальной кислоты у видов Olinia (oliniaceae)». Фитохимия . 34 (2): 433. DOI : 10.1016 / 0031-9422 (93) 80024-M .
- ^ Эндрю Пенгелли (2004), Составляющий лекарственных растений (2 - й изд.), Allen & Анвины, стр. 44-45, ISBN 978-1-74114-052-1
- ^ a b Миллер, Ребекка Э .; Gleadow, Roslyn M .; Вудроу, Ян Э. (2004). «Цианогенез в тропических Prunus turneriana: характеристика, вариация и реакция на слабое освещение» . Функциональная биология растений . 31 (5): 491–503. DOI : 10.1071 / FP03218 . ISSN 1445-4408 . PMID 32688921 .
- ^ a b Тодберг, Сара; Дель Куэто, Хорхе; Маццео, Роза; Паван, Стефано; Лотти, Кончетта; Дисента, Федерико; Якобсен Нейлсон, Элизабет Х .; Мёллер, Биргер Линдберг; Санчес-Перес, Ракель (ноябрь 2018 г.). «Выяснение пути амигдалина раскрывает метаболическую основу горького и сладкого миндаля (Prunus dulcis) 1 [ОТКРЫТО]» . Физиология растений . 178 (3): 1096–1111. DOI : 10.1104 / pp.18.00922 . ISSN 0032-0889 . PMC 6236625 . PMID 30297455 .
- ^ Санчес-Перес, Ракель; Йоргенсен, Кирстен; Олсен, Карл Эрик; Дисента, Федерико; Мёллер, Биргер Линдберг (март 2008 г.). «Горечь в миндале» . Физиология растений . 146 (3): 1040–1052. DOI : 10.1104 / pp.107.112979 . ISSN 0032-0889 . PMC 2259050 . PMID 18192442 .
- ^ Нейлсон, Элизабет Х .; Гуджер, Джейсон QD; Мотавиа, Мохаммед Саддик; Бьярнхольт, Нанна; Фриш, Тина; Олсен, Карл Эрик; Мёллер, Биргер Линдберг; Вудро, Ян Э. (декабрь 2011 г.). «Цианогенные диглюкозиды, производные фенилаланина из камфорного эвкалипта, и их количество в зависимости от онтогенеза и типа ткани» . Фитохимия . 72 (18): 2325–2334. DOI : 10.1016 / j.phytochem.2011.08.022 .
- ^ a b Ямагути, Такуя; Ямамото, Кадзунори; Асано, Ясухиса (сентябрь 2014 г.). «Идентификация и характеристика CYP79D16 и CYP71AN24, катализирующих первый и второй этапы биосинтеза цианогенных гликозидов на основе l-фенилаланина в японском абрикосе Prunus mume Sieb. Et Zucc» . Молекулярная биология растений . 86 (1–2): 215–223. DOI : 10.1007 / s11103-014-0225-6 . ISSN 0167-4412 . PMID 25015725 . S2CID 14884838 .
- ^ Чжоу, Джиминг; Хартманн, Стефани; Shepherd, Brianne K .; Поултон, Джонатан Э. (01.07.2002). "Исследование микрогетерогенности и специфичности агликонов остатков гидролаз пруназина черной вишни" . Физиология растений . 129 (3): 1252–1264. DOI : 10.1104 / pp.010863 . ISSN 0032-0889 . PMC 166519 . PMID 12114579 .
- ^ a b Хансен, Сесили Сетти; Соренсен, Метте; Вейга, Тьяго А.М.; Зибрандцен, Юлиана Ф.С.; Heskes, Allison M .; Олсен, Карл Эрик; Boughton, Berin A .; Мёллер, Биргер Линдберг; Нейлсон, Элизабет HJ (ноябрь 2018 г.). «Перенастроенный биосинтез цианогенных глюкозидов в кладокаликсе эвкалипта с участием цитохрома P450 CYP706C55» . Физиология растений . 178 (3): 1081–1095. DOI : 10.1104 / pp.18.00998 . ISSN 0032-0889 . PMC 6236593 . PMID 30297456 .
- ^ Пичманова, Мартина; Нейлсон, Элизабет Х .; Motawia, Mohammed S .; Олсен, Карл Эрик; Агербирк, Нильс; Грей, Кристофер Дж .; Флитч, Сабина; Мейер, Себастьян; Сильвестро, Даниэле; Йоргенсен, Кирстен; Санчес-Перес, Ракель (1 августа 2015 г.). «Путь рециркуляции цианогенных гликозидов, подтвержденный сравнительным метаболическим профилем трех видов цианогенных растений» . Биохимический журнал . 469 (3): 375–389. DOI : 10.1042 / BJ20150390 . ISSN 0264-6021 .
- ^ Диас-Виванкос, Педро; Берналь-Висенте, Агустина; Кантабелла, Даниэль; Петри, Сезар; Эрниендес, Хосин Антонио (2017-12-01). «Метаболомика и биохимические подходы связывают биосинтез салициловой кислоты с цианогенезом у растений персика» . Физиология растений и клеток . 58 (12): 2057–2066. DOI : 10.1093 / PCP / pcx135 . ISSN 0032-0781 .
- ^ Питер Р. Cheeke (1989). Токсиканты растительного происхождения: гликозиды . 2 . CRC Press. п. 137.