 | |
 | |
| Имена | |
|---|---|
| Другие имена Дихромат пиридиния | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.039.511 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| C 10 H 12 N 2 Cr 2 O 7 | |
| Молярная масса | 376,2 |
| Внешность | твердое вещество от оранжевого до коричневого [1] |
| Точка кипения | От 145 до 147 ° C (от 293 до 297 ° F, от 418 до 420 K) [1] |
| растворим в воде [1] | |
| Опасности | |
| Пиктограммы GHS |       |
| Сигнальное слово GHS | Опасность |
| H228 , H272 , H314 , H315 , H317 , H319 , H350 , H400 , H410 | |
| Р201 , Р202 , Р210 , Р220 , P221 , P240 , P241 , P260 , P261 , P264 , P272 , P273 , P280 , P281 , P301 + 330 + 331 , P302 + 352 , P303 + 361 + 353 , Р304 + 340 , P305 + 351 + 338 , P308 + 313 , P310 , P321 , P332 + 313 , P333 + 313 , P337 + 313 | |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
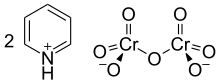
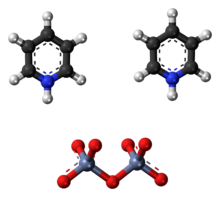
Корнфорт реагент или дихромат пиридини (PDC) является пиридиний соль бихромата с химической формулой [С 5 Н 5 NH] 2 [Cr 2 O 7 ]. Это соединение названо в честь австралийско-британского химика сэра Джона Варкапа Корнфорта (род. 1917), который представил его в 1962 году. [2] [3] Реагент Корнфорта является сильным окислителем, который может превращать первичные и вторичные спирты в альдегиды и кетоны.соответственно. По своей химической структуре и функциям он тесно связан с другими соединениями, изготовленными из оксида шестивалентного хрома , такими как хлорхромат пиридиния и реагент Коллинза . В настоящее время эти реагенты из-за их токсичности используются редко. [4]
Синтез и свойства [ править ]
Реагент Корнфорта получают путем медленного добавления концентрированного водного раствора триоксида хрома к пиридину . Реакция может вызвать взрыв, которого можно избежать, тщательно растворив триоксид в воде и охладив раствор льдом. Продукт фильтруют, промывают ацетоном и сушат, получая оранжевый порошок. Порошок устойчив на воздухе, не особенно гигроскопичен и имеет почти нейтральный pH, что облегчает обращение с ним; он лишь слабокислый из-за присутствия катионов пиридиния. Реагент Корнфорта легко растворяется в воде, диметилформамиде и диметилсульфоксиде (ДМСО). Плохо растворяется в ацетоне.и хлорированные органические растворители, такие как дихлорметан , и образует суспензии . [4] [5]
Приложения [ править ]
Реагент Корнфорта является сильным окислителем, который может превращать первичные спирты в альдегиды, а вторичные спирты в кетоны , как в виде раствора, так и суспензии. Это приложение было впервые упомянуто в 1969 году, но полностью разработано Кори и Шмидтом только в 1979 году. Они упомянули, что реакция насыщенных первичных спиртов с PDC с использованием диметилформамида в качестве растворителя приводит к окислению до карбоновых кислот, а не до альдегидов . Однако окисление до карбоновых кислот на аллиловых и бензильных первичных спиртах не происходит. [6]
Окисление обычно проводят в условиях окружающей среды, в условиях почти нейтрального pH , в диметилформамиде или дихлорметане или их смеси. Выбор растворителя или их соотношения влияет на скорость реакции; в частности, более высокое содержание диметилформамида приводит к более сильному окислению. Медленная скорость окисления некоторых спиртов может быть увеличена добавлением молекулярных сит , органических кислот или уксусного ангидрида или их комбинаций. Ускорение молекулярными ситами лучше всего работает, когда диаметр их пор составляет около 0,3 нм, и это, очевидно, не связано с их способностью к водопоглощению. Среди органических кислот уксусная кислота , трифторацетат пиридиния или тозилат пиридиния.могут быть добавлены, причем первый из них наиболее эффективен и его легче всего удалить. Достигается значительное ускорение, но реакция неизбежно переходит с нейтральной (pH) в кислую. Сравнимое ускорение достигается с помощью уксусного ангидрида, который используется в химии сахаров и нуклеозидов . Ускорение реакции зависит не только от добавок, но и от их формы, поэтому все реагенты предпочтительны сухими и свежеприготовленными, а PDC и молекулярные сита должны быть тонко измельчены. Недостатком ускорителей является то, что они могут одновременно способствовать нескольким маршрутам окисления, снижая тем самым селективность реакции. [4] [5]
По своей химической структуре и функциям реагент Корнфорта тесно связан с другими солями пиридиния шестивалентного оксида хрома, такими как хлорхромат пиридиния [PyH] [CrO 3 Cl], и комплексами пиридина, такими как реагент Коллинза , CrO 3 · 2Py в дихлорметане. и реагент Сарре , CrO 3 · 2Py в пиридине. [4]
Проблемы безопасности [ править ]
Реагент Корнфорт очень токсичен для водных организмов и может нанести долгосрочный ущерб окружающей среде в случае выброса в больших количествах. Он раздражает кожу и слизистые оболочки и может вызывать аллергические реакции; он канцерогенный. Предельно допустимая концентрация колеблется в пределах от 0,01 до 0,1 мг · м -3 в воздухе в зависимости от страны. Поскольку он содержит шестивалентный хром , предполагается, что он является канцерогеном, а как сильный окислитель дихромат пиридиния способствует возгоранию, выделяя окись углерода , двуокись углерода и дым токсичных металлов. Пожар можно потушить водой или CO 2 . [1]
См. Также [ править ]
- Окисление комплексами хром (VI) -амин
Ссылки [ править ]
- ^ a b c d Дихромат пиридиния , MSDS, Альфа Цезарь
- ^ Александра Сеннинг словарь Elsevier по chemoetymology: в whies и whences химической номенклатуры и терминологии , Elsevier, 2007, ISBN 0-444-52239-5 стр. 94
- ^ Корнфорт, RH; Корнфорт, JW; Попяк, Г. (1962). «Получение R- и S-мевалонолактонов». Тетраэдр . 18 (12): 1351–4. DOI : 10.1016 / S0040-4020 (01) 99289-0 .
- ^ а б в г Г. Тоджо; М. Фернянандес (2006). Окисление спиртов до альдегидов и кетонов: руководство по современной общепринятой практике . Нью-Йорк: Спрингер. стр. 28, 29, 86. ISBN 0-387-23607-4.
- ^ a b Стивен В. Лей Oxidation , Elsevier, 1992, ISBN 0-08-040598-3 стр. 272
- ^ Кори, EJ; Шмидт, Г. (1979). «Полезные процедуры для окисления спиртов с участием дихромата пиридиния в апротических средах». Tetrahedron Lett. 20 (52): 399. DOI : 10.1016 / S0040-4039 (01) 93515-4 .