
Ответ SOS глобальный ответ на повреждение ДНК , в которой клеточный цикл арестовывают и репарации ДНК и мутагенез индуцируется. В систему входит белок RecA (Rad51 у эукариот). Белок RecA, стимулируемый одноцепочечной ДНК, участвует в инактивации репрессора ( LexA ) генов SOS-ответа, тем самым вызывая ответ. Это склонная к ошибкам система репарации, которая вносит значительный вклад в изменения ДНК, наблюдаемые у широкого круга видов.
Открытие [ править ]
Ответ SOS был обнаружен и назван Мирославом Радманом в 1975 году [3].
Механизм [ править ]
Во время нормального роста гены SOS негативно регулируются димерами белка-репрессора LexA . В нормальных условиях LexA связывается с консенсусной последовательностью из 20 пар оснований ( SOS-бокс ) в операторной области для этих генов. Некоторые из этих SOS-генов экспрессируются на определенных уровнях даже в репрессированном состоянии, в зависимости от сродства LexA к их SOS-боксу. Активация генов SOS происходит после повреждения ДНК за счет накопления одноцепочечных (оцДНК) областей, образующихся в ответвлениях репликации, где ДНК-полимераза блокируется. RecA формирует филамент вокруг этих областей оцДНК АТФ-зависимым образом и активируется. [4]Активированная форма RecA взаимодействует с репрессором LexA, чтобы облегчить самоотщепление репрессора LexA от оператора. [4] [5]
Как только пул LexA уменьшается, репрессия генов SOS снижается в соответствии с уровнем сродства LexA к SOS-боксам. [4] Операторы, слабо связывающие LexA, выражаются первыми полностью. Таким образом, LexA может последовательно активировать различные механизмы восстановления. Гены со слабым SOS-боксом (такие как lexA , recA , uvrA , uvrB и uvrD ) полностью индуцируются в ответ даже на слабое лечение, индуцирующее SOS. Таким образом, первым инициируемым механизмом SOS-репарации является эксцизионная репарация нуклеотидов.(NER), цель которого - исправить повреждение ДНК без принятия полноценного SOS-ответа. Если, однако, NER недостаточно для устранения повреждения, концентрация LexA еще больше снижается, поэтому индуцируется экспрессия генов с более сильными блоками LexA (таких как sulA , umuD , umuC - они экспрессируются поздно). [4] SulA останавливает деление клеток [4] , связываясь с FtsZ , белком, инициирующим этот процесс. Это вызывает филаментациюи индукция UmuDC-зависимой мутагенной репарации. В результате этих свойств некоторые гены могут частично индуцироваться в ответ даже на эндогенные уровни повреждения ДНК, в то время как другие гены, по-видимому, индуцируются только тогда, когда в клетке присутствует сильное или стойкое повреждение ДНК.
Устойчивость к антибиотикам [ править ]
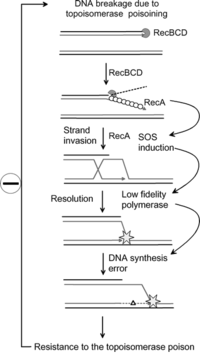
Недавние исследования показали, что путь SOS может иметь важное значение для приобретения бактериальных мутаций, которые приводят к устойчивости к некоторым антибиотикам. [6] Увеличение скорости мутации во время реакции SOS вызвано тремя низкой точности воспроизведения ДНК - полимераз : Pol II , Pol IV и Pol V . [6] В настоящее время исследователи нацелены на эти белки с целью создания лекарств, предотвращающих восстановление SOS. Таким образом можно увеличить время, необходимое патогенным бактериям для развития устойчивости к антибиотикам, что повысит долгосрочную жизнеспособность некоторых антибиотиков. [7]
Тестирование генотоксичности [ править ]
У Escherichia coli различные классы повреждающих ДНК агентов могут инициировать SOS-ответ, как описано выше. Воспользовавшись преимуществом слияния оперонов, поместив lac-оперон (ответственный за производство бета-галактозидазы, белка, разлагающего лактозу) под контроль связанного с SOS белка, возможен простой колориметрический анализ генотоксичности . К бактериям добавляется аналог лактозы, который затем разлагается бета-галактозидазой, образуя окрашенное соединение, которое можно количественно измерить с помощью спектрофотометрии . Степень развития окраски является косвенным показателем продуцируемой бета-галактозидазы, которая напрямую связана с количеством повреждений ДНК.
В E.coli , которые дополнительно модифицированы, чтобы иметь ряд мутаций , в том числе мутации uvrA , при наличии которых дефицитный штамм в эксцизионной репарации, увеличивая ответ на определенные повреждающих ДНК агентов, а также мутацию РСР, которая делает липополисахарида бактерий -дефицитный, что способствует лучшей диффузии определенных химических веществ в клетку, чтобы вызвать реакцию SOS. [8] Доступны коммерческие наборы, которые измеряют первичный ответ клетки E. coli на генетическое повреждение, и они могут сильно коррелировать с тестом Эймса для определенных материалов. [9]
Другие изображения [ править ]
SOS-ответ подавляет образование перегородки до тех пор, пока бактериальная ДНК не может быть восстановлена, и наблюдается как филаментация при исследовании клеток под микроскопом (верхний правый угол изображения).
См. Также [ править ]
- Индукция лизиса лямбда-фага
Ссылки [ править ]
- ↑ Little JW, Mount DW (май 1982 г.). «Система регуляции SOS кишечной палочки ». Cell . 29 (1): 11–22. DOI : 10.1016 / 0092-8674 (82) 90085-X . PMID 7049397 .
- Перейти ↑ Michel B (июль 2005 г.). «После 30 лет исследований бактериальная реакция SOS все еще удивляет нас» . PLOS Биология . 3 (7): e255. DOI : 10.1371 / journal.pbio.0030255 . PMC 1174825 . PMID 16000023 .
- ^ Radman, М (1975). «Феноменология индуцибельного мутагенного пути репарации ДНК в Escherichia coli : гипотеза SOS репарации». Основные науки о жизни . 5A : 355–367. DOI : 10.1007 / 978-1-4684-2895-7_48 . PMID 1103845 .
- ^ a b c d e Масловска, KH; Макиела-Дзбенска, К .; Fijalkowska, IJ (май 2019 г.). «Система SOS: сложный и строго регулируемый ответ на повреждение ДНК» . Экологический и молекулярный мутагенез . 60 (4): 368–384. DOI : 10.1002 / em.22267 . PMC 6590174 . PMID 30447030 .
- ^ Нельсон Д.Л., Cox MM (апрель 2004) Ленинджера Принципы биохимии 4е издание. Нью-Йорк: WH Freeman and Company. стр.1098.
- ^ а б Цирц, RT; Чин, JK; Анды, ДР; Де Креси-Лагар, V; Крейг, Вашингтон; Ромесберг, ИП; и другие. (Июнь 2005 г.). «Подавление мутации и борьба с эволюцией устойчивости к антибиотикам» . PLOS Биология . 3 (6): e176. DOI : 10.1371 / journal.pbio.0030176 . PMC 1088971 . PMID 15869329 .
- ^ Ли, AM; Росс, Коннектикут; Цзэн, BB; Синглтон, Сан-Франциско; и другие. (Июль 2005 г.). «Молекулярная мишень для подавления развития устойчивости к антибиотикам: ингибирование белка RecA Escherichia coli с помощью N6- (1-нафтил) -АДФ». Журнал медицинской химии . 48 (17): 5408–5411. DOI : 10.1021 / jm050113z . PMID 16107138 .
- ^ Quillardet P, Hofnung M (октябрь 1993). «Хромотест SOS: обзор». Мутационные исследования . 297 (3): 235–279. DOI : 10.1016 / 0165-1110 (93) 90019-J . PMID 7692273 .
- ^ Quillardet P, Hofnung M (июнь 1985). «Хромотест SOS, колориметрический бактериальный анализ генотоксинов: валидационное исследование с 83 соединениями». Мутационные исследования . 147 (3): 79–95. DOI : 10.1016 / 0165-1161 (85) 90021-4 . PMID 3923333 .
