 | |
| Имена | |
|---|---|
| Название ИЮПАК Метантетракарбонитрил | |
| Другие имена тетрацианид углерода; 2,2-дицианомалононитрил | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ChemSpider | |
PubChem CID | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| C 5 N 4 | |
| Молярная масса | 116,083 г · моль -1 |
| Структура | |
| тригональный | |
| R 3 c | |
а = 9,062, с = 11,625 | |
Объем решетки ( В ) | 137,8 Å 3 |
Формула единиц ( Z ) | 6 |
| тетраэдр | |
| Термохимия [1] | |
Std энтальпия формации (Δ F H ⦵ 298 ) | −146,2 ккал / моль |
| −616,4 ккал / моль | |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
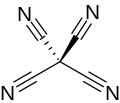
Тетрацианометан или тетрацианид углерода представляет собой молекулярный нитрид углерода перцианоалкана с формулой C (CN) 4 . По структуре можно рассматривать метан, в котором все атомы водорода замещены цианидными группами. Впервые он был сделан Эрвином Майером в 1969 году. [2] [3]
Свойства [ править ]
Тетрацианометан представляет собой твердое вещество при комнатной температуре. Он разлагается при температуре более 160 ° C без плавления, и хотя он может находиться в разбавленном паре, жидкая форма неизвестна. [2] Молекулы тетрацианометана имеют тетраэдрическую симметрию ( 4 3 m или T d ). Молекула имеет расстояние CC 1,484 Å и расстояние CN 1,161 Å в газовой форме. В твердом теле связь C≡N укорачивается до 1,147 Å. [3] Связь CC имеет силовую константу 4,86 × 10 5 дин / см, что немного больше, чем связь C-Cl в четыреххлористом углероде , но намного слабее, чем в ионе трицианометанида . [4]При давлении более 7 ГПа тетрацианометан начинает полимеризоваться с образованием неорганизованного твердого вещества с ковалентной сеткой. При более высоком давлении цвет желтеет и темнеет до черного. Более 20 ГПа полимеризация полная. [5]
Модуль всестороннего сжатия K 0 = 4,4 и его производная K 0 '= 18. [5]
Производство [ править ]
Тетрацианометан может быть получен путем реакции хлорида цианогена с трицианометанидом серебра. [4]
- ClCN + AgC (CN) 3 → C (CN) 4 + AgCl
Реакции [ править ]
В кислотном растворе в воде тетрацианометан гидролизуется с образованием трицианометанида и ионов аммония вместе с диоксидом углерода. В щелочных растворах образуются трицианометанид и цианат- ионы. [4]
См. Также [ править ]
- Трицианометан ( цианоформ )
Ссылки [ править ]
- ^ Барнс, DS; Мортимер, Коннектикут; Майер, Э. (июль 1973 г.). «Энтальпия образования тетрацианометана». Журнал химической термодинамики . 5 (4): 481–483. DOI : 10.1016 / S0021-9614 (73) 80095-3 .
- ^ а б Майер, Эрвин (1969). "Darstellung und Eigenschaften von Tetracyanmethan". Monatshefte für Chemie . 100 (2): 462–468. DOI : 10.1007 / BF00904089 . S2CID 92450428 .
- ^ a b Бриттон, Д. (1 июля 1974 г.). «Кристаллическая структура тетрацианометана, C (CN) 4 ». Acta Crystallographica Раздел B . 30 (7): 1818–1821. DOI : 10.1107 / S0567740874005863 .
- ^ a b c Хестер, Рональд Э .; Ли, Кеннет Майкл; Майер, Эрвин (сентябрь 1970 г.). «Тетрацианометан как псевдо (тетрагалогенид углерода)». Журнал физической химии . 74 (18): 3373–3376. DOI : 10.1021 / j100712a011 .
- ^ а б Кифер, Дерек У .; Гоу, Хуэйян; Ван, Цяньцянь; Парди, Эндрю; Эпштейн, Альберт; Джул, Стивен Дж .; Коди, Джордж Д .; Баддинг, Джон; Штробель, Тимоти А. (12 февраля 2018 г.). «Тетрацианометан под давлением: полимеры с расширенным CN из предшественников со встроенными центрами sp3». Журнал физической химии . 122 (11): 2858–2863. Bibcode : 2018JPCA..122.2858K . DOI : 10.1021 / acs.jpca.7b10729 . ОСТИ 1430339 . PMID 29432685 .