| |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Триоксидан (только предварительно выбранное название) [1] | |
| Другие имена Трехокись водорода Трехокись водорода Вода-Воздух Дигидроксиэфир | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| 200290 | |
PubChem CID | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| Н 2 О 3 | |
| Молярная масса | 50,013 г · моль -1 |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Триоксидан (также систематически называемый μ-триоксидандиидодигидрогеном ), также называемый триоксидом водорода или триоксидом дигидрогена , представляет собой неорганическое соединение с химической формулой H [O]
3H (также записывается как [H (μ-O
3) H] или [H
2О
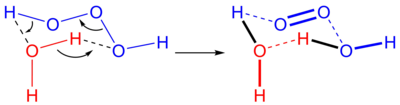
3] ). Это один из нестабильных полиоксидов водорода . [2] В водных растворах триоксидан разлагается с образованием воды и синглетного кислорода :
Обратная реакция, добавление синглетного кислорода к воде, обычно не происходит частично из-за нехватки синглетного кислорода. В биологических системах, однако, известно , что озон генерируется из синглетного кислорода, и предполагаемый механизм - это катализируемое антителами производство триоксидана из синглетного кислорода. [3]
Подготовка [ править ]
Триоксидан может быть получен в небольших, но обнаруживаемых количествах в реакциях озона и перекиси водорода или при электролизе воды . Большие количества были получены реакцией озона с органическими восстановителями при низких температурах в различных органических растворителях, таких как антрахиноновый процесс , и он также образуется при разложении органических гидротриоксидов (ROOOH). [4] Альтернативно, триоксидан можно получить восстановлением озона 1,2-дифенилгидразином.при низкой температуре. Используя связанный со смолой вариант последнего, можно выделить относительно чистый триоксидан в виде раствора в органическом растворителе. Приготовление растворов высокой чистоты возможно с использованием катализатора метилтриоксорения (VII). [5] В ацетоне- d 6 при –20 ° C характерный сигнал 1 H ЯМР триоксидана можно было наблюдать при химическом сдвиге 13,1 ppm. [4] Растворы триоксида водорода в диэтиловом эфире можно безопасно хранить при -20 ° C в течение недели. [5]
Реакция озона с перекисью водорода известна как «пероксоновый процесс». Эта смесь некоторое время использовалась для очистки грунтовых вод, загрязненных органическими соединениями. В результате реакции образуются H 2 O 3 и H 2 O 5 . [6]
Структура [ править ]
В 2005 году триоксидан был экспериментально обнаружен методом микроволновой спектроскопии в сверхзвуковой струе. Молекула существует в перекошенной структуре с двугранным углом кислород – кислород – кислород – водород 81,8 °. Длина связи кислород-кислород, равная 142,8 пикометра , немного короче, чем длина связи кислород-кислород 146,4 мкм в перекиси водорода . Также существуют различные димерные и тримерные формы. Он немного более кислый, чем перекись водорода, диссоциируя на H + и OOOH - . [7]
Реакции [ править ]
Триоксидан легко разлагается на воду и синглетный кислород с периодом полураспада около 16 минут в органических растворителях при комнатной температуре, но только миллисекунды в воде. Он реагирует с органическими сульфидами с образованием сульфоксидов , но о его реакционной способности мало что известно.
Недавние исследования показали, что триоксидан является активным ингредиентом, отвечающим за антимикробные свойства хорошо известной смеси озон / перекись водорода . Поскольку эти два соединения также присутствуют в биологических системах, утверждается, что антитело в организме человека может генерировать триоксидан в качестве мощного окислителя против вторгающихся бактерий. [3] [8] Источником соединения в биологических системах является реакция между синглетным кислородом и водой (которая протекает в любом направлении, конечно, в зависимости от концентрации), при этом синглетный кислород вырабатывается иммунными клетками. [4] [9]
Вычислительная химия предсказывает, что существует больше молекул кислорода или полиоксидов водорода, и что даже бесконечно длинные кислородные цепи могут существовать в низкотемпературном газе. Благодаря этим спектроскопическим свидетельствам поиск такого типа молекул может начаться в межзвездном пространстве . [7]
См. Также [ править ]
- Молозонид
Ссылки [ править ]
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 1024. DOI : 10.1039 / 9781849733069-FP001 . ISBN 978-0-85404-182-4.
- ^ Черковник, Янез; Плесничар, Божо (2013). «Последние достижения в химии трехокиси водорода (HOOOH)». Химические обзоры . 113 (10): 7930–7951. DOI : 10.1021 / cr300512s . PMID 23808683 .
- ^ a b Пол Т. Найфелер; Бойл; Элтепу; Вонг; Eschenmoser; Лернер; Вентворт-младший (2004). «Трехокись водорода (HOOOH) образуется во время термической реакции между перекисью водорода и озоном». Angewandte Chemie International Edition . 43 (35): 4656–4659. DOI : 10.1002 / anie.200460457 . PMID 15317003 .
- ^ a b c Плесничар, Божо (2005). "Прогресс в химии трехокиси дигидрогена (HOOOH)" (PDF) . Acta Chimica Slovenica . 52 : 1–12.
- ^ a b Strle, G .; Церковник, Дж. (2015), "Простое и эффективное получение триоксида водорода высокой чистоты (HOOOH)", Angew. Chem. Int. Эд. , 54 (34): 9917-9920, DOI : 10.1002 / anie.201504084 , PMID 26234421
- ^ Сюй, X .; Годдард, Вашингтон (2002). «Нелинейные уравнения в частных производных и их приложения: химия пероксона: образование H 2 O 3 и кольца (HO 2 ) (HO 3 ) из O 3 / H 2 O 2 » . Труды Национальной академии наук . 99 (24): 15308–12. Bibcode : 2002PNAS ... 9915308X . DOI : 10.1073 / pnas.202596799 . PMC 137712 . PMID 12438699 .
- ^ a b Косуке Сума; Ёсихиро Сумиёси и Ясуки Эндо (2005). «Вращательный спектр и структура HOOOH». Варенье. Chem. Soc. 127 (43): 14998–14999. DOI : 10.1021 / ja0556530 . PMID 16248618 .
- ^ Проверенная временем химическая реакция порождает неожиданный продукт , Новости и обзоры , 13 сентября 2004 г.
- ^ Роальд Хоффманн (2004). «История О» (PDF) . Американский ученый . 92 : 23. DOI : 10,1511 / 2004.1.23 .