 | |
ruthenium(II)-chloride-powder.jpg/440px-Tris(bipyridine)ruthenium(II)-chloride-powder.jpg) | |
 | |
| Имена | |
|---|---|
| Другие названия Ru-bpy Рутений-трис (2,2'-бипиридил) дихлорид | |
| Идентификаторы | |
| |
| ECHA InfoCard | 100.034.772 |
| Номер RTECS |
|
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| C 30 H 24 N 6 Cl 2 Ru · 6H 2 O | |
| Молярная масса | 640,53 г / моль (безводный) 748,62 г / моль (гексагидрат) |
| Появление | красное твердое вещество |
| Плотность | твердый |
| Температура плавления | > 300 ° С |
| мало растворим в воде; растворим в ацетоне | |
| Состав | |
| Восьмигранный | |
| 0 Д | |
| Опасности | |
| Основные опасности | умеренно токсичен |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| R-фразы (устаревшие) | никто |
| S-фразы (устаревшие) | S22 S24 / 25 |
| Родственные соединения | |
Родственные соединения | Трихлорид рутения 2,2'-бипиридин |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
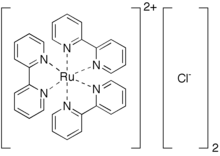
Хлорид трис (бипиридин) рутения (II) представляет собой координационный комплекс хлоридной соли с формулой [Ru (bpy) 3 ] 2+ 2Cl - . Эту красную кристаллическую соль получают в виде гексагидрата , хотя все интересующие свойства проявляются в катионе [Ru (bpy) 3 ] 2+ , которому уделяется много внимания из-за его отличительных оптических свойств. Хлориды можно заменить другими анионами , такими как PF 6 - .
Синтез и структура [ править ]
Эта соль получают путем обработки водного раствора трихлорида рутения с 2,2'-бипиридином . В этом превращении Ru (III) восстанавливается до Ru (II), и в качестве восстанавливающего агента обычно добавляют гипофосфористую кислоту . [1] [Ru (bpy) 3 ] 2+ является октаэдрическим, содержащим центральный низкоспиновый ион d 6 Ru (II) и три бидентатных лиганда bpy. Расстояния Ru-N составляют 2,053 (2), что меньше, чем расстояния Ru-N для [Ru (bpy) 3 ] 3+ . [2] Комплекс хиральный, с симметрией D 3 . Он был разделен на его энантиомеры.. Считается, что в своем нижнем триплетном возбужденном состоянии молекула достигает более низкой симметрии C 2 , поскольку возбужденный электрон локализован в основном на одном бипиридильном лиганде. [3] [4]
Фотохимия [Ru (bpy) 3 ] 2+ [ править ]
[Ru (bpy) 3 ] 2+ поглощает ультрафиолетовый и видимый свет. Водные растворы [Ru (bpy) 3 ] Cl 2 имеют оранжевый цвет из-за сильного поглощения MLCT при 452 ± 3 нм ( коэффициент экстинкции 14 600 М -1 см -1 ). Дополнительные полосы поглощения обнаруживаются при 285 нм, соответствующие центрированным по лигандам π * ← π переходам и слабому переходу около 350 нм (переход dd). [5] Поглощение света приводит к образованию возбужденного состояния и имеет относительно долгое время жизни 890 нс в ацетонитриле [6] и 650 нс в воде.[6] Возбужденное состояние релаксирует до основного состояния за счет испускания фотона или безызлучательной релаксации. Квантовый выход составляет 2,8% в насыщенной воздухом воде при 298К и максимум излучения длина волны составляет 620 нм. [7] Длительное время жизни возбужденного состояния объясняется тем фактом, что оно является триплетным , тогда как основное состояние является синглетным состоянием, и частично из-за того факта, что структура молекулы допускает разделение зарядов. Синглет-триплетные переходы запрещены и поэтому часто медленны .
Как и все возбужденные состояния молекул, триплетное возбужденное состояние [Ru (bpy) 3 ] 2+ обладает как более сильными окислительными, так и восстанавливающими свойствами, чем его основное состояние. Эта ситуация возникает из-за того, что возбужденное состояние можно описать как комплекс Ru 3+, содержащий анион-радикал bpy · - в качестве лиганда. Таким образом, фотохимические свойства [Ru (bpy) 3 ] 2+ напоминают фотосинтетическую сборку , которая также включает разделение электрона и дырки . [8]
[Ru (bpy) 3 ] 2+ был исследован в качестве фотосенсибилизатора как для окисления, так и для восстановления воды. После поглощения фотона [Ru (bpy) 3 ] 2+ переходит в вышеупомянутое триплетное состояние, обозначенное [Ru (bpy) 3 ] 2+ *. Эта разновидность переносит электрон, расположенный на одном лиганде bpy, жертвенному окислителю, такому как пероксодисульфат (S 2 O 8 2- ). Образующийся [Ru (bpy) 3 ] 3+ является мощным окислителем и окисляет воду до O 2 и протонов через катализатор . [9] В качестве альтернативы восстанавливающая способность [Ru (bpy) 3 ] 2+ * может быть использована для восстановления метилвиологена , рециклируемого носителя электронов, который, в свою очередь, восстанавливает протоны на платиновом катализаторе. Для того, чтобы этот процесс был каталитическим, для возврата Ru (III) обратно в Ru (II) используется протекторный восстановитель, такой как EDTA 4- или триэтаноламин .
Производные [Ru (bpy) 3 ] 2+ многочисленны. [10] [11] Такие комплексы широко обсуждаются для применения в биодиагностике, фотовольтаике и органических светодиодах , но их производные не поступают в продажу . Применение [Ru (bpy) 3 ] 2+ и его производных для изготовления оптических химических сенсоров является, пожалуй, одной из наиболее успешных областей до сих пор. [12]
[Ru (bpy) 3 ] 2+ и фотоокислительный катализ [ править ]
В фотоокислительном катализе [Ru (bpy) 3 ] 2+ используется в качестве сенсибилизатора в качестве стратегии органического синтеза. Также используются многие аналоги [Ru (bpy) 3 ] 2+ . В этих преобразованиях используются окислительно-восстановительные свойства [Ru (bpy) 3 ] 2+ * и его производной с восстановительным гашением [Ru (bpy) 3 ] + . [13] [14] [15] [16]
Безопасность [ править ]
Металл бипиридин, а также родственные фенантролиновые комплексы обычно биоактивны, поскольку они могут действовать как интеркалирующие агенты .
Ссылки [ править ]
- ^ Broomhead JA; Молодой CG (1990). Гексагидрат дихлорида трис (2,2'-бипиридина) рутения (II) . Неорганические синтезы. 28 . С. 338–340. DOI : 10.1002 / 9780470132593.ch86 . ISBN 9780470132593.
- ^ Бинер, М .; Buergi, HB; Ludi, A .; Рор, К. (1 июня 1992 г.). «Кристаллические и молекулярные структуры [Ru (bpy) 3] (PF6) 3 и [Ru (bpy) 3] (PF6) 2 при 105 K». Варенье. Chem. Soc . 114 (13): 5197–5203. DOI : 10.1021 / ja00039a034 .
- ^ Да, Элвин Т .; Чарльз В. Шэнк ; Джеймс К. Маккаскер (2000). «Сверхбыстрая динамика локализации электронов после фотоиндуцированного переноса заряда». Наука . 289 (5481): 935–938. CiteSeerX 10.1.1.612.8363 . DOI : 10.1126 / science.289.5481.935 . PMID 10937993 .
- ^ Томпсон, Дэвид В .; Ито, Акитака; Мейер, Томас Дж. (30 июня 2013 г.). «[Ru (bpy) 3] 2 + * и другие замечательные возбужденные состояния с переносом заряда от металла к лиганду (MLCT)». Чистая и прикладная химия . 85 (7): 1257–1305. DOI : 10.1351 / PAC-CON-13-03-04 . S2CID 98792207 .
- ^ Kalyanasundaram, К. (1982). «Фотофизика, фотохимия и преобразование солнечной энергии с помощью трис (бипиридил) рутения (II) и его аналогов». Обзоры координационной химии . 46 : 159–244. DOI : 10.1016 / 0010-8545 (82) 85003-0 .
- ^ a b Монтальти, Марко; Альберто Седи; Лука Проди; М. Тереза Гандольфи (2006). Справочник по фотохимии (3-е изд.). 6000 Broken Sound Prkway NW, Suite 200 Бока-Ратон, Флорида: CRC press Taylor & Francis Group. стр. 379 -404. ISBN 978-0-8247-2377-4.CS1 maint: location ( ссылка )
- ^ Накамар, Катсуй (1982). «Синтез, квантовые выходы люминесценции и время жизни тришелатных комплексов смешанного лиганда рутения (II), включая 3,3'-диметил-1-2,2'-бипиридил» . Бюллетень химического общества Японии . 55 (9): 2697. DOI : 10,1246 / bcsj.55.2697 .
- ^ AJ Бард & MA Fox (1995). «Искусственный фотосинтез: солнечное расщепление воды на водород и кислород». В соотв. Chem. Res. 28 (3): 141–145. DOI : 10.1021 / ar00051a007 .
- ^ М. Хара; CC Waraksa; JT Lean; Б. А. Льюис и Т. Е. Маллук (2000). «Фотокаталитическое окисление воды в буферной системе трис (2,2'-бипиридил) рутения-коллоидный IrO2». J. Phys. Chem. . 104 (22): 5275–5280. CiteSeerX 10.1.1.547.1886 . DOI : 10.1021 / jp000321x .
- ^ А. Юрис; В. Бальзани; Ф. Баригеллетти; С. Кампанья; П. Белзер и А. фон Зелевский (1988). «Полипиридиновые комплексы Ru (II) - фотофизика, фотохимия, электрохимия, хемилюминесценция». Coord. Chem. Ред . 84 : 85–277. DOI : 10.1016 / 0010-8545 (88) 80032-8 .
- ^ С. Кампанья; Ф. Пунторьеро; Ф. Настаси; Дж. Бергамини и В. Бальзани (2007). Фотохимия и фотофизика координационных соединений: рутений . Вершина. Curr. Chem . Темы современной химии. 280 . С. 117–214. DOI : 10.1007 / 128_2007_133 . ISBN 978-3-540-73346-1.
- ^ Г. Орельяна и Д. Гарсия-Фреснадильо (2004). Экологический и промышленный оптосенсор с индивидуализированными люминесцентными полипиридильными комплексами Ru (II) . Springer Ser. Chem. Sens. Biosens . 1 . С. 309–357. DOI : 10.1007 / 978-3-662-09111-1_13 . ISBN 978-3-642-07421-9.
- ^ Ромеро, Натан А .; Ничевич, Дэвид А. (10 июня 2016 г.). «Органический фоторедокс-катализ». Химические обзоры . 116 (17): 10075–10166. DOI : 10.1021 / acs.chemrev.6b00057 . PMID 27285582 .
- ^ Троубридж, Аарон; Уолтон, Скарлетт М .; Гаунт, Мэтью Дж. (2020). "Новые стратегии катализированного переходными металлами синтеза алифатических аминов" . Химические обзоры . 120 (5): 2613–2692. DOI : 10.1021 / acs.chemrev.9b00462 . PMID 32064858 .
- ^ Ван, Чанг-Шэн; Dixneuf, Pierre H .; Суле, Жан-Франсуа (2018). «Фоторедокс-катализ для создания связей C – C из связей C (sp2) –H». Химические обзоры . 118 (16): 7532–7585. DOI : 10.1021 / acs.chemrev.8b00077 . PMID 30011194 .
- ^ Приер, Кристофер К .; Ранкич, Даника А .; Макмиллан, Дэвид WC (2013). "Фоторедокс-катализ в видимом свете с комплексами переходных металлов: применение в органическом синтезе" . Химические обзоры . 113 (7): 5322–5363. DOI : 10.1021 / cr300503r . PMC 4028850 . PMID 23509883 .