Эта статья может быть слишком технической для понимания большинством читателей . ( Август 2015 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
 | |
| Имена | |
|---|---|
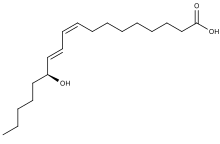
| Название ИЮПАК (9 Z , 11 E , 13 S ) -13-гидрокси-9,11-октадекадиеновая кислота | |
| Другие имена 13 (S) -ЗАД, 13S-HODE | |
| Идентификаторы | |
| |
3D модель ( JSmol ) |
|
| ЧЭБИ |
|
| ЧЭМБЛ |
|
| ChemSpider | |
| КЕГГ |
|
PubChem CID | |
| |
| |
| Характеристики | |
| С 18 Н 32 О 3 | |
| Молярная масса | 296,451 г · моль -1 |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
13-Гидроксиоктадекадиеновая кислота ( 13-HODE ) - это обычно используемый термин для 13 ( S ) -гидрокси-9 Z , 11 E- октадекадиеновой кислоты (13 ( S ) -HODE). Производство 13 ( S ) -HODE часто сопровождается образованием его стереоизомера , 13 ( R ) -гидрокси-9 Z , 11 E- октадекадиеновой кислоты (13 ( R ) -HODE). На следующем рисунке представлена структура ( S ) стереоизомера 13-HODE. Два других встречающихся в природе 13-HODE, которые могут сопровождать продукцию 13 ( S ) -HODE, - это его цис-транс (т. Е. 9Е , 11 Е .) Изомеров а именно, 13 ( S ) -гидрокси-9 Е , 11 Е -octadecadienoic кислоты (13 ( S ) - ЕЕ -HODE) и 13 ( R ) -гидрокси-9 Е , 11 Е -octadecadienoic кислоты (13 ( R ) - EE -HODE). Исследования приписывают 13 ( S ) -HODE ряд клинически значимых биоактивностей; Недавние исследования приписали активность 13 ( R ) -HODE, которая отличается от активности 13 ( S) -HODE; и другие исследования предположили, что один или несколько из этих HODE опосредуют физиологические и патологические реакции, являются маркерами различных заболеваний человека и / или способствуют прогрессированию определенных заболеваний у людей. Однако, поскольку во многих исследованиях по идентификации, количественной оценке и действию 13 ( S ) -HODE в клетках и тканях использовались методы, которые не делали различий между этими изомерами, 13-HODE используется здесь, когда фактический изученный изомер неясен.
Аналогичный набор метаболитов 9-гидроксиоктадекадиеновой кислоты (9-HODE) (т.е. 9 (S) -HODE), 9 (R) -HODE, 9 (S) -EE-HODE) и 9 (R) -EE- HODE) возникает естественным образом и особенно в условиях оксидативного стресса, формируется одновременно с 13-HODE; 9-HODE имеют перекрывающиеся и дополняющие друг друга, но не идентичные действиям с 13-HODE. Некоторые недавние исследования, измеряющие уровни HODE в тканях, объединили четыре 9-HODE с четырьмя 13-HODE, чтобы сообщить только об общих HODE (tHODE). Было предложено, что tHODE являются маркерами некоторых заболеваний человека. Другие исследования сосредоточенными вместе 9- ( S ), 9 ( R ), 13 ( S ) -, и 13 ( R ) -HODEs вместе с двумя кетонаметаболиты этих HODE, 13-oxoODE (13-оксо-9 Z , 12 E- октадекадиеновая кислота) и 9-oxoODE, сообщающие только об общих OXLAM (метаболиты окисленной линолевой кислоты); OXLAM участвовали в совместной работе, чтобы сигнализировать о восприятии боли.
Пути создания 13-HODE [ править ]
15-липоксигеназа 1 [ править ]
15-липоксигеназа 1 ( ALOX15 ), наиболее известная тем, что превращает 20-углеродную полиненасыщенную жирную кислоту , арахидоновую кислоту , в серию 15-гидроксилированных метаболитов арахидоновой кислоты (см. 15-гидроксикозатетраеновая кислота ), на самом деле предпочитает в качестве субстрата полиненасыщенные 18-углеродные жирная кислота, линолевая кислота , а не арахидоновая кислота, превращая ее в 13-гидроперокси-9 Z , 11 E- октадекадиеновую кислоту (13-HpODE). [1] [2] Фермент действует очень стереоспецифично, образуя 13 ( S ) -гидроперокси-9 Z , 11 E- октадекадиеновую кислоту (13 ( S) -HpODE), но сравнительно мало или отсутствует 13 ( R ) -гидроперокси-9 Z , 11 E- октадекадиеновая кислота (13 ( R ) -HpODE) -. [3] [4] В клетках 13 ( S ) -HpODE быстро восстанавливается пероксидазами до 13 ( S ) -HODE. [1] [5] ALOX15 полностью способен метаболизировать линолевую кислоту, связанную с фосфолипидом [6] или холестерином [7], с образованием 13 (S) -HpODE-связанных фосфолипидов и холестерина, которые быстро превращаются в соответствующие им 13 ( S) -связанные продукты.
15-липоксигеназа 2 [ править ]
15-липоксигеназа типа 2 ( ALOX15B ) сильно предпочитает арахидоновую кислоту линолевой и, как следствие, относительно плохо метаболизирует линолевую кислоту до 13 ( S ) -HpODE (который затем превращается в 13 ( S ) -HODE) по сравнению с 15-липоксигеназой. 1; [8] тем не менее, он может способствовать производству этих метаболитов. [2] [9]
Циклооксигеназы 1 и 2 [ править ]
Циклооксигеназа 1 (COX-1) и циклооксигеназа 2 (COX-2) метаболизируют линолевую кислоту до 13 (S) -HODE, при этом COX-2 проявляет более высокое предпочтение линолевой кислоте и, следовательно, производит гораздо больше этого продукта, чем его аналог COX-1. ; [10] следовательно, ЦОГ-2, по-видимому, является основным ЦОГ, образующим 13 ( S ) -HODE в клетках, экспрессирующих оба фермента. [11] Одновременно с производством 13 ( S ) -HODE эти ферменты также производят меньшие количества 9 ( R ) -HODE. [12] [11]
Цитохром P450 [ править ]
Цитохром Р450 микросомальные ферменты метаболизировать линолевую кислоту к смеси 13-Ходеса и 9-Ходеса; в этих реакциях образуются рацемические смеси, в которых преобладает стереоизомер R , например, при соотношении R / S 80% / 20% как для 13-HODE, так и для 9-HODE в микросомах печени человека. [13] [14] [15]
Свободные радикалы и окисление синглетного кислорода [ править ]
Окислительный стресс в клетках и тканях вызывает окисление линолевой кислоты свободными радикалами и синглетным кислородом с образованием 13-HpODE, 9-HpODE, 13-HODE и 9-HODE; эти неферментативные реакции производят или подозреваются, но не доказано, что они производят приблизительно равные количества их S- и R- стереоизомеров. [16] [17] [18] Свободнорадикальное окисление линолевой кислоты также приводит к образованию 13-EE-HODE, 9-гидрокси-10 E , 12- E- октадекадиеновой кислоты, 9-гидрокси-10 E , 12- Z- октадекадиеновой кислоты. и 11-гидрокси-9 Z , 12 Z-октадекаеновая кислота, в то время как синглетный кислород атакует линолевую кислоту, производит (предположительно) рацемические смеси 9-гидрокси-10 E , 12- Z- октадекадиеновой кислоты, 10-гидрокси-8 E , 12 Z- октадекадиеновой кислоты и 12-гидрокси-9 Z -13- Е -octadecadienoic кислоты. [19] 4-Гидроксиноненаль (т.е. 4-гидрокси-2 E -ноненаль или HNE) также является продуктом перекисного окисления 13-HpODE. [20]Поскольку при окислительном стрессе обычно образуются как свободные радикалы, так и синглетный кислород, большая часть или все эти продукты могут образовываться вместе в тканях, подвергающихся окислительному стрессу. Свободные радикалы и окисление синглетного кислорода линолевой кислоты производят аналогичный набор метаболитов 13-HODE (см. 9-гидроксиоктадекадиеновая кислота ). Исследования приписывают эти окисления быть основной вклад в производство 13-HODE в тканях , подвергающихся окислительному стрессу в том числе у людей , очаги воспаления, стеатогепатита , сердечно - сосудистые заболевания о связанных атеромы бляшек, нейродегенеративные заболевания и т.д. (см оксидативный стресс ). [21] [19]
Метаболизм 13 ( S ) -HODE [ править ]
Подобно большинству полиненасыщенных жирных кислот и моногидроксил-полиненасыщенных жирных кислот, 13 ( S ) -HODE быстро и количественно включается в фосфолипиды ; [22] уровни 13 ( S ) -HODE, этерифицированного в sn-2 положении фосфатидилхолина , фосфатидилинозитола и фосфатидилэтаноламина в очагах псориаза человека значительно ниже, чем в нормальной коже; этот путь укорачивания цепи может быть ответственным за инактивацию 13 ( S ) -HODE. [23] 13 ( S ) -HODE также метаболизируется пероксисомами.-зависимые β-окисления до продуктов с укороченной цепью из 16, 14 и 12 атомов углерода, которые высвобождаются из клетки; [24] этот путь укорачивания цепи может служить неактивным и избавляться от 13 ( S ) -HODE.
13 ( S ) -HODE окисляется до 13-оксо-9 Z , 11 E- октадекадиеновой кислоты (13-оксо-HODE или 13-oxoODE) NAD + -зависимой 13-HODE дегидрогеназой, белок для которой был частично очищен из толстой кишки крысы. [25] [26] [27] Образование 13-оксо-ODE может представлять собой первый этап в 13 ( S ) -HODEs пероксисомозависимом укорочении цепи, но 13-оксо-ODE имеет свои собственные области биологической важности: он накапливается в тканях [28] [29] является биоактивным, [30] [31] и может иметь клиническое значение в качестве маркера для [32] [33] и потенциального участника [33]болезнь человека. Сам 13-оксо-ODE может реагировать с глутатионом в неферментативной реакции Михаэля или глутатионтрансферазозависимой реакции с образованием продуктов 13-оксо-ODE, содержащих двойную связь 11 транс и глутатион, присоединенный к углероду 9 в смеси S и R диастереомеры ; эти два диастереомера являются основными метаболитами 13 ( S ) -HODE в культивируемых клетках рака толстой кишки человека HT-29 . [34] Эксплантаты слизистой оболочки толстой кишки крыс Sprague-Dawley и клетки HT29 рака толстой кишки человека добавляют глутатион к 13-оксо-ODE в реакции Майкла.с образованием 13-оксо-9-глутатион-11 ( E ) -октадекаеновой кислоты; эта реакция конъюгации является ферментативной и опосредуется глутатионтрансферазой . [35] [36] Поскольку этот конъюгат может быстро экспортироваться из клетки и еще не охарактеризован на предмет биологической активности, неясно, выполняет ли эта трансферазная реакция какую-либо функцию, кроме удаления 13-оксо-ODE из клетки для ограничения ее Мероприятия. [34]
Действия [ править ]
Стимуляция рецепторов, активируемых пролифератором пероксисом [ править ]
13-HODE, 13-oxoODE и 13-EE-HODE (вместе с их аналогами 9-HODE) непосредственно активируют гамма-рецептор, активируемый пролифератором пероксисом (PPARγ). [37] [38] [39] Эта активация, по-видимому, ответственна за способность 13-HODE (и 9-HODE) индуцировать транскрипцию генов, индуцируемых PPARγ в моноцитах человека, а также стимулировать созревание этих клеток до макрофагов. . [37] 13 ( S ) -HODE (и 9 ( S ) -HODE) также стимулируют активацию бета-рецептора, активируемого пролифератором пероксисом (PPARβ) в модельной клеточной системе; Также предполагается, что 13-HODE (и 9-HODE) способствуют способности окисленныхлипопротеин низкой плотности (LDL) для активации PPARβ1: LDL, содержащий связанный с фосфолипидом 13-HODE (и 9-HODE), захватывается клеткой, а затем действует на фосфолипазы для высвобождения HODE, которые, в свою очередь, непосредственно активируют PPARβ1. [40]
Стимуляция рецептора TRPV1 [ править ]
13 ( S ) -HODE, 13 ( R ) -HODE и 13-oxoODE, наряду с их аналогами 9-HODE, также действуют на клетки через TRPV1 . TRPV1 представляет собой временный рецептор потенциального катионного канала V-члена 1 рецептора подсемейства (также называемый рецептором капсаицина или ваниллоидным рецептором 1). Эти 6 HODE, дублированные метаболиты окисленной линолевой кислоты (OXLAM), индивидуально, но также и, возможно, в большей степени при совместном действии, стимулируют TRPV1-зависимые ответы в нейронах грызунов, эпителиальных клетках бронхов грызунов и человека, а также в модельных клетках, способных экспрессировать грызуна или человека TRPV1. Эта стимуляция возникает из-за прямого взаимодействия этих агентов с TRPV1, хотя отчеты расходятся в отношении эффективности (OXLAM), например, с наиболее мощным OXLAM, 9 (S ) -HODE, для активации TRPV1 в нейронах грызунов требуется не менее 10 микромоль / литр [41] или более физиологическая концентрация 10 наномоль / литр [30] . Взаимодействию OXLAM-TRPV1 приписывают опосредование болевых ощущений у грызунов (см. Ниже).
Стимуляция рецептора GPR132 [ править ]
13 ( S ) -HpODE, и 13 ( S ) -HODE непосредственно активировать человеческий (но не мышь) GPR132 (G белком рецептор 132, также называемый G2A) в клетках яичника китайского хомячка сделано , чтобы выразить эти рецепторы; однако они являются гораздо более слабыми активаторами GPR132, чем 9 ( S ) -HpODE или 9 ( S ) -HODE. [42] [43] GPR132 первоначально был описан как рецептор, чувствительный к pH; роль (и) 13 ( S ) -HpODE и 13 ( S ) -HODE, а также 9 ( S ) -HpODE, 9 ( S ) HODE и серии или GPR132-активирующей арахидоновой кислотыгидроксиметаболиты (т.е. HETE) в активации G2A в физиологических и патологических условиях, в которых участвует G2A ( список этих состояний см. в GPR132 ), еще не определены. Это определение, поскольку оно может применяться к людям, затрудняется неспособностью этих HODE активировать GPR132 грызунов и, следовательно, быть проанализированным на моделях грызунов.
Участие в деградации митохондрий [ править ]
По мере созревания линии эритроцитов (см. Эритропоэз ) от ретикулоцитов, несущих митохондрии, до зрелых свободных от митохондрий эритроцитов у кроликов митохондрии накапливают связанный с фосфолипидом 13 ( S ) -HODE в своих мембранах из-за действия липоксигеназы, которая (у кроликов, мышей и других позвоночных- субприматов ) напрямую метаболизирует связанный с линолевой кислотой фосфолипид до фосфолипида, связанного с 13 ( S ) -HpODE, который быстро восстанавливается до фосфолипида, связанного с 13 ( S ) -HODE. [6] Предполагается, что накопление связанного с фосфолипидом 13 ( S ) -HpODE и / или 13 ( S) -HODE является критическим шагом в повышении проницаемости митохондрий, тем самым вызывая их деградацию и, следовательно, созревание до эритроцитов. [6] [44] Однако функциональная инактивация гена липоксигеназы, атакующего фосфолипиды, у мышей не вызывает серьезных дефектов эритропоэза. [45] Предполагается, что деградация митохондрий происходит, по крайней мере, по двум избыточным путям, помимо того, что запускается липоксигеназозависимым образованием 13 ( S ) -HpODE- и 13 ( S ) -HODE-связанных фосфолипидов, а именно, митохондриальное переваривание путем аутофагии и митохондриальный экзоцитоз . [46] Так или иначе, формирование 13 ( S) -HODE, связанный с фосфолипидом в митохондриальных мембранах, является одним из путей, посредством которого они становятся более проницаемыми и, таким образом, подвергаются деградации и, как следствие их высвобождения вредных элементов, вызывают повреждение клеток. [47]
Стимуляция лейкоцитов крови [ править ]
13-HODE (и 9-HODE) являются умеренно сильными стимуляторами направленной миграции (т.е. хемотаксиса ) нейтрофилов коровы и человека in vitro [48], тогда как 13 ( R ) -HODE (и 9 ( R ) -HODE, и 9 ( R ) -HODE) S ) -HODE) являются слабыми стимуляторами направленной миграции in vitro цитотоксических и потенциально повреждающих ткани лимфоцитов человека , то есть естественных клеток-киллеров . [49] Эти эффекты могут способствовать провоспалительному действию и повреждению тканей, приписываемому 13-HODE (и 9-HODE).
Участие в заболеваниях человека [ править ]
Атеросклероз [ править ]
При атеросклерозе , являющемся основной причиной ишемической болезни сердца и инсультов , атероматозные бляшки накапливаются в интиме сосудов, сужая размер кровеносных сосудов и уменьшая кровоток. В модели на животных и у людей 13-HODE (в основном этерифицированный до холестерина , фосфолипидов и, возможно, других липидов) является доминирующим компонентом этих бляшек. [50] [51] [52] [53] Поскольку эти исследования показали, что на ранней стадии развития бляшек, 13-HODE состоял в основном из Sстереоизомера, хотя более зрелые бляшки содержали равные количества стереоизомеров S и R , было высказано предположение, что 15-LOX-1 способствует раннему накоплению, в то время как цитохромные и / или свободнорадикальные пути вносят вклад в более позднее накопление бляшек. Дальнейшие исследования показывают, что 13 ( S ) -HODE способствует образованию бляшек, активируя фактор транскрипции , PPARγ (13 ( R ) -HODE не обладает этой способностью [54] ), который, в свою очередь, стимулирует выработку двух рецепторов на поверхности макрофагов. резидент в бляшках, 1) CD36рецептор-поглотитель окисленных липопротеинов низкой плотности, нативных липопротеинов, окисленных фосфолипидов и длинноцепочечных жирных кислот и 2) адипоцитарный белок 2 (aP2), белок, связывающий жирные кислоты; это может привести к тому, что макрофаги увеличат поглощение этих липидов, переходят в пенистые клетки , содержащие липиды , и тем самым увеличат размер бляшек. [55] Ось 13 ( S ) -HODE / PPARγ также вызывает самоуничтожение макрофагов за счет активации путей, вызывающих апоптоз ; этот эффект также может способствовать увеличению размера бляшек. [56] Эти исследования показывают, что метаболические пути, продуцирующие 13-HODE, [55] PPARγ, [55] [56] CD36,[57] и aP2 [58] могут быть терапевтическими мишенями для лечения заболеваний, связанных с атеросклерозом. Действительно, статины , которые, как известно, подавляют синтез холестерина путем ингибирования фермента в пути синтеза холестерина, 3-гидрокси-3-метил-глутарил-КоА-редуктазы HMG-CoA-редуктазы , широко используются для предотвращения атеросклероза и заболеваний, связанных с атеросклерозом. Статины также ингибируют PPARγ в человеческих макрофагах, эндотелиальных клетках сосудов и гладкомышечных клетках; это действие может способствовать их антиатерогенному эффекту. [59]
Астма [ править ]
У морских свинок 13 ( S ) -HODE при внутривенном введении вызывает сужение дыхательных путей в легких, а при вдыхании в виде аэрозоля имитирует астматическую гиперчувствительность к агентам, вызывающим сужение бронхов, за счет усиления реакции сужения дыхательных путей на метахолин и гистамин . [60] В мышиной модели аллерген-индуцированной астмы уровни 13-HODE повышены, [61] в последней модели на мышах инъекция антитела, направленного против 13 ( S ) -HODE, уменьшила многие патологические и физиологические особенности астма ,. [47] мыши вынуждены сверхэкспрессировать в легких мышиный фермент (12/15-липоксигеназу), который метаболизирует линолевую кислоту до 13 (S ) -HODE продемонстрировал повышенные уровни этого метаболита в легких, а также различные патологические и физиологические особенности астмы [61], а введение 13 ( S ) HODE воспроизвело многие из этих особенностей астмы [62] на мышиной модели. астмы и болезни человека, эпителиальные клетки дыхательных путей легких демонстрируют различные патологические изменения, включая нарушение их митохондрий [47] [61] [63] 13 ( S ) -HODE вызывает аналогичные разрушительные изменения в митохондриях культивируемых Beas 2B дыхательных путей человека эпителиальные клетки. [47] Кроме того, люди, страдающие астмой, демонстрируют повышенные уровни 13-HODE в крови, мокроте и смывах из альвеолы легких (т.е. жидкости бронхоальвеолярного лаважа БАЛ) и эозинофилов человека , которые участвуют в развитии астмы, метаболизируют линолевую кислоту до 13-HODE (и 9-HODE) в гораздо большей степени, чем любой другой тип лейкоцитов . [64] Механизм, ответственный за влияние 13-HODE на эпителиальные клетки дыхательных путей, может включать его активацию рецептора TRPV1 (см. Предыдущий раздел о TRPV1): этот рецептор высоко экспрессируется в эпителиальных клетках дыхательных путей мыши и человека, а также в эпителиальных клетках дыхательных путей человека Beas 2B и, кроме того, подавление экспрессии TRPV1, а также ингибитор рецептора TPRV1 (капсазепан) блокируют ответы дыхательных путей мыши на 13 (S) -HODE. [47] Хотя необходимы дальнейшие исследования, эти доклинические исследования позволяют предположить, что 13 ( S ) -HODE, производимый, по крайней мере частично, эозинофилами и действующий через TRPV1, может быть ответственным за повреждение дыхательных путей, которое происходит в более тяжелых формах. астмы и что фармакологические ингибиторы TRPV1 могут в конечном итоге оказаться полезными добавками к лечению астмы.
Рак [ править ]
Рак толстой кишки [ править ]
Семейный аденоматозный полипоз - это синдром, который включает предрасположенность к развитию колоректального рака (и других видов рака) из-за наследования дефектных мутаций в гене APC ( аденоматозный полипоз кишечной палочки ) или MUTYH . Эти мутации приводят к нескольким нарушениям регуляции роста эпителиальных клеток толстой кишки, которые в конечном итоге приводят к развитию кишечных полипов, которые имеют высокий риск превращения в раковые. [65] Одной из аномалий, обнаруженных при заболевании APC, является прогрессирующее снижение уровня 15-липоксигеназы 1 вместе с ее продуктом, 13-HODE (предполагается, но не однозначно показано, что это S стереоизомер) по мере продвижения заболевания толстой кишки от полипа до злокачественной стадии; 15-НЕТЕ, 5-липоксигеназа, 12-липоксигеназа и 15-липоксигеназа-2 и отдельные метаболиты последних липоксигеназ не обнаруживают такой связи. [66] [67] [68] Подобное избирательное снижение 15-липоксигеназы 1 и 13-HODE происходит при ненаследственном раке толстой кишки. [69] [70] [66] 13 ( S ) -HODE подавляет пролиферацию и вызывает гибель ( апоптоз ) культивированных клеток рака толстой кишки человека. [54] [69] [71] [70]Исследования на животных моделях также показывают, что ось 15-липоксигеназы 1/13-HODE ингибирует развитие лекарственно-индуцированного рака толстой кишки, а также рост эксплантатов клеток рака толстой кишки человека. [67] Эти результаты позволяют предположить, что 15-липоксигеназа 1 и ее продукт 13 ( S ) -HODE являются факторами, способствующими развитию генетически ассоциированного и несвязанного рака толстой кишки; они действуют, способствуя подавлению развития и / или роста этого рака, а при их уменьшении или отсутствии позволяют его безудержный злокачественный рост.
Рак груди [ править ]
13 ( S ) -HODE стимулирует пролиферацию линий клеток рака груди человека, положительных по рецептору MCF-7 эстрогена, и отрицательных по рецептору эстрогена MBA-MD-231 (см. Список линий клеток рака груди ) в культуре); [72] его производство, по-видимому, необходимо для эпидермального фактора роста и фактора роста опухоли α, чтобы стимулировать пролиферацию культивированных клеток рака молочной железы человека BT-20 [73] и для роста ксенотрансплантатов рака груди у мышей; [74]и среди серии из 10 метаболитов полиненасыщенных жирных кислот, количественно определенных в ткани рака груди человека, только 13-HODE (стереоизомер не определен) был значительно повышен при быстрорастущем раке по сравнению с более медленным ростом рака. [72] Результаты этих исследований показывают, что 13 ( S ) -HODE может способствовать росту рака груди у людей.
Рак простаты [ править ]
15-LOX 1 сверхэкспрессируется при раке предстательной железы по сравнению с доброкачественной тканью предстательной железы, и уровни его экспрессии в культивируемых различных клеточных линиях рака предстательной железы человека положительно коррелируют со скоростью их пролиферации и усиливают ответ пролиферации клеток рака простаты на эпидермальный фактор роста. и инсулиноподобный фактор роста 1); его уровни в тканях рака простаты человека также положительно коррелируют с тяжестью рака, судя по шкале Глисона для рака ; сверхэкспрессия 15-LOX 1, по-видимому, не только увеличивает пролиферацию клеток рака предстательной железы, но также способствует выживанию его клеток за счет стимуляции выработки инсулиноподобного фактора роста 1 и, возможно, изменения Bcl-2пути клеточного апоптоза, а также увеличивает васкуляризацию опухоли предстательной железы и, таким образом, метастазирование за счет стимуляции выработки фактора роста эндотелия сосудов . Эти эффекты 15-LOX 1 возникают из-за продукции фермента 13 ( S ) -HODE. [75] [76] [77] Ось 15-LOX 1/13 ( S ) -HODE также способствует росту рака простаты в различных моделях животных. [78] [79] В одном из животной модели эффекты про-рост 15-LOX 1 были изменены диетическим нацеливанием: увеличение диетической линолевой кислоты, омега-6 жирные кислоты , способствуют в то время как увеличение диетической стеаридоновой кислоты, омега- 3 жирные кислотыуменьшил рост эксплантатов рака простаты человека. [80] Эти эффекты могут быть связаны со способностью диеты с линолевой кислотой увеличивать производство метаболита 15-Lox 1, 13-HODE, [80] и способностью стеаридоновой кислоты увеличивать выработку докозагексаеновой кислоты и метаболиты 15-LOX-1 докозагексаеновой кислоты, 17S-гидропероксидокоза-гекса-4Z, 7Z, 10Z, 13 Z, 15E, 19Z-еноат (17-HpDHA, 17S-гидроксидокозагекса-4Z, 7Z, 10Z, 13Z, 15E, 19Z-еноат (17-HDHA), 10S, 17S-дигидроксидокозагекса-4Z, 7Z, 11E, 13Z, 15E, 19Z-еноат (10,17-diHDHA, протектин DX) и 7S, 17S- дигидроксидоксагекса-4Z, 8E, 10Z, 13Z, 15E, 19Z-еноат (7,17-дигДГА, протектин D5), все из которых являются ингибиторами пролиферации культивируемых клеток рака предстательной железы человека. [81] [82][83]
Маркеры болезни [ править ]
Уровни 13-HODE повышены, по сравнению с соответствующим контролем, в липопротеинов низкой плотности , выделенных от людей с ревматоидным артритом , [84] в липопротеинов высокой плотности фракции пациентов с сахарным диабетом , [85] в сыворотке индивидуумов с поликистоза почек болезнь . [86] или хронический панкреатит, [87] и в плазме людей с алкогольным и неалкогольным стеатогепатитом . [88] [89] Уровень общих HODE, который включает различные изомеры 13-HODE и 9-HODE, повышен в плазме и эритроцитах пациентов сБолезнь Альцгеймера и в плазме, но не в эритроцитах пациентов с сосудистой деменцией по сравнению с нормальными добровольцами. [90] См. Раздел 9-гидроксиоктадекадиеновая кислота о 9-HODE как маркерах заболевания, вызывающего окислительный стресс, для получения дополнительных сведений. Эти исследования показывают, что высокие уровни HODE могут быть полезны для индикации наличия и прогрессирования указанных заболеваний. Однако поскольку абсолютные значения HODE, обнаруженные в различных исследованиях, сильно различаются, поскольку уровни HODE варьируются в зависимости от потребления линолевой кислоты с пищей, поскольку HODE могут образовываться во время обработки тканей, и поскольку аномальные уровни HODE не связаны с конкретным заболеванием, использование этих метаболитов в качестве маркеров не принесло клинической пользы. [21] [91] [92][19] Маркеры HODE могут оказаться полезными в качестве маркеров конкретного заболевания, типа заболевания и / или прогрессирования заболевания в сочетании с другими маркерами заболевания. [19] [93]
Ссылки [ править ]
- ^ а б Соберман, Р. Дж; Харпер, Т. У; Беттеридж, Д.; Льюис, Р. А; Остин, К. Ф. (1985). «Характеристика и разделение 5-липоксигеназы арахидоновой кислоты и омега-6 липоксигеназы линолевой кислоты (15-липоксигеназа арахидоновой кислоты) полиморфно-ядерных лейкоцитов человека» . Журнал биологической химии . 260 (7): 4508–15. DOI : 10.1016 / S0021-9258 (18) 89293-6 . PMID 3920219 .[ постоянная мертвая ссылка ]
- ^ а б Векслер, Аарон Т; Кеньон, Виктор; Дешам, Джошуа Д.; Холман, Теодор Р. (2008). «Изменения специфичности субстрата для ретикулоцитов человека и эпителиальных 15-липоксигеназ обнаруживают регуляцию аллостерического продукта» . Биохимия . 47 (28): 7364–75. DOI : 10.1021 / bi800550n . PMC 2603187 . PMID 18570379 .
- ^ Рейно, О; Delaforge, M; Boucher, JL; Rocchiccioli, F; Mansuy, D (1989). «Окислительный метаболизм линолевой кислоты лейкоцитами человека». Сообщения о биохимических и биофизических исследованиях . 161 (2): 883–91. DOI : 10.1016 / 0006-291X (89) 92682-X . PMID 2735926 .
- ^ Кюн, Хартмут; Барнетт, Джим; Грюнбергер, Дорит; Беккер, Престон; Чоу, Джоан; Нгуен, Бинь; Бурштын-Петтегрю, Хела; Чан, Харди; Сигал, Эллиотт (1993). «Сверхэкспрессия, очистка и характеристика рекомбинантной 15-липоксигеназы человека». Biochimica et Biophysica Acta (BBA) - липиды и липидный метаболизм . 1169 (1): 80–89. DOI : 10.1016 / 0005-2760 (93) 90085-N . PMID 8334154 .
- ^ Кун, Хартмут; Вальтер, Матиас; Кубань, Ральф Юрген (2002). «Арахидонат-15-липоксигеназы млекопитающих». Простагландины и другие липидные медиаторы . 68–69: 263–290. DOI : 10.1016 / S0090-6980 (02) 00035-7 . PMID 12432923 .
- ^ а б с Кюн, H; Браш, А. Р. (1990). «Появление продуктов липоксигеназы в мембранах ретикулоцитов кролика. Доказательства роли липоксигеназы ретикулоцитов в созревании эритроцитов» . Журнал биологической химии . 265 (3): 1454–8. DOI : 10.1016 / S0021-9258 (19) 40037-9 . PMID 2104842 . [ постоянная мертвая ссылка ]
- ^ Белкнер, J; Стендер, H; Кюн, Х (1998). «Кроличья 15-липоксигеназа предпочтительно насыщает кислородом сложные эфиры холестерина ЛПНП, и эта реакция не требует витамина Е» . Журнал биологической химии . 273 (36): 23225–32. DOI : 10.1074 / jbc.273.36.23225 . PMID 9722553 . [ постоянная мертвая ссылка ]
- ^ Brash, A. R; Boeglin, W. E; Чанг, М. С (1997). «Открытие второй 15S-липоксигеназы у человека» . Труды Национальной академии наук . 94 (12): 6148–52. Bibcode : 1997PNAS ... 94.6148B . DOI : 10.1073 / pnas.94.12.6148 . PMC 21017 . PMID 9177185 .
- ^ Векслер, Аарон Т; Кеньон, Виктор; Гарсия, Натали К.; Дешам, Джошуа Д.; Ван дер Донк, Уилфред А; Холман, Теодор Р. (2009). "Кинетические и структурные исследования аллостерического сайта в человеческом эпителиальной 15-липоксигеназе-2" . Биохимия . 48 (36): 8721–30. DOI : 10.1021 / bi9009242 . PMC 2746553 . PMID 19645454 .
- ^ Laneuville, О; Брейер, Д. К.; Сюй, N; Huang, Z. H; Гейдж, Д. А; Уотсон, Дж. Т.; Лагард, М; Dewitt, D. L; Смит, В. Л. (1995). «Особенности жирнокислотного субстрата простагландин-эндопероксида H-синтазы-1 и -2. Образование 12-гидрокси- (9Z, 13E / Z, 15Z) -октадекатриеновых кислот из альфа-линоленовой кислоты» . Журнал биологической химии . 270 (33): 19330–6. DOI : 10.1074 / jbc.270.33.19330 . PMID 7642610 . [ постоянная мертвая ссылка ]
- ^ a b Godessart, Нурия; Камачо, Мерседес; Лопес-Бельмонте, Хесус; Антон, Роза; Гарсия, Монтсеррат; Де Морагас, Хосеп-Мария; Вила, Луис (1996). «Простагландин H-синтаза-2 является основным ферментом, участвующим в биосинтезе октадеканоидов из линолевой кислоты в дермальных фибробластах человека, стимулированных интерлейкином-1β». Журнал следственной дерматологии . 107 (5): 726–32. DOI : 10.1111 / 1523-1747.ep12365616 . PMID 8875957 .
- ^ Хамберг, Матс; Самуэльссон, Бенгт (1980). «Стереохимия в образовании [9-гидрокси-10,12-октадекадиеновой кислоты и 13-гидрокси-9,11-октадекадиеновой кислоты из линолевой кислоты циклооксигеназой жирных кислот». Biochimica et Biophysica Acta (BBA) - липиды и липидный метаболизм . 617 (3): 545–7. DOI : 10.1016 / 0005-2760 (80) 90022-3 . PMID 6768399 .
- ^ Линдстрем, Терри D; Ост, Стивен Д. (1984). «Исследования по цитохрому P-450-зависимому восстановлению гидропероксида липидов». Архивы биохимии и биофизики . 233 (1): 80–7. DOI : 10.1016 / 0003-9861 (84) 90603-9 . PMID 6431911 .
- ^ Oliw, Эрнст Н (1993). «Бис-аллильное гидроксилирование линолевой кислоты и арахидоновой кислоты монооксигеназами печени человека». Biochimica et Biophysica Acta (BBA) - липиды и липидный метаболизм . 1166 (2–3): 258–63. DOI : 10.1016 / 0005-2760 (93) 90106-J . PMID 8443245 .
- ^ Рупарел, Шивани; Грин, Дастин; Чен, Пол; Харгривз, Кеннет М (2012). «Ингибитор цитохрома P450, кетоконазол, ингибирует периферическую воспалительную боль, опосредованную метаболитом окисленной линолевой кислоты» . Молекулярная боль . 8 : 1744–8069–8–73. DOI : 10.1186 / 1744-8069-8-73 . PMC 3488501 . PMID 23006841 .
- ^ Франкель, EN (1984). «Химия свободнорадикального и синглетного окисления липидов». Прогресс в исследованиях липидов . 23 (4): 197–221. DOI : 10.1016 / 0163-7827 (84) 90011-0 . PMID 6100997 .
- ^ Спителлер, Питер; Спителлер, Герхард (1998). «Сильная зависимость спектра продуктов перекисного окисления липидов от того, используется ли Fe2 + / O2 или Fe3 + / O2 в качестве окислителя». Biochimica et Biophysica Acta (BBA) - липиды и липидный метаболизм . 1392 (1): 23–40. DOI : 10.1016 / S0005-2760 (97) 00209-9 . PMID 9593808 .
- ^ Пунта, Карло; Ректор, Кристофер Л; Портер, Нед А. (2005). «Перекисное окисление метиловых эфиров полиненасыщенных жирных кислот, катализируемое N-метилбензогидроксамовой кислотой: новый и удобный метод селективного синтеза гидропероксидов и спиртов». Химические исследования в токсикологии . 18 (2): 349–56. DOI : 10.1021 / tx049685x . PMID 15720142 .
- ^ a b c d Ёсида, Ясукадзу; Умено, Ая; Акадзава, Йоко; Шичири, Мототада; Муротоми, Кадзутоши; Хори, Масанори (2015). «Химия продуктов перекисного окисления липидов и их использование в качестве биомаркеров при раннем выявлении заболеваний» . Журнал Oleo Science . 64 (4): 347–56. DOI : 10,5650 / jos.ess14281 . PMID 25766928 .
- ^ Риахи, Яэль; Коэн, Гай; Шамни, Офер; Сассон, Шломо (2010). «Сигнальные и цитотоксические функции 4-гидроксиалкеналов». Американский журнал физиологии. Эндокринология и обмен веществ . 299 (6): E879–86. DOI : 10,1152 / ajpendo.00508.2010 . PMID 20858748 .
- ^ a b Рамсден, Кристофер Э; Рингель, Амит; Фельдштейн, Ариэль Э; Таха, Амир Y; Макинтош, Бет А; Hibbeln, Joseph R; Майчрзак-Хонг, Шарон Ф .; Faurot, Keturah R; Рапопорт, Стэнли I; Cheon, Yewon; Чунг, Юн-Ми; Берк, Майкл; Дуглас Манн, Дж (2012). «Снижение содержания линолевой кислоты в рационе снижает биологически активные метаболиты окисленной линолевой кислоты в организме человека» . Простагландины, лейкотриены и незаменимые жирные кислоты . 87 (4–5): 135–41. DOI : 10.1016 / j.plefa.2012.08.004 . PMC 3467319 . PMID 22959954 .
- ^ Чо, Y; Цзыбо, В. А (1994). «Включение 13-гидроксиоктадекадиеновой кислоты (13-HODE) в эпидермальные церамиды и фосфолипиды: катализируемое фосфолипазой C высвобождение нового 13-HODE-содержащего диацилглицерина» . Журнал липидных исследований . 35 (2): 255–62. DOI : 10.1016 / S0022-2275 (20) 41214-3 . PMID 8169529 . [ постоянная мертвая ссылка ]
- ^ Grøn, B; Иверсен, L; Ziboh, V; Kragballe, K (1993). «Моногидроксижирные кислоты, этерифицированные до фосфолипидов, уменьшаются в пораженной псориатической коже». Архив дерматологических исследований . 285 (8): 449–54. DOI : 10.1007 / BF00376816 . PMID 8274032 . S2CID 25517644 .
- ^ Клык, X; Kaduce, T. L; Спектор, А.А. (1999). «Включение 13- (S) -гидроксиоктадекадиеновой кислоты (13-HODE) и превращение в новые продукты эндотелиальными клетками» . Журнал липидных исследований . 40 (4): 699–707. PMID 10191294 . [ постоянная мертвая ссылка ]
- ^ Бык, A. W; Earles, S.M; Бронштейн, Дж. К. (1991). «Метаболизм окисленной линолевой кислоты: Распределение активности ферментативного окисления 13-гидроксиоктадекадиеновой кислоты до 13-оксооктадекадиеновой кислоты в тканях крысы». Простагландины . 41 (1): 43–50. DOI : 10.1016 / 0090-6980 (91) 90103-M . PMID 2020745 .
- ^ Бык, A. W; Брантинг, К; Бронштейн, Дж. С; Блэкберн, М. Л.; Стропила, J (1993). «Повышает активность дегидрогеназы 13-гидроксиоктадекадиеновой кислоты во время дифференцировки культивируемых клеток». Канцерогенез . 14 (11): 2239–43. DOI : 10.1093 / carcin / 14.11.2239 . PMID 8242849 .
- ^ Эрлз, Соня М; Бронштейн, Джоэл С; Победитель, Дэвид Л. Бык, Артур В (1991). «Метаболизм окисленной линолевой кислоты: характеристика дегидрогеназы 13-гидроксиоктадекадиеновой кислоты из ткани толстой кишки крысы». Biochimica et Biophysica Acta (BBA) - липиды и липидный метаболизм . 1081 (2): 174–80. DOI : 10.1016 / 0005-2760 (91) 90023-B . PMID 1998735 .
- ^ Кюн, H; Белкнер, Дж; Wiesner, R; Ольха, L (1990). «Появление 9- и 13-кето-октадекадиеновой кислоты в биологических мембранах, оксигенированных липоксигеназой ретикулоцитов». Архивы биохимии и биофизики . 279 (2): 218–24. DOI : 10.1016 / 0003-9861 (90) 90484-G . PMID 2112367 .
- ^ Уоддингтон, Эмма; Сиенуарине, Кишор; Падди, Ян; Крофт, Кевин (2001). «Идентификация и количественное определение уникальных продуктов окисления жирных кислот в атеросклеротической бляшке человека с использованием высокоэффективной жидкостной хроматографии». Аналитическая биохимия . 292 (2): 234–44. DOI : 10,1006 / abio.2001.5075 . PMID 11355856 .
- ^ а б Patwardhan, A. M; Шотландия, П.Е .; Акопян, А.Н. Харгривз, К. М. (2009). «Активация TRPV1 в спинном мозге окисленными метаболитами линолевой кислоты способствует воспалительной гипералгезии» . Труды Национальной академии наук . 106 (44): 18820–4. DOI : 10.1073 / pnas.0905415106 . PMC 2764734 . PMID 19843694 .
- ^ Альтманн, Райнхольд; Хаусманн, Мартин; Шпёттль, Таня; Грубер, Майкл; Бык, Артур В; Мензель, Катрин; Вогл, Даниэла; Херфарт, Ганс; Шёльмерих, Юрген; Фальк, Вернер; Роглер, Герхард (2007). «13-Oxo-ODE представляет собой эндогенный лиганд PPARγ в эпителиальных клетках толстой кишки человека». Биохимическая фармакология . 74 (4): 612–22. DOI : 10.1016 / j.bcp.2007.05.027 . PMID 17604003 .
- ^ Гувейя-Фигейра, Сандра; Späth, Jana; Живкович, Анджела М; Нординг, Малин L (2015). «Профилирование метаболома оксилипина и эндоканнабиноидов с помощью UPLC-ESI-MS / MS в плазме человека для мониторинга постпрандиального воспаления» . PLOS ONE . 10 (7): e0132042. Bibcode : 2015PLoSO..1032042G . DOI : 10.1371 / journal.pone.0132042 . PMC 4506044 . PMID 26186333 .
- ^ а б Зейн, Клаудиа О; Лопес, Росио; Фу, Сяомин; Кирван, Джон П.; Ериан, Лиза М; Маккалоу, Артур Дж; Хазен, Стэнли Л; Фельдштейн, Ариэль Э (2012). «Пентоксифиллин снижает количество продуктов окисления липидов при неалкогольном стеатогепатите: новые данные о потенциальном терапевтическом механизме» . Гепатология . 56 (4): 1291–9. DOI : 10.1002 / hep.25778 . PMC 3430813 . PMID 22505276 .
- ^ а б Мерфи, Роберт С; Зарини, Симона (2002). «Аддукты глутатиона оксиэйкозаноидов». Простагландины и другие липидные медиаторы . 68–69: 471–82. DOI : 10.1016 / S0090-6980 (02) 00049-7 . PMID 12432937 .
- ^ Бык, Артур W; Бронштейн, Джоэл С; Эрлз, Соня М; Блэкберн, Мэри L (1996). «Образование аддуктов между 13-оксооктадекадиеновой кислотой (13-OXO) и тиолами, полученными из белков, in vivo и in vitro». Науки о жизни . 58 (25): 2355–65. DOI : 10.1016 / 0024-3205 (96) 00236-6 . PMID 8649225 .
- ^ Блэкберн, Мэри L; Подгорский, Изабела; Бык, Артур В (1999). «Специфические белковые мишени 13-оксооктадекадиеновой кислоты (13-OXO) и экспорт конъюгата 13-OXO-глутатион в клетки HT-29». Biochimica et Biophysica Acta (BBA) - молекулярная и клеточная биология липидов . 1440 (2–3): 225–34. DOI : 10.1016 / S1388-1981 (99) 00123-7 . PMID 10521706 .
- ^ a b Надь, Ласло; Тонтоноз, Питер; Альварес, Жаклин Г.А.; Чен, Хунву; Эванс, Рональд М (1998). «Окисленный ЛПНП регулирует экспрессию генов макрофагов посредством активации PPARγ лигандом». Cell . 93 (2): 229–40. DOI : 10.1016 / S0092-8674 (00) 81574-3 . PMID 9568715 . S2CID 7573475 .
- ^ Ито, Т; Fairall, L; Амин, К; Инаба, Y; Szanto, A; Балинт, Б.Л .; Надь, L; Ямамото, К; Швабе, Дж. В (2008). «Структурная основа активации PPARgamma окисленными жирными кислотами» . Структурная и молекулярная биология природы . 15 (9): 924–31. DOI : 10.1038 / nsmb.1474 . PMC 2939985 . PMID 19172745 .
- ^ Ёкои, Хироши; Мизуками, Хадзиме; Нагацу, Акито; Оно, Такамаса; Танабэ, Хироки; Иноуэ, Макото (2009). «Активированные пероксисомным пролифератором γ-лиганды рецептора, выделенные из семян Adlay (Coix lacryma-jobi L. Var. Ma-yuen STAPF.)» . Биологический и фармацевтический бюллетень . 32 (4): 735–40. DOI : 10.1248 / bpb.32.735 . PMID 19336916 .
- ^ Делерив, Филипп; Фурман, Кристоф; Тесье, Элизабет; Фрюшар, Жан-Шарль; Дурье, Патрик; Стэлс, Барт (2000). «Окисленные фосфолипиды активируют PPARα зависимым от фосфолипазы A2 образом». Письма FEBS . 471 (1): 34–8. DOI : 10.1016 / S0014-5793 (00) 01364-8 . PMID 10760508 . S2CID 85113031 .
- ^ Де Петрочеллис, Лучано; Скиано Мориелло, Аниелло; Императоре, Роберта; Кристино, Луиджа; Старович, Катажина; Ди Марцо, Винченцо (2012). «Переоценка активности 9-HODE на каналах TRPV1 по сравнению с анандамидом: энантиоселективность и эффекты на других каналах TRP и в сенсорных нейронах» . Британский журнал фармакологии . 167 (8): 1643–51. DOI : 10.1111 / j.1476-5381.2012.02122.x . PMC 3525867 . PMID 22861649 .
- ^ Обината, Хидеру; Идзуми, Такаши (2009). «G2A как рецептор окисленных свободных жирных кислот». Простагландины и другие липидные медиаторы . 89 (3–4): 66–72. DOI : 10.1016 / j.prostaglandins.2008.11.002 . PMID 19063986 .
- ^ Инь, Хун; Чу, Алан; Ли, Вэй; Ван, Бин; Шелтон, Фабиола; Отеро, Франселла; Нгуен, Дебора Дж. Колдуэлл, Джереми С; Чен, Ю Алиса (2009). «Идентификация лиганда рецептора, связанного с липидом G, с использованием анализа β-Arrestin Path Hunter ™» . Журнал биологической химии . 284 (18): 12328–38. DOI : 10.1074 / jbc.M806516200 . PMC 2673301 . PMID 19286662 .
- ^ Ван Лейен, Клаус; Duvoisin, Роберт М; Энгельгардт, Харальд; Видманн, Мартин (1998). «Функция липоксигеназы в запрограммированной деградации органелл». Природа . 395 (6700): 392–5. Bibcode : 1998Natur.395..392V . DOI : 10,1038 / 26500 . PMID 9759730 . S2CID 4366265 .
- ^ Вс, D; Функ, C.D (1996). «Нарушение экспрессии 12/15-липоксигеназы в перитонеальных макрофагах. Повышенное использование пути 5-липоксигеназы и снижение окисления липопротеинов низкой плотности» . Журнал биологической химии . 271 (39): 24055–62. DOI : 10.1074 / jbc.271.39.24055 . PMID 8798642 . [ постоянная мертвая ссылка ]
- ^ Иванов, Игорь; Кун, Хартмут; Хейдек, Дагмар (2015). «Структурная и функциональная биология 15-липоксигеназы-1 арахидоновой кислоты (ALOX15)» . Джин . 573 (1): 1–32. DOI : 10.1016 / j.gene.2015.07.073 . PMC 6728142 . PMID 26216303 .
- ^ a b c d e Мабалираджан, Улаганатан; Рехман, Рахшинда; Ахмад, Танвир; Кумар, Сарвеш; Сингх, Сучита; Leishangthem, Geeta D; Айч, Джотирмой; Кумар, Маниш; Кханна, Критика; Сингх, Виджай П.; Динда, Амит К.; Бисвал, Шьям; Агравал, Анураг; Гош, Баларам (2013). «Метаболит линолевой кислоты вызывает тяжелую астму, вызывая повреждение эпителия дыхательных путей» . Научные отчеты . 3 : 1349. Bibcode : 2013NatSR ... 3E1349M . DOI : 10.1038 / srep01349 . PMC 3583002 . PMID 23443229 .
- ^ Хенрикс, П. А; Энгельс, Ф; Van Der Vliet, H; Nijkamp, F.P (1991). «9- и 13-гидроксилинолевая кислоты обладают хемотаксической активностью в отношении полиморфно-ядерных лейкоцитов крупного рогатого скота и человека». Простагландины . 41 (1): 21–7. DOI : 10.1016 / 0090-6980 (91) 90101-K . PMID 2020743 .
- ^ Ролин, Йоханнес; Аль-Джадери, Зайдун; Магхазачи, Аззам А (2013). «Окисленные липиды и лизофосфатидилхолин вызывают хемотаксис и приток внутриклеточного кальция в естественные клетки-киллеры». Иммунобиология . 218 (6): 875–83. DOI : 10.1016 / j.imbio.2012.10.009 . PMID 23200035 .
- ^ Кюн, H; Белкнер, Дж; Zaiss, S; Fährenklemper, T; Wohlfeil, S (1994). «Участие 15-липоксигеназы на ранних стадиях атерогенеза» . Журнал экспериментальной медицины . 179 (6): 1903–11. DOI : 10,1084 / jem.179.6.1903 . PMC 2191515 . PMID 8195716 .
- ^ Folcik, VA; Нивар-Аристы, РА; Краевский, Л.П .; Кэткарт, МК (1995). «Липоксигеназа способствует окислению липидов в атеросклеротических бляшках человека» . Журнал клинических исследований . 96 (1): 504–10. DOI : 10.1172 / JCI118062 . PMC 185224 . PMID 7615823 .
- ^ Уоддингтон, Эмма I; Крофт, Кевин Д. Сиенуарине, Кишор; Латам, Брюс; Пудди, Ян Б. (2003). «Продукты окисления жирных кислот в атеросклеротической бляшке человека: анализ клинических и гистопатологических коррелятов». Атеросклероз . 167 (1): 111–20. DOI : 10.1016 / S0021-9150 (02) 00391-X . PMID 12618275 .
- ^ Кюн, H; Heydeck, D; Хуго, я; Гниотта, К. (1997). «Действие 15-липоксигеназы in vivo на ранних стадиях атерогенеза человека» . Журнал клинических исследований . 99 (5): 888–93. DOI : 10.1172 / JCI119253 . PMC 507896 . PMID 9062346 .
- ^ a b Кабрал, Марисоль; Мартин-Венегас, Ракель; Морено, Хуан Хосе (2014). «Дифференциальный рост клеток / поведение апоптоза энантиомеров 13-гидроксиоктадекадиеновой кислоты в клеточной линии колоректального рака». Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени . 307 (6): G664–71. DOI : 10,1152 / ajpgi.00064.2014 . PMID 25035111 .
- ^ a b c Ли Кеннеди, R; Вангавети, Венкат; Джаррод, Гассан; Шашидхар, Венкатеш; Шашидхар, Венкатеш; Бауне, Бернхард Т (2010). «Обзор: Рецепторы свободных жирных кислот: новые цели для лечения диабета и его осложнений» . Терапевтические достижения в эндокринологии и метаболизме . 1 (4): 165–75. DOI : 10.1177 / 2042018810381066 . PMC 3474614 . PMID 23148161 .
- ^ a b Вангавети, Венкат Н; Шашидхар, Венкатеш М; Раш, Кэтрин; Малабу, Усман Х; Расалам, Рой Р.; Кольер, Фиона; Бауне, Бернхард Т; Кеннеди, Ричард Л. (2014). «Гидроксиоктадекадиеновые кислоты регулируют апоптоз в человеческих клетках THP-1 PPARγ-зависимым образом». Липиды . 49 (12): 1181–92. DOI : 10.1007 / s11745-014-3954-Z . PMID 25330944 . S2CID 4062623 .
- ^ Феббрайо, Мария; Подрез, Евгений А; Смит, Джонатан Д; Хаджар, Дэвид П.; Хазен, Стэнли Л; Хофф, Генри Ф; Шарма, Кавита; Сильверштейн, Рой L (2000). «Целенаправленное разрушение рецептора скавенджера класса B CD36 защищает от развития атеросклеротического поражения у мышей» . Журнал клинических исследований . 105 (8): 1049–56. DOI : 10.1172 / JCI9259 . PMC 300837 . PMID 10772649 .
- ^ Маковски, Лиза; Борд, Джеффри Б.; Маэда, Кадзухиса; Бабаев Владимир Р; Уйсал, К. Теоман; Морган, Морин А; Паркер, Рекс А; Саттлс, Джилл; Фацио, Серхио; Hotamisligil, Gökhan S; Линтон, Macrae F (2001). «Отсутствие макрофагов, связывающего жирные кислоты протеина aP2, защищает мышей с дефицитом аполипопротеина E от атеросклероза» . Природная медицина . 7 (6): 699–705. DOI : 10.1038 / 89076 . PMC 4027052 . PMID 11385507 .
- ↑ Фукуда, Кадзуки; Мацумура, Такеши; Сенокучи, Такафуми; Исии, Норио; Киношита, Хироюки; Ямада, Сари; Мураками, Сайко; Накао, Сая; Мотосима, Хироюки; Кондо, Тацуя; Кукидомэ, Дайсуке; Кавасаки, Сюдзи; Кавада, Теруо; Нисикава, Такеши; Араки, Эйити (2015). «Статины опосредуют антиатеросклеротическое действие в гладкомышечных клетках за счет активации рецептора-γ, активируемого пролифератором пероксисом». Сообщения о биохимических и биофизических исследованиях . 457 (1): 23–30. DOI : 10.1016 / j.bbrc.2014.12.063 . PMID 25529449 .
- ^ Хенрикс, P; Энгельс, Ф; Вандерлинде, H; Гарссен, Дж; Nijkamp, F (1995). «13-гидроксилинолевая кислота вызывает гиперреактивность дыхательных путей к гистамину и метахолину у морских свинок in vivo». Журнал аллергии и клинической иммунологии . 96 (1): 36–43. DOI : 10.1016 / S0091-6749 (95) 70030-7 . PMID 7622761 .
- ^ а б в Мабалираджан, U; Динда, А. К; Кумар, S; Рошан, Р; Gupta, P; Шарма, С.К .; Гош, Б. (2008). «Структурные изменения и дисфункция митохондрий связаны с экспериментальной аллергической астмой» . Журнал иммунологии . 181 (5): 3540–8. DOI : 10.4049 / jimmunol.181.5.3540 . PMID 18714027 .
- ^ Мабалираджан, Улаганатан; Рехман, Рахшинда; Ахмад, Танвир; Кумар, Сарвеш; Сингх, Сучита; Leishangthem, Geeta D; Айч, Джотирмой; Кумар, Маниш; Кханна, Критика; Сингх, Виджай П.; Динда, Амит К.; Бисвал, Шьям; Агравал, Анураг; Гош, Баларам (2013). «Метаболит линолевой кислоты вызывает тяжелую астму, вызывая повреждение эпителия дыхательных путей» . Научные отчеты . 3 : 1349. Bibcode : 2013NatSR ... 3E1349M . DOI : 10.1038 / srep01349 . PMC 3583002 . PMID 23443229 .
- ^ Томас, Биджу; Рутман, Эндрю; Херст, Роберт А; Халдар, Пранаб; Вардлоу, Эндрю Дж; Bankart, Джон; Брайтлинг, Кристофер Э; О'Каллаган, Кристофер (2010). «Цилиарная дисфункция и ультраструктурные аномалии - признаки тяжелой астмы». Журнал аллергии и клинической иммунологии . 126 (4): 722–729.e2. DOI : 10.1016 / j.jaci.2010.05.046 . PMID 20673980 .
- ^ Энгельс, F; Kessels, G.C; Хенрикс, П. А; Nijkamp, F.P (1996). «Предпочтительное образование 13-гидроксилинолевой кислоты эозинофилами периферической крови человека». Простагландины . 52 (2): 117–24. DOI : 10.1016 / 0090-6980 (96) 00057-3 . PMID 8880897 .
- ^ Легкое, M. S; Тренер, A.H; Кэмпбелл, I; Липтон, Л. (2015). «Семейный колоректальный рак» . Журнал внутренней медицины . 45 (5): 482–91. DOI : 10.1111 / imj.12736 . PMID 25955461 .
- ^ а б Шурейки, я; Чен, Д; Дэй, Р. С; Цзо, X; Хохман, Ф. Л; Росс, В. А; Коул, Р. А; Мой, О; Моррис, Дж. С; Сяо, L; Newman, R.A; Ян, П; Липпман, С. М. (2010). «Профилирование метаболизма липоксигеназы на конкретных этапах колоректального опухолевого процесса» . Исследования по профилактике рака . 3 (7): 829–38. DOI : 10.1158 / 1940-6207.CAPR-09-0110 . PMC 2900425 . PMID 20570882 .
- ^ а б Цзо, Сяншэн; Шурейки, Имад (2013). «Профилирование эйкозаноидов при раке толстой кишки: появление модели» . Простагландины и другие липидные медиаторы . 104–105: 139–43. DOI : 10.1016 / j.prostaglandins.2012.08.004 . PMC 3532570 . PMID 22960430 .
- ^ Кун, Хартмут; Бантия, Свати; Ван Лейен, Клаус (2015). «Липоксигеназы млекопитающих и их биологическое значение» . Biochimica et Biophysica Acta (BBA) - молекулярная и клеточная биология липидов . 1851 (4): 308–30. DOI : 10.1016 / j.bbalip.2014.10.002 . PMC 4370320 . PMID 25316652 .
- ^ а б Шурейки, я; Wojno, K.J; Пур, Дж. А; Редди, Р. Дж .; Moussalli, M.J; Spindler, S.A; Гринсон, Дж. К; Normolle, D; Хасан, А. А; Лоуренс, Т. С; Бреннер, Д. Э (1999). «Снижение уровней 13-S-гидроксиоктадекадиеновой кислоты и экспрессии 15-липоксигеназы-1 при раке толстой кишки человека» . Канцерогенез . 20 (10): 1985–95. DOI : 10.1093 / carcin / 20.10.1985 . PMID 10506115 .
- ^ a b Никсон, Дженнифер Б; Ким, Кён Су; Лэмб, Патриция В; Боттон, Фрэнк Джи; Элинг, Томас Э (2004). «15-липоксигеназа-1 обладает противоопухолевым действием при колоректальном раке». Простагландины, лейкотриены и незаменимые жирные кислоты . 70 (1): 7–15. DOI : 10.1016 / j.plefa.2003.06.001 . PMID 14643174 .
- ^ Shureiqi, я; Цзян, Вт; Цзо, X; Wu, Y; Stimmel, J. B; Leesnitzer, L.M; Моррис, Дж. С; Fan, H.-Z; Фишер, С. М.; Липпман, С. М. (2003). «Продукт 15-липоксигеназы-1, 13-S-гидроксиоктадекадиеновая кислота, подавляет PPAR-δ, вызывая апоптоз в клетках колоректального рака» . Труды Национальной академии наук . 100 (17): 9968–73. Bibcode : 2003PNAS..100.9968S . DOI : 10.1073 / pnas.1631086100 . PMC 187904 . PMID 12909723 .
- ^ а б О'Флаэрти, Джозеф Т; Вутен, Ронда Э; Самуэль, Майкл П.; Томас, Майкл Дж; Левин, Эдвард А; Дело, Л. Дуглас; Акман, Стивен А; Эдвардс, Ирис Дж (2013). «Метаболиты жирных кислот в быстро пролиферирующем раке молочной железы» . PLOS ONE . 8 (5): e63076. Bibcode : 2013PLoSO ... 863076O . DOI : 10.1371 / journal.pone.0063076 . PMC 3642080 . PMID 23658799 .
- ^ Редди, Наги; Эверхарт, Анджела; Элинг, Томас; Глазго, Уэйн (1997). «Характеристика 15-липоксигеназы в клетках карциномы молочной железы человека ВТ-20: стимуляция образования 13-HODE с помощью TGFα / EGF». Сообщения о биохимических и биофизических исследованиях . 231 (1): 111–6. DOI : 10.1006 / bbrc.1997.6048 . PMID 9070230 .
- ^ Хилл, Стивен М; Бласк, Дэвид Э; Сян, Шулинь; Юань, Линь; Мао, Лулу; Dauchy, Роберт Т; Dauchy, Erin M; Фраш, Трипп; Duplesis, Тамика (2011). «Мелатонин и связанные с ним сигнальные пути, которые контролируют нормальный эпителий груди и рак груди». Журнал биологии и неоплазии молочных желез . 16 (3): 235–45. DOI : 10.1007 / s10911-011-9222-4 . PMID 21773809 . S2CID 22711432 .
- ^ Келавкар, U; Глазго, Вт; Элинг, Т. Э (2002). «Влияние экспрессии 15-липоксигеназы-1 на раковые клетки». Текущие отчеты урологии . 3 (3): 207–14. DOI : 10.1007 / s11934-002-0066-8 . PMID 12084190 . S2CID 21497252 .
- ^ Си, Линда С; Уилсон, Ли С; Элинг, Томас Э (2002). «Противоположные эффекты метаболитов 15-липоксигеназы-1 и -2 на передачу сигналов MAPK в простате» . Журнал биологической химии . 277 (43): 40549–56. DOI : 10.1074 / jbc.M203522200 . PMID 12189136 .
- ^ Kelavkar, У. Р; Коэн, С. (2004). «Экспрессия 15-липоксигеназы-1 активирует и активирует рецептор инсулиноподобного фактора роста-1 в клетках рака простаты» . Неоплазия . 6 (1): 41–52. DOI : 10.1016 / S1476-5586 (04) 80052-6 . PMC 1508629 . PMID 15068670 .
- ^ Келавкар, Уддхав П; Парвани, Анил V; Шаппелл, Скотт Б. Мартин, В. Дэвид (2006). «Условная экспрессия человеческой 15-липоксигеназы-1 в простате мыши вызывает интраэпителиальную неоплазию простаты: модель мыши FLiMP» . Неоплазия . 8 (6): 510–22. DOI : 10.1593 / neo.06202 . PMC 1601466 . PMID 16820097 .
- ^ Сен, Малабика; МакХью, Кевин; Хатзли, Джастин; Филипс, Брайан Дж; Дхир, Раджив; Парвани, Анил V; Келавкар, Уддхав П. (2006). «Ортотопическая экспрессия 15-липоксигеназы (LO) -1 человека в дорсолатеральной простате нормальной мыши C57BL / 6 дикого типа вызывает поражения, подобные PIN». Простагландины и другие липидные медиаторы . 81 (1–2): 1–13. DOI : 10.1016 / j.prostaglandins.2006.05.024 . PMID 16997127 .
- ^ а б Келавкар, U. P; Hutzley, J; МакХью, К. Allen, K.G; Парвани, А (2009). «Рост опухоли предстательной железы можно регулировать с помощью диетического воздействия на ферменты 15-липоксигеназа-1 и циклооксигеназа-2» . Неоплазия . 11 (7): 692–9. DOI : 10.1593 / neo.09334 . PMC 2697355 . PMID 19568414 .
- ^ Эдвардс, И. Дж; Berquin, I.M; Вс, ч; О'Флаэрти, Дж. Т.; Daniel, L.W; Томас, М. Дж; Рудель, Л. Л; Wykle, R.L; Чен, Y. Q (2004). «Дифференциальные эффекты доставки омега-3 жирных кислот в раковые клетки человека липопротеинами низкой плотности по сравнению с альбумином» . Клинические исследования рака . 10 (24): 8275–83. DOI : 10.1158 / 1078-0432.CCR-04-1357 . PMID 15623603 .
- ^ о'Флаэрти, Джозеф Т; Ху Юньпин; Вутен, Ронда Э; Хорита, Дэвид А; Самуэль, Майкл П.; Томас, Майкл Дж; Сунь, Хайго; Эдвардс, Ирис Дж (2012). "15-липоксигеназные метаболиты докозагексаеновой кислоты ингибируют пролиферацию и выживаемость раковых клеток простаты" . PLOS ONE . 7 (9): e45480. Bibcode : 2012PLoSO ... 745480O . DOI : 10.1371 / journal.pone.0045480 . PMC 3447860 . PMID 23029040 .
- ^ Ху, Юньпин; Сунь, Хайго; о'Флаэрти, Джозеф Т; Эдвардс, Ирис Дж (2013). «Опосредованный 15-липоксигеназой-1 метаболизм докозагексаеновой кислоты необходим для передачи сигналов синдекана-1 и апоптоза в клетках рака простаты» . Канцерогенез . 34 (1): 176–82. DOI : 10.1093 / carcin / bgs324 . PMC 3584949 . PMID 23066085 .
- ^ Jira, Вольфганг; Шпителлер, Герхард; Рихтер, Андреас (1997). «Повышенный уровень продуктов окисления липидов в липопротеинах низкой плотности у пациентов, страдающих ревматоидным артритом». Химия и физика липидов . 87 (1): 81–9. DOI : 10.1016 / S0009-3084 (97) 00030-3 . PMID 9219348 .
- ^ Ле, Куанг Хай; Эль-Алауи, Медди; Верисель, Эвелин; Сегрестен, Беренис; Сулер, Лоран; Гишардан, Мишель; Лагард, Мишель; Мулен, Филипп; Кальсада, Екатерина (2015). «Гликоксидированные ЛПВП, ЛПВП, обогащенные окисленными фосфолипидами и ЛПВП от пациентов с диабетом, подавляют функцию тромбоцитов» . Журнал клинической эндокринологии и метаболизма . 100 (5): 2006–14. DOI : 10.1210 / jc.2014-4214 . PMC 4803888 . PMID 25794249 .
- ^ Клавиттер, Елена; Клавиттер, Йост; МакФанн, Ким; Пеннингтон, Александр Т; Abebe, Kaleab Z; Броснахан, Годела; Cadnapaphornchai, Melissa A; Шончоль, Мишель; Гитомер, Беренис; Христиане, Уве; Шриер, Роберт В. (2014). «Биоактивные липидные медиаторы при поликистозе почек» . Журнал липидных исследований . 55 (6): 1139–49. DOI : 10.1194 / jlr.P042176 . PMC 4031945 . PMID 24343898 .
- ^ Стивенс, Тайлер; Берк, Майкл П.; Лопес, Росио; Чунг, Юн-Ми; Чжан, Жэньлян; Парси, Мансур А; Броннер, Мэри П.; Фельдштейн, Ариэль Э (2012). «Липидомный профиль сыворотки и панкреатической жидкости при хроническом панкреатите». Поджелудочная железа . 41 (4): 518–22. DOI : 10.1097 / MPA.0b013e31823ca306 . PMID 22504378 . S2CID 42972163 .
- ^ Ян, Лили; Latchoumycandane, Каливаратан; Макмаллен, Меган Р.; Пратт, Брайан Т; Чжан, Жэньлян; Папучадо, Беттина Г.; Надь, Лаура Э; Фельдштейн, Ариэль Э; Макинтайр, Томас М (2010). «Хроническое воздействие алкоголя увеличивает циркулирующие биоактивные окисленные фосфолипиды» . Журнал биологической химии . 285 (29): 22211–20. DOI : 10.1074 / jbc.M110.119982 . PMC 2903350 . PMID 20460374 .
- ^ Фельдштейн, Ариэль Э; Лопес, Росио; Тамими, Тарек Абу-Раджаб; Ериан, Лиза; Чунг, Юн-Ми; Берк, Майкл; Чжан, Жэньлян; Макинтайр, Томас М; Хазен, Стэнли L (2010). «Масс-спектрометрическое профилирование окисленных липидных продуктов при неалкогольной жировой болезни печени и неалкогольном стеатогепатите у человека» . Журнал липидных исследований . 51 (10): 3046–54. DOI : 10.1194 / jlr.M007096 . PMC 2936759 . PMID 20631297 .
- ↑ Йошида, Ясукадзу; Ёсикава, Ацуши; Кинуми, Томоя; Огава, Йоко; Сайто, Йоширо; Охара, Казуюки; Ямамото, Хирокадзу; Имаи, Ясухару; Ники, Эцуо (2009). «Гидроксиоктадекадиеновая кислота и окислительно модифицированные пероксиредоксины в крови пациентов с болезнью Альцгеймера и их потенциал в качестве биомаркеров». Нейробиология старения . 30 (2): 174–85. DOI : 10.1016 / j.neurobiolaging.2007.06.012 . PMID 17688973 . S2CID 23418993 .
- ↑ Йошида, Ясукадзу; Умено, Ая; Шичири, Мототада (2013). «Биомаркеры перекисного окисления липидов для оценки окислительного стресса и оценки антиоксидантной способности in vivo » . Журнал клинической биохимии и питания . 52 (1): 9–16. DOI : 10.3164 / jcbn.12-112 . PMC 3541426 . PMID 23341691 .
- ↑ Ники, Эцуо (2014). «Биомаркеры перекисного окисления липидов в клиническом материале». Biochimica et Biophysica Acta (BBA) - Общие вопросы . 1840 (2): 809–17. DOI : 10.1016 / j.bbagen.2013.03.020 . PMID 23541987 .
- ^ Лю, Ян; Ван, Дуань; Ли, Ди; Солнце, Руифан; Ся, Мин (2014). «Связь ретинол-связывающего белка 4 с окислительным стрессом, воспалительными маркерами и метаболическим синдромом у людей среднего и пожилого возраста в Китае» . Диабетология и метаболический синдром . 6 (1): 25. DOI : 10,1186 / 1758-5996-6-25 . PMC 3938900 . PMID 24559154 .