Эта статья поднимает множество проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалить эти сообщения-шаблоны ) ( Узнайте, как и когда удалить этот шаблон сообщения )
|
Аномер представляет собой тип геометрической вариации найден в некоторых атомах в углеводных молекулах. Эпимер является стереоизомером , которая отличается в конфигурации при любом одном стереогенного центре . Аномер - это эпимер на полуацетальном / полукетальном углероде в циклическом сахариде , атоме, называемом аномерным углеродом . [1] Аномерный углерод - это углерод, полученный из карбонильного углеродного соединения ( кетоновая или альдегидная функциональная группа) в форме открытой цепи углеводной молекулы. Аномеризацияэто процесс превращения одного аномера в другой. Как это типично для стереоизомерных соединений, разные аномеры имеют разные физические свойства, точки плавления и определенные вращения .
Слово «аномер» происходит от греческого слова ἄνω, означающего «вверх, выше», и греческого слова μέρος («часть»), как в «изомер».
Номенклатура [ править ]
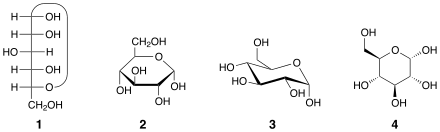
Два аномера обозначаются альфа (α) или бета (β) в соответствии с конфигурационным соотношением между аномерным центром и аномерным эталонным атомом , следовательно, они являются относительными стереодескрипторами .[2] Аномерный центр полуацеталей - аномерный углерод C-1. В гемикеталах это углерод, полученный из карбонила кетона (например, C-2 в D- фруктозе). В альдогексозах аномерный эталонный атом представляет собой стереоцентр, наиболее удаленный от аномерного углерода в кольце (конфигурационный атом, определяющий сахар как D или L ). Например, в α- D-глюкопираноза эталонным атомом является C-5.
Если в циклической проекции Фишера [3] экзоциклический атом кислорода в аномерном центре является цис (с той же стороны) по отношению к экзоциклическому кислороду, присоединенному к аномерному эталонному атому (в группе ОН), то аномером является α. Если два атома кислорода являются транс (с разных сторон), аномером является β. [4] Таким образом, абсолютные конфигурации аномерного углерода и эталонного атома одинаковы (оба R или оба S ) в α-аномере и противоположны (один R и другой S ) в β-аномере. [5]
Аномеризация [ править ]
Аномеризация - это процесс превращения одного аномера в другой. В случае восстанавливающих сахаров аномеризация называется мутаротацией, она легко происходит в растворе и катализируется кислотой и основанием. Этот обратимый процесс обычно приводит к смеси аномеров, в которой в конечном итоге достигается равновесие между двумя отдельными аномерами.
Отношение двух аномеров специфично для относительно сахара. Например, независимо от конфигурации исходной D- глюкозы раствор будет постепенно превращаться в смесь примерно 64% β- D- глюкопиранозида и 36% α- D- глюкопиранозы. При изменении соотношения оптическое вращение смеси изменяется; это явление называется мутаротацией .
Механизм аномеризации [ править ]
Хотя циклические формы сахаров обычно в значительной степени предпочтительны, полуацетали в водном растворе находятся в равновесии со своими формами с открытой цепью . В альдогексозах это равновесие устанавливается, когда полуацетальная связь между C-1 (углерод, связанный с двумя атомами кислорода) и кислородом C-5 расщепляется (образуя соединение с открытой цепью) и реформируется (образуя циклическое соединение). Когда полуацетальная группа реформируется, группа ОН на С-5 может атаковать любую из двух стереохимически различных сторон альдегидной группы на С-1. На какой стороне он атакует, определяет, образуется ли α- или β-аномер.
Аномеризация гликозидов обычно происходит в кислых условиях. Обычно аномеризация происходит посредством протонирования экзоциклического ацетального кислорода, ионизации с образованием иона оксокарбения с высвобождением спирта и нуклеофильной атаки спиртом на обратной стороне иона оксокарбения с последующим депротонированием.
Физические свойства и стабильность [ править ]
Аномеры различаются по структуре и, таким образом, имеют разные стабилизирующие и дестабилизирующие эффекты друг от друга. Основными факторами стабильности определенного аномера являются:
- Аномерная эффект , который стабилизирует аномер , который имеет электронный вывод группы ( как правило , атом кислород или атом азота) в осевой ориентации на кольце. Этот эффект устраняется в полярных растворителях, таких как вода.
- 1,3-диаксиальные взаимодействия , которые обычно дестабилизируют аномер, имеющий аномерную группу в аксиальной ориентации на кольце. Этот эффект особенно заметен в пиранозах и других шестичленных кольцевых соединениях. Это главный фактор в воде.
- Водородные связи между аномерной группой и другими группами кольца, что приводит к стабилизации аномера.
- Диполярное отталкивание между аномерной группой и другими группами кольца, приводящее к дестабилизации аномера.
Для D- глюкопиранозида β-аномер является более стабильным аномером в воде. Для D- маннопиранозы α-аномер является более стабильным аномером.
Поскольку аномеры являются диастереомерами друг друга, они часто различаются по физическим и химическим свойствам. Одним из наиболее важных физических свойств, используемых для изучения аномеров, является удельное вращение , которое можно контролировать с помощью поляриметрии .
См. Также [ править ]
- Номенклатура моносахаридов
- Стереохимия
Ссылки [ править ]
- ^ Фрэнсис Кэри (2000). Органическая химия, издательство McGraw-Hill Higher Education Press (4-е изд.).
- ^ IUPAC , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « α (альфа), β (бета) ». DOI : 10,1351 / goldbook.A00003
- ^ "Химия - Лондонский университет королевы Марии" .
- ^ Номенклатура углеводов (рекомендации 1996 г.) Архивировано 27 октября 2010 г. в Wayback Machine PDF
- ^ "Структурная основа разнообразия гликанов" . Основы гликобиологии . Лабораторный пресс Колд-Спринг-Харбор. 2009. ISBN. 9780879697709.
Внешние ссылки [ править ]
- {{Commonscatinline}