| Сердечно-легочное шунтирование | |
|---|---|
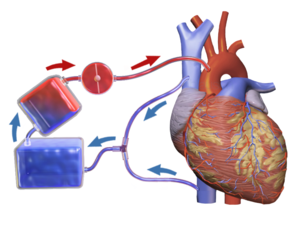
 Аппарат искусственного кровообращения (вверху справа) при операции шунтирования коронарной артерии . | |
| МКБ-9-СМ | 39,61 |
| MeSH | D002318 |
| Код ОПС-301 | 14 |
| Прочие коды | 22570829 |
Сердечно-легочный обход ( CPB ) - это метод, при котором аппарат временно берет на себя функцию сердца и легких во время операции , поддерживая кровообращение и содержание кислорода в организме пациента. Сам насос CPB часто называют аппаратом искусственного кровообращения или «насосом». Насосы искусственного кровообращения обслуживаются перфузиологами . КПБ - это форма экстракорпорального кровообращения. Экстракорпоральная мембранная оксигенация обычно используется для длительного лечения.
CPB механически циркулирует и насыщает кислородом кровь для тела, минуя сердце и легкие. Он использует аппарат искусственного кровообращения для поддержания перфузии к другим органам и тканям тела, пока хирург работает в бескровном операционном поле. Хирург помещает канюлю в правое предсердие, полую вену или бедренную вену для вывода крови из организма. Венозная кровь удаляется из организма с помощью канюли, а затем фильтруется, охлаждается или нагревается и насыщается кислородом, прежде чем она будет возвращена в организм с помощью механического насоса. Канюля, используемая для возврата насыщенной кислородом крови, обычно вводится в восходящую аорту, но может быть вставлена в бедренную артерию, подмышечную артерию или брахиоцефальную артерию (среди прочего). [1] [2]
Пациенту вводят гепарин для предотвращения свертывания крови, а затем назначают сульфат протамина, чтобы обратить действие гепарина. Во время процедуры может сохраняться переохлаждение; температура тела обычно поддерживается на уровне от 28 ° C до 32 ° C (82,4–89,6 ° F). Кровь охлаждается во время CPB и возвращается в тело. Охлажденная кровь замедляет основной обмен веществ в организме, уменьшая потребность в кислороде. Охлажденная кровь обычно имеет более высокую вязкость, но раствор кристаллоидов, используемый для заполнения обходной трубки, разбавляет кровь.
Использует [ редактировать ]
Искусственное кровообращение обычно используется при операциях на сердце. Этот метод позволяет хирургической бригаде насыщать кислородом и обеспечивать циркуляцию крови пациента, что позволяет хирургу оперировать сердце. [1] Во многих операциях, таких как шунтирование коронарной артерии (АКШ), сердце останавливается (то есть останавливается) из-за сложности операции на бьющемся сердце. Операции, требующие открытия камер сердца, например, восстановление или замена митрального клапана., требует использования CPB, чтобы избежать системного захвата воздуха и обеспечить бескровное поле для увеличения видимости для хирурга. Аппарат перекачивает кровь и с помощью оксигенатора позволяет эритроцитам собирать кислород, а также снижает уровень углекислого газа. [3] Это имитирует функцию сердца и легких соответственно.
CPB можно использовать для индукции гипотермии всего тела , состояния, в котором тело может находиться до 45 минут без перфузии (кровотока). [1] Если кровоток прекращается при нормальной температуре тела , необратимое повреждение мозга обычно происходит через три-четыре минуты - вскоре после этого может наступить смерть. Точно так же CPB можно использовать для повторного согревания людей, страдающих от переохлаждения . [4] Этот метод повторного согревания с использованием CPB эффективен, если внутренняя температура пациента превышает 16 ° C. [5]
Экстракорпоральная мембранная оксигенация ( ЭКМО ) - это упрощенная версия аппарата искусственного кровообращения, который включает в себя центробежный насос и оксигенатор для временного выполнения функции сердца и / или легких. ЭКМО полезна у пациентов с сердечной или легочной дисфункцией после операции на сердце, у пациентов с острой легочной недостаточностью, массивной тромбоэмболией легочной артерии , травмой легких в результате инфекций и рядом других проблем, которые нарушают сердечную или легочную функцию. ЭКМО дает сердцу и / или легким время на восстановление или восстановление, но это только временное решение. Пациенты с терминальными состояниями, раком, тяжелым поражением нервной системы, неконтролируемым сепсисом и другими состояниями не могут быть кандидатами на ЭКМО.[6]
Хирургические процедуры, при которых используется искусственное кровообращение [ править ]
- Аортокоронарное шунтирование
- Ремонт и / или замена сердечного клапана ( аортальный клапан , митральный клапан , трикуспидальный клапан , легочный клапан )
- Ремонт больших перегородочных дефектов ( дефект межпредсердной перегородки , дефект межжелудочковой перегородки , атриовентрикулярная дефект межпредсердной перегородки )
- Ремонт и / или паллиативное лечение врожденных пороков сердца ( Тетралогия Фалло , транспозиция магистральных сосудов )
- Пересадка ( трансплантация сердца , трансплантация легких , трансплантация сердца и легкого , трансплантация печени )
- Ремонт некоторых крупных аневризм ( аневризмы аорты , аневризмы головного мозга )
- Легочная тромбоэндартерэктомия
- Легочная тромбэктомия
- Изолированная перфузия конечностей [7]
Противопоказания и особые соображения [ править ]
Абсолютных противопоказаний к искусственному кровообращению нет. [8] Однако есть несколько факторов, которые необходимо учитывать при планировании операции.
Гепарин-индуцированная тромбоцитопения (HIT) и гепарин-индуцированная тромбоцитопения и тромбоз (HITT) являются потенциально опасными для жизни состояниями, связанными с введением гепарина. При HIT или HITT образуются антитела против гепарина, которые вызывают активацию тромбоцитов и образование тромбов . Поскольку при ХПБ обычно используется гепарин, пациентам, у которых известно, что у них есть антитела, ответственные за HIT и HITT, требуются альтернативные формы антикоагуляции. Бивалирудин является наиболее изученной альтернативой гепарину у пациентов с HIT или HITT, которым требуется CPB. [9]
Небольшой процент пациентов, например, с дефицитом антитромбина III , может проявлять резистентность к гепарину. У этих пациентов пациенты могут нуждаться в дополнительном приеме гепарина, свежезамороженной плазмы или других продуктов крови, таких как рекомбинантный антитромбин III, для достижения адекватной антикоагуляции. [10]
Стойкая левая верхняя полая вена (PLSVC) является грудной вариации системы , в которой левосторонний полом не в эвольвенты во время нормального развития. Это наиболее частая вариация грудной венозной системы, встречающаяся примерно у 0,3% населения. [11] Аномалия часто обнаруживается при предоперационных исследованиях изображений, но также может быть обнаружена во время операции. PLSVC может затруднить достижение надлежащего венозного оттока или ретроградную кардиопледгию. Ведение PLSVC во время CPB зависит от таких факторов, как размер и дренажный участок PSLVC. [1]
Риски и осложнения [ править ]
| Осложнение | Заболеваемость (событий / 1000) | Смерть или серьезная травма (%) |
|---|---|---|
| Протаминовая реакция [1] | 1.3 | 10,5 |
| Тромбоз [1] | 0,3–0,4 | 2,6–5,2 |
| Расслоение аорты [1] | 0,4–0,8 | 14,3–33,1 |
| Газовая эмболия | 0,2–1,3 | 0,2–8,7 |
| Массивная системная газовая эмболия [1] | 0,03–0,07 | 50–52 |
| Смещение канюли (вызывает массивное кровотечение) [1] | 0,2–1,6 | 4,2–7,1 |
| Синдром острого респираторного дистресс-синдрома [1] | - | - |
| Арритмии [1] | - | - |
| Синдром капиллярной утечки [2] | - | - |
| Гемолиз [2] | - | - |
| Постперфузионный синдром (« насосная головка ») [2] | - | - |
CPB не является доброкачественным и имеет ряд связанных проблем. Как следствие, CPB используется только в течение нескольких часов, на которые может потребоваться операция на сердце. Известно, что CPB активирует каскад коагуляции и стимулирует медиаторы воспаления, что приводит к гемолизу и коагулопатиям. Эта проблема усугубляется по мере того, как белки комплемента накапливаются на мембранных оксигенаторах. [12] По этой причине большинство оксигенаторов имеют рекомендацию производителя использовать их не более шести часов, хотя иногда они используются до десяти часов, при этом необходимо следить за тем, чтобы они не свертывались и не останавливались. работающий. На более длительные периоды времени ЭКМО(экстракорпоральная мембранная оксигенация), которая может действовать до 31 дня - например, в случае с Тайванем, в течение 16 дней, после чего пациенту была сделана трансплантация сердца. [13]
Наиболее частым осложнением, связанным с CPB, является реакция протамина во время отмены антикоагуляции. [1] Существует три типа протаминовых реакций, каждый из которых может вызывать опасную для жизни гипотензию (тип I), анафилаксию (тип II) или легочную гипертензию (тип III). [14] [12] Пациенты, ранее подвергавшиеся воздействию протамина, например, те, кто ранее перенес вазэктомию (протамин содержится в сперме) или диабетики (протамин содержится в препаратах инсулина нейтрального протамина хагедорна (НПХ)), имеют повышенную риск протаминовых реакций II типа из-за перекрестной чувствительности.[12] Поскольку протамин является быстродействующим лекарством, его обычно вводят медленно, чтобы можно было отслеживать возможные реакции. [2] Первым шагом в лечении протаминовой реакции является немедленное прекращение инфузии протамина. Кортикостероиды используются при всех типах протаминовых реакций. Хлорфенамин используется для реакций типа II (анафилактических). При реакциях типа III назначают повторную дозу гепарина, и пациенту может потребоваться повторное шунтирование. [12]
CPB может способствовать немедленному снижению когнитивных функций. Система кровообращения сердце-легкие и сама операция соединения выпускают в кровоток различные инородные тела, включая частицы кровяных телец, трубки и бляшки. Например, когда хирурги зажимают аорту и соединяют ее с трубкой, образующиеся эмболы могут блокировать кровоток и вызывать мини-инсульты. Другими факторами хирургии сердца, связанными с психическим повреждением, могут быть явления гипоксии, высокой или низкой температуры тела, аномального артериального давления, нерегулярного сердечного ритма и лихорадки после операции. [15]
Компоненты [ править ]
Сердечно-легочный обходной анастомоз состоит из двух основных функциональных блоков, насоса и оксигенатора, который удаляет относительно обедненную кислородом кровь из тела пациента и заменяет ее богатой кислородом кровью через ряд трубок (шлангов). Теплообменник используется для контроля температуры тела путем нагревания или охлаждения крови в контуре. Важно, чтобы все компоненты контура были покрыты изнутри гепарином или другим антикоагулянтом, чтобы предотвратить свертывание внутри контура. [1]
НКТ [ править ]
Компоненты схемы CPB соединены между собой серией трубок из силиконовой резины или ПВХ . [16]
Насосы [ править ]
Центробежный насос [ править ]
Многие контуры CPB теперь используют центробежный насос для поддержания и контроля кровотока во время CPB. Изменяя скорость вращения (об / мин) головки насоса, поток крови создается за счет центробежной силы . Многие считают, что этот тип перекачивания превосходит действие роликового насоса, поскольку считается, что он предотвращает избыточное давление, зажатие или перекручивание линий и вызывает меньшее повреждение продуктов крови ( гемолиз и т. Д.). [17]
Роликовый насос [ править ]
Консоль насоса обычно состоит из нескольких вращающихся насосов с приводом от электродвигателя, которые перистальтически «массируют» трубки. Это действие мягко продвигает кровь по трубке. Его обычно называют роликовым насосом или перистальтическим насосом . Эти насосы более доступны по цене, чем их центробежные аналоги, но они подвержены избыточному давлению, если трубопроводы зажаты или перекручены. [17] Они также с большей вероятностью вызывают массивную воздушную эмболию и требуют постоянного и тщательного наблюдения со стороны перфузиолога. [1]
Оксигенатор [ править ]
Оксигенатор предназначен для добавления кислорода к заваренной крови и удалить некоторые из углекислого газа из венозной крови . Кардиохирургия стала возможной благодаря CPB с использованием пузырьковых оксигенаторов , но мембранные оксигенаторы вытеснили пузырьковые оксигенаторы с 1980-х годов. Основные причины этого заключаются в том, что мембранные оксигенаторы, как правило, генерируют намного меньше микропузырьков, называемых газообразными микроэмболами, которые обычно считаются вредными для пациента [18] и уменьшают повреждение клеток крови [19] по сравнению с пузырьковыми оксигенаторами.. В последнее время более широкое распространение получило использование оксигенаторов из полых волокон. Эти производные мембранных оксигенаторов дополнительно уменьшают возникновение микроэмбол, уменьшая прямую границу раздела воздух-кровь, одновременно обеспечивая адекватный газообмен. [17]
Другой тип оксигенатора, получивший в последнее время популярность, - это оксигенатор крови, покрытый гепарином, который, как полагают, вызывает меньшее системное воспаление и снижает склонность крови к сгустку в контуре CPB. [ необходима цитата ]
Теплообменники [ править ]
Поскольку гипотермия часто используется в CPB для снижения метаболических требований (в том числе сердечных), используются теплообменники для нагрева и охлаждения крови в контуре. Нагрев и охлаждение осуществляются путем пропускания трубопровода через баню с теплой или ледяной водой. Для линии кардиоплегии требуется отдельный теплообменник. [1]
Канюли [ править ]
Множественные канюли вшиваются в тело пациента в различных местах, в зависимости от типа операции. Венозная канюля удаляет обедненную кислородом венозную кровь из тела пациента. Артериальная канюля вводит богатую кислородом кровь в артериальную систему. Основные факторы, определяющие выбор размера канюли, определяются размером и массой пациента, ожидаемой скоростью потока и размером сосуда, в который вводится канюля. [1] кардиоплегия канюля обеспечивает кардиоплегию решение , чтобы заставить сердце перестанет биться.
Некоторые часто используемые места для канюляции:
| Венозный | Артериальный | Кардиоплегия |
|---|---|---|
| Правое предсердие | Проксимальный отдел аорты , дистальнее поперечного зажима | Проксимальный отдел аорты , проксимальнее поперечного зажима |
| Полая вена | Бедренная артерия | Коронарный синус (ретроградное родоразрешение) |
| Бедренная вена | Подмышечная артерия | Коронарная устья |
| Дистальный отдел аорты | Шунтирующие трансплантаты (при АКШ ) | |
| Вершина сердца |
Кардиоплегия [ править ]
Кардиопледгия - это жидкий раствор, используемый для защиты сердца во время CPB. Его вводят через канюлю в отверстие коронарных артерий (обычно через корень аорты) и / или в сердечные вены (через коронарный синус). [17] Эти методы доставки называются антеградными и ретроградными соответственно. Раствор для кардиопледгии защищает сердце, останавливая (то есть останавливая) сердце, тем самым снижая его метаболические потребности. Существует несколько типов решений при кардиоплегии, но большинство из них работают, подавляя быстрые натриевые токи в сердце, тем самым предотвращая проведение потенциала действия . Другие типы растворов действуют, подавляя действие кальция на миоциты . [3]
Техника [ править ]
Предоперационное планирование [ править ]
CPB требует серьезной предусмотрительности перед операцией. В частности, катетеризация, охлаждение и кардио-защитные стратегии должны быть согласованы между хирургом , анестезиологом , перфузиологом и средним медицинским персоналом . [17]
Стратегия канюляции [ править ]
Стратегия канюляции зависит от нескольких особенностей операции и пациента. Типичная артериальная канюляция включает размещение одной канюляции в дистальном отделе восходящей аорты . Самая простая форма включает размещение одной канюли (известной как двухступенчатая канюля), проходящей через правое предсердие в нижнюю полую вену . При некоторых операциях, таких как операции на трехстворчатом или митральном клапане , используются две канюли: одна проходит через нижнюю полую вену, а другая - через верхнюю полую вену . Это называется одноступенчатой канюляцией. [3]
Интраоперационная техника [ править ]
Контур CPB должен быть заполнен жидкостью, и весь воздух должен быть удален из артериальной линии / канюли перед подключением к пациенту. Контур заполняется раствором кристаллоидов, а иногда также добавляются продукты крови. Перед канюляцией (обычно после вскрытия перикарда при использовании центральной канюляции) вводят гепарин или другой антикоагулянт до тех пор, пока время активированного свертывания крови не превысит 480 секунд. [2]
Место артериальной канюляции проверяют на наличие кальциноза или других заболеваний. Предоперационная визуализация или ультразвуковой зонд могут использоваться для выявления кальцификатов аорты, которые потенциально могут смещаться и вызывать окклюзию или инсульт . После того, как место канюляции признано безопасным, в дистальный отдел восходящей аорты накладывают два концентрических ромбовидных кисетных шва. В сумочке делается колющий разрез скальпелем, и через разрез проводится артериальная канюля. Важно, чтобы канюля проходила перпендикулярно аорте, чтобы избежать расслоения аорты . [2]Нить кисетного шва стягивается вокруг канюли с помощью жгута и прикрепляется к канюле. [17] В этот момент перфузиолог продвигает артериальную линию контура CPB, а хирург соединяет артериальную линию, идущую от пациента, с артериальной линией, идущей от аппарата CPB. Необходимо следить за тем, чтобы воздух не попадал в контур, когда они соединены, иначе пациент может пострадать от воздушной эмболии . [3] [2] Другие места для артериальной канюляции включают подмышечную артерию , брахиоцефальную артерию или бедренную артерию .
За исключением различий в расположении, венозная канюляция выполняется аналогично артериальной канюляции. Поскольку кальциноз венозной системы встречается реже, осмотр или использование ультразвука для определения кальцификации в местах канюляции не требуется. Кроме того, поскольку венозная система находится под гораздо меньшим давлением, чем артериальная система, требуется только один шов, чтобы удерживать канюлю на месте. [2] Если используется только одна канюля (двухэтапная канюляция), ее проводят через отросток правого предсердия , через трехстворчатый клапан и в нижнюю полую вену. [3]Если требуются две канюли (одноступенчатая канюляция), первую обычно проводят через верхнюю полую вену, а вторую - через нижнюю полую вену. [3] бедренная вена может быть также канюлируют в некоторых пациентах.
Если для операции необходимо остановить сердце , также необходимы канюли для кардиоплегии . В зависимости от операции и предпочтений хирурга могут использоваться антеградная кардиопледгия (протекающая вперед через артерии сердца), ретроградная кардиоплегия (протекающая назад через вены сердца) или оба типа. При антеградной кардиоплегии делается небольшой разрез в аорте проксимальнее места артериальной канюляции (между сердцем и местом артериальной канюляции), и через него вводится канюля для доставки кардиопледгии в коронарные артерии . При ретроградной кардиоплегии делается разрез на задней (задней) поверхности сердца через правый желудочек.. Канюля помещается в этот разрез, проходит через трехстворчатый клапан и в коронарный синус . [17] [3] Линии кардиоплегии подключены к аппарату CPB.
На этом этапе пациент готов к обходному анастомозу. Кровь из венозных канюль под действием силы тяжести поступает в аппарат CPB, где она насыщается кислородом и охлаждается (при необходимости) перед возвращением в организм через артериальную канюлю. Теперь можно вводить кардиопледгию, чтобы остановить сердце, и поперечный зажим помещается через аорту между артериальной канюлей и канюлей кардиопледгии, чтобы предотвратить обратный ток артериальной крови в сердце.
Как только пациент готов отойти от поддержки обходного анастомоза, перекрестный зажим и канюли удаляются и вводится сульфат протамина, чтобы обратить антикоагулянтный эффект гепарина.
История [ править ]
Немецко-австрийский физиолог Максимилиан фон Фрей сконструировал ранний прототип аппарата искусственного кровообращения в 1885 году в Физиологическом институте Карла Людвига при Лейпцигском университете . [20] Однако такие машины были невозможны до открытия в 1916 году гепарина , который предотвращает свертывание крови . Советский ученый Сергей Брюхоненко в 1926 году разработал аппарат искусственного кровообращения для общей перфузии тела, который использовался в экспериментах с собаками. Группа ученых из Бирмингемского университета (включая инженера-химика Эрика Чарльза) была среди пионеров этой технологии. [21] [22]
Доктор Кларенс Деннис возглавил команду в Медицинском центре Университета Миннесоты, которая 5 апреля 1951 года провела первую операцию на людях, включающую открытую кардиотомию с временным механическим переключением функций сердца и легких. Пациент не выжил из-за неожиданного сложного врожденного порока сердца. Один из членов команды был доктор Рассел М. Нельсон , который впоследствии стал президентом в Церкви Иисуса Христа Святых последних дней , и кто выполнил первую операцию на открытом сердце в штате Юта . [23]
Первая успешная механическая поддержка функции левого желудочка была выполнена 3 июля 1952 года Форестом Дьюи Додриллом с использованием машины Dodrill-GMR, разработанной совместно с General Motors . Позже аппарат использовался для поддержки функции правого желудочка. [24]
Первая успешная операция на открытом сердце у человека с использованием аппарата искусственного кровообращения была проведена Джоном Гиббоном и Фрэнком Ф. Оллбриттеном-младшим [25] 6 мая 1953 года в университетской больнице Томаса Джефферсона в Филадельфии . Они устранили дефект межпредсердной перегородки у 18-летней женщины. [26] Аппарат Гиббона был усовершенствован в надежный инструмент хирургической бригадой под руководством Джона В. Кирклина в клинике Мэйо в Рочестере, штат Миннесота, в середине 1950-х годов. [27]
Оксигенатор был впервые разработан в 17 веке Робертом Гуком, а в 19 веке он был разработан французскими и немецкими физиологами-экспериментаторами в практические экстракорпоральные оксигенаторы. Пузырьковые оксигенаторы не имеют промежуточного барьера между кровью и кислородом, их называют оксигенаторами «прямого контакта». Мембранные оксигенаторы создают газопроницаемую мембрану между кровью и кислородом, которая снижает кровяную травму при прямом контакте оксигенаторов. С 1960-х годов большая часть работы была сосредоточена на преодолении препятствий для газообмена мембранного барьера, что привело к разработке высокопроизводительных микропористых оксигенаторов из полого волокна, которые в конечном итоге заменили оксигенаторы прямого контакта в кардиологических залах. [28]
В 1983 году Кен Литзи запатентовал замкнутую систему аварийного обхода сердца, которая уменьшила сложность схем и компонентов. [29] Это устройство улучшило выживаемость пациентов после остановки сердца, поскольку его можно было быстро использовать в нехирургических условиях. [30]
Ссылки [ править ]
- ^ a b c d e f g h i j k l m n o p Кардиохирургия у взрослых . Кон, Лоуренс Х., 1937-2016 (Пятое изд.). Нью-Йорк. 2017-08-28. ISBN 978-0-07-184487-1. OCLC 930496902 .CS1 maint: другие ( ссылка )
- ^ a b c d e f g h i Кардиохирургия Кирклина / Барратта-Бойса: морфология, диагностические критерии, естественное течение, методы, результаты и показания . Кушукос, Николас Т., Кирклин, Джон У. (Джон Вебстер). (4-е изд.). Филадельфия: Эльзевьер / Сондерс. 2013. ISBN. 978-1-4557-4605-7. OCLC 812289395 .CS1 maint: другие ( ссылка )
- ^ a b c d e f g Юссеф, Самуэль Дж .; Уильямс, Джейсон А. (2013). TSRA Primer кардиоторакальной хирургии . Чикаго, Иллинойс: TSRA / TSDA. ISBN 978-0-9894023-0-9.
- ^ Маккалоу, L .; Арора, С. (декабрь 2004 г.). «Диагностика и лечение переохлаждения». Я семейный врач . 70 (12): 2325–32. PMID 15617296 .
- ^ Лич, Брайан; Браун, Марк (2004). Руководство по клинической перфузии (2-е изд.). Форт Майерс, Флорида: PERFUSION.COM, INC. Стр. 117. ISBN 978-0-9753396-0-2.
- ^ Лич, Брайан (2004). Руководство по клинической пефузии (2-е изд.). Форт Майерс, Флорида: perfusion.com. п. 141. ISBN. 978-0-9753396-0-2.
- ^ Лич, Брайан (2004). Руководство по перфузии клинкала (2-е изд.). Форт-Майерс, Флорида: Perfusion.com. п. 117. ISBN 978-0-9753396-0-2.
- ^ Исмаил, Абдельхади; Мишкольци, Сабольч Ю. (2019), «Сердечно- легочное шунтирование» , StatPearls , StatPearls Publishing, PMID 29489210 , получено 21 января 2020 г.
- ^ Шор-Лессерсон, Линда; Бейкер, Роберт А .; Феррарис, Виктор А .; Greilich, Philip E .; Фитцджеральд, Дэвид; Роман, Филипп; Хэммон, Джон В. (февраль 2018 г.). «Общество торакальных хирургов, Общество сердечно-сосудистых анестезиологов и Американское общество экстракорпоральных технологий: Рекомендации по клинической практике - антикоагуляция во время искусственного кровообращения» . Анналы торакальной хирургии . 105 (2): 650–662. DOI : 10.1016 / j.athoracsur.2017.09.061 . ISSN 1552-6259 . PMID 29362176 .
- ^ Финли, Алан; Гринберг, Чарльз (июнь 2013 г.). «Чувствительность и резистентность к гепарину: управление во время искусственного кровообращения» . Анестезия и анальгезия . 116 (6): 1210–1222. DOI : 10.1213 / ANE.0b013e31827e4e62 . ISSN 0003-2999 . PMID 23408671 . S2CID 22500786 .
- ^ Берг, С .; Knüppel, M .; Гейпель, А .; Коль, Т .; Krapp, M .; Knöpfle, G .; Germer, U .; Hansmann, M .; Гембрух, У. (март 2006 г.). «Пренатальная диагностика стойкой левой верхней полой вены и связанных с ней врожденных аномалий». Ультразвук в акушерстве и гинекологии . 27 (3): 274–280. DOI : 10.1002 / uog.2704 . ISSN 0960-7692 . PMID 16456841 . S2CID 26364072 .
- ^ а б в г Лапар, Дэмиен Дж. (2016). Цра обзор кардиоторакальной хирургии . [Место публикации не указано]: Createspace. ISBN 978-1-5232-1716-8. OCLC 953497320 .
- ^ Человек проживает 16 дней без сердца United Press International. 3 апреля 2008 г.
- ^ Нибо, Мэдс; Мэдсен, Джонна Сков (2008). «Серьезные анафилактические реакции из-за сульфата протамина: систематический обзор литературы» . Фундаментальная и клиническая фармакология и токсикология . 103 (2): 192–196. DOI : 10.1111 / j.1742-7843.2008.00274.x . ISSN 1742-7843 . PMID 18816305 .
- ^ Штутц, Брюс "Тыква: есть ли у аппарата искусственного кровообращения темная сторона?" Scientific American , 9 января 2009 г.
- ^ Дэвис, Хью. «Аппарат искусственного кровообращения - КПБ» . www.ebme.co.uk . Проверено 21 ноября 2019 .
- ^ a b c d e f g Мокадам, Нахуш А., автор, редактор. Сердечно-легочное шунтирование: праймер . OCLC 922073684 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Пирсон, ДТ; Holden M; Послад S; Мюррей А; Уотерхаус П. (1984). «Клиническое сравнение характеристик газообмена и образования газообразных микроэмбол одной мембраны и пяти пузырьковых оксигенаторов: характеристики газопереноса и образование газообразных микроэмбол». Перфузия . 1 (1): 15–26. DOI : 10.1177 / 026765918600100103 . S2CID 71419747 .
- ^ Пирсон, ДТ; Holden M; Послад S; Мюррей А; Уотерхаус П. (1984). «Клиническое сравнение характеристик газообмена и образования газовых микроэмболов одной мембраны и пяти пузырьковых оксигенаторов: гемосовместимость». Перфузия . 1 (1): 81–98. DOI : 10.1177 / 026765918600100103 . S2CID 71419747 .
- Перейти ↑ Zimmer, Heinz-Gerd (сентябрь 2003 г.). «Аппарат искусственного кровообращения был изобретен дважды - первый раз Макс фон Фрей» . Клиническая кардиология . 26 (9): 443–5. DOI : 10.1002 / clc.4960260914 . ISSN 0160-9289 . PMC 6654655 . PMID 14524605 .
- ^ Деннис C; Spreng DS; Nelson GE; и другие. (Октябрь 1951 г.). «Разработка насоса-оксигенатора для замены сердца и легких: устройство, применимое к пациентам-людям и применение в одном случае» . Анна. Surg . 134 (4): 709–21. DOI : 10.1097 / 00000658-195110000-00017 . PMC 1802968 . PMID 14878382 .
- ^ Корпорация, Боннье (1 февраля 1951 г.). Популярная наука . Bonnier Corporation. п. 4 . Проверено 4 апреля 2018 года .
- ^ "U of U Health - Празднование 60-летия кардиохирургии в Юте с Расселом М. Нельсоном, доктором медицины" utah.edu . Архивировано из оригинального 17 -го января 2018 года . Проверено 4 апреля 2018 года .
- ^ Нортон, Джеффри (2008). Хирургия: фундаментальные науки и клинические данные . Нью-Йорк: спрингер. С. 1473 . ISBN 978-0-387-30800-5.
- ^ Хедлунд, Келли Д. [1] Дань уважения Фрэнку Ф. Олбриттену младшему. Происхождение левого желудочка в первые годы операции на открытом сердце с помощью аппарата сердца-легкого Гиббона. Журнал Техасского института сердца, Техасский институт сердца. J. 2001; 28 (4): 292–296. Лето 2001. Проверено 18 мая 2019 года.
- ↑ Cohn LH (май 2003 г.). «Пятьдесят лет операции на открытом сердце» . Тираж . 107 (17): 2168–70. DOI : 10.1161 / 01.CIR.0000071746.50876.E2 . PMID 12732590 .
- ^ « Джон Кирклин, пионер кардиохирургии, умер в возрасте 86 лет ». (23 апреля 2004 г.) Университет Алабамы в Бирмингеме. пресс-релиз
- Перейти ↑ Lim M (2006). «История экстракорпоральных оксигенаторов» . Анестезия . 61 (10): 984–95. DOI : 10.1111 / j.1365-2044.2006.04781.x . PMID 16978315 . S2CID 24970815 .
- ^ "Патент США на патент системы аварийного байпаса (Патент № 4,540,399, выданный 10 сентября 1985 г.) - Поиск патентов Justia" . patents.justia.com . Проверено 28 сентября 2019 .
- ^ Райхман, Роберт (1990). «Повышение выживаемости пациентов с использованием системы сердечно-легочной поддержки после остановки сердца» . Анналы торакальной хирургии . 49 (1): 101–105. DOI : 10.1016 / 0003-4975 (90) 90363-B . PMID 2297254 .
Внешние ссылки [ править ]
| Викискладе есть медиафайлы, связанные с сердечно-легочным шунтированием . |
- Международный консорциум по доказательной перфузии
- CircuitSurfers: блог о перфузии о сердечно-легочном шунтировании
- Hessel EA, Эдмундс LH (2003). «Экстракорпоральное кровообращение: системы перфузии» . В Cohn LH, Edmunds LH (ред.). Кардиохирургия у взрослых . Нью-Йорк: Макгроу-Хилл. С. 317–38. Архивировано из оригинала на 2006-12-10 . Проверено 9 декабря 2006 .
- Мультимедийное руководство по кардиоторакальной хирургии. Сборник искусственного кровообращения.
- Профили в науке: статьи Кларенса Денниса Избранные статьи Кларенса Денниса, которым приписывается первая попытка операции искусственного кровообращения.