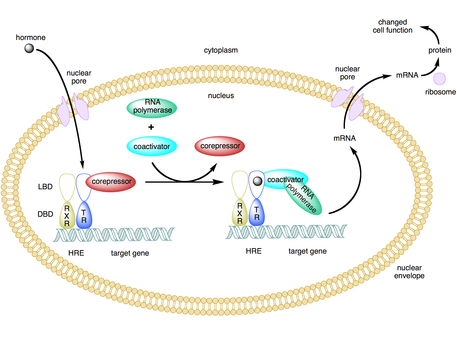
Коактиватор представляет собой тип транскрипционной coregulator , который связывается с активатором (а фактор транскрипции ) , чтобы увеличить скорость транскрипции в виде гена или набор генов. [1] Активатор содержит ДНК-связывающий домен, который связывается либо с участком промотора ДНК, либо со специфической регуляторной последовательностью ДНК , называемой энхансером . [2] [3] Связывание комплекса активатор-коактиватор увеличивает скорость транскрипции за счет привлечения общего аппарата транскрипции к промотору, что увеличивает экспрессию генов.. [3] [4] [5] Использование активаторов и коактиваторов позволяет получить высокоспецифичную экспрессию определенных генов в зависимости от типа клетки и стадии развития. [2]
Некоторые коактиваторы также обладают активностью гистонацетилтрансферазы (HAT). ЖЦФ образует крупные мультибелковых комплексы , которые ослабляют ассоциацию гистонов к ДНК пути ацетилирования в N-концевые гистоны хвоста. Это обеспечивает больше места для связывания механизма транскрипции с промотором, что увеличивает экспрессию гена. [1] [4]
Активаторы обнаружены во всех живых организмах , но белки-коактиваторы обычно встречаются только у эукариот, потому что они более сложные и требуют более сложного механизма регуляции генов. [1] [4] У эукариот коактиваторами обычно являются белки, локализованные в ядре. [1] [6]
Механизм [ править ]
Некоторые коактиваторы косвенно регулируют экспрессию гена, связываясь с активатором и вызывая конформационные изменения, которые затем позволяют активатору связываться с энхансером ДНК или последовательностью промотора. [2] [7] [8] Как только комплекс активатор-коактиватор связывается с энхансером, РНК-полимераза II и другие общие механизмы транскрипции привлекаются к ДНК, и начинается транскрипция. [9]
Гистонацетилтрансфераза [ править ]
Ядерная ДНК обычно плотно обернута вокруг гистонов, что затрудняет или делает невозможным доступ к ДНК для механизмов транскрипции. Эта ассоциация в первую очередь обусловлена электростатическим притяжением между ДНК и гистонами, поскольку фосфатный остов ДНК отрицательно заряжен, а гистоны богаты остатками лизина, которые заряжены положительно. [10] Тесная ассоциация ДНК-гистон предотвращает транскрипцию ДНК в РНК.
Многие коактиваторы обладают активностью гистонацетилтрансферазы (HAT), что означает, что они могут ацетилировать определенные остатки лизина на N-концевых хвостах гистонов. [4] [7] [11] В этом методе активатор связывается с сайтом энхансера и привлекает комплекс HAT, который затем ацетилирует гистоны, связанные с нуклеосомным промотором, путем нейтрализации положительно заряженных остатков лизина. [7] [11] Эта нейтрализация заряда заставляет гистоны иметь более слабую связь с отрицательно заряженной ДНК, что расслабляет структуру хроматина, позволяя другим факторам транскрипции или аппарату транскрипции связываться с промотором (инициация транскрипции). [4] [11]Ацетилирование комплексами HAT может также помочь сохранить хроматин открытым на протяжении всего процесса удлинения, увеличивая скорость транскрипции. [4]
Ацетилирование N-концевого гистонового хвоста является одной из наиболее распространенных модификаций белков, обнаруживаемых у эукариот, причем около 85% всех белков человека ацетилируются. [12] Ацетилирование имеет решающее значение для синтеза, стабильности, функции, регуляции и локализации белков и транскриптов РНК. [11] [12]
HAT действуют аналогично N-концевым ацетилтрансферазам (NAT), но их ацетилирование обратимо, в отличие от NAT. [13] HAT-опосредованное ацетилирование гистонов обращается с использованием гистондеактетилазы (HDAC), которая катализирует гидролиз остатков лизина, удаляя ацетильную группу из гистонов. [4] [7] [11] Это приводит к тому, что хроматин закрывается из своего расслабленного состояния, что затрудняет связывание транскрипционного аппарата с промотором, таким образом подавляя экспрессию генов. [4] [7]
Примеры коактиваторов, которые проявляют активность HAT, включают CARM1 , CBP и EP300 . [14] [15]
Corepression [ править ]
Многие соактиваторы также действуют как корепрессоры при определенных обстоятельствах. [5] [9] Кофакторы, такие как TAF1 и BTAF1, могут инициировать транскрипцию в присутствии активатора (действовать как коактиватор) и подавлять базальную транскрипцию в отсутствие активатора (действовать как корепрессор). [9]
Значение [ править ]
Биологическое значение [ править ]
Регуляция транскрипции - один из наиболее распространенных способов изменения экспрессии генов организмом. [16] Использование активации и коактивации позволяет лучше контролировать, когда, где и сколько белка вырабатывается. [1] [7] [16] Это позволяет каждой клетке быстро реагировать на экологические или физиологические изменения и помогает смягчить любые повреждения, которые могут возникнуть, если бы они не регулировались иным образом. [1] [7]
Сопутствующие расстройства [ править ]
Мутации генов-коактиваторов, ведущие к потере или усилению функции белка, были связаны с такими заболеваниями и расстройствами, как врожденные дефекты , рак (особенно гормонозависимые раковые заболевания), нарушения развития нервной системы и умственная отсталость (ID), среди многих других. [17] [5] Нарушение регуляции, ведущее к избыточной или недостаточной экспрессии коактиваторов, может пагубно взаимодействовать со многими лекарствами (особенно с антигормональными препаратами) и приводит к раку, проблемам с фертильностью, а также нарушениям нервного развития и психоневрологическим расстройствам . [5] Для конкретного примера нарушение регуляцииCREB-связывающий белок (CBP), который действует как коактиватор для множества факторов транскрипции в центральной нервной системе (ЦНС), репродуктивной системе, тимусе и почках, был связан с болезнью Хантингтона , лейкемией , синдромом Рубинштейна-Тайби , расстройствами нервного развития и дефицит иммунной системы , кроветворения и функции скелетных мышц . [14] [18]
Как мишени для наркотиков [ править ]
Коактиваторы являются многообещающими мишенями для лекарственной терапии при лечении рака, нарушения обмена веществ , сердечно-сосудистых заболеваний и диабета 2 типа , а также многих других заболеваний. [5] [19] Например, коактиватор стероидных рецепторов (SCR) NCOA3 часто сверхэкспрессируется при раке груди , поэтому разработка молекулы ингибитора, которая нацелена на этот коактиватор и снижает его экспрессию, может быть использована в качестве потенциального лечения рака груди. [15] [20]
Поскольку факторы транскрипции контролируют множество различных биологических процессов, они являются идеальными мишенями для лекарственной терапии. [14] [21] Коактиваторы, которые их регулируют, можно легко заменить синтетическим лигандом, который позволяет контролировать увеличение или уменьшение экспрессии генов. [14]
Дальнейшие технологические достижения дадут новое понимание функции и регуляции коактиваторов на уровне всего организма и выяснят их роль в заболеваниях человека, что, как мы надеемся, станет лучшими мишенями для будущих лекарственных препаратов. [14] [15]
Известные коактиваторы [ править ]
На сегодняшний день известно более 300 корегуляторов. [15] Некоторые примеры этих соактиваторов включают: [22]
- ARA54 нацелен на рецепторы андрогенов
- ATXN7L3 нацелен на несколько членов суперсемейства ядерных рецепторов
- BCL3 нацелен на рецептор 9-цис-ретиноевой кислоты (RXR)
- CBP нацелен на многие факторы транскрипции
- CDC25B нацелен на стероидные рецепторы
- COPS5 нацелен на несколько ядерных рецепторов
- DDC нацелена на рецепторы андрогенов
- EP300 нацелен на многие факторы транскрипции
- KAT5 нацелен на многие ядерные рецепторы
- KDM1A нацелен на рецепторы андрогенов
- Семейство коактиваторов стероидных рецепторов (SRC)
- NCOA1 нацелен на несколько членов суперсемейства ядерных рецепторов.
- NCOA2 нацелен на несколько членов суперсемейства ядерных рецепторов
- NCOA3 нацелен на несколько ядерных рецепторов и факторов транскрипции
См. Также [ править ]
- Репрессор
- Регулирование экспрессии генов
- Корегулятор транскрипции
- Перевод
- TcoF-DB
Ссылки [ править ]
- ^ Б с д е е Courey AJ (2008). Механизмы регуляции транскрипции . Мальден, Массачусетс: Блэквелл. ISBN 978-1-4051-0370-1. OCLC 173367793 .
- ^ a b c «Общий фактор транскрипции / фактор транскрипции» . Изучите науку в Scitable . Проверено 29 ноября 2017 .
- ^ a b Pennacchio LA, Bickmore W, Dean A, Nobrega MA, Bejerano G (апрель 2013 г.). «Энхансеры: пять основных вопросов» . Природа Обзоры Генетики . 14 (4): 288–95. DOI : 10.1038 / nrg3458 . PMC 4445073 . PMID 23503198 .
- ^ Б с д е е г ч Брауна CE, Lechner T, L Howe, Workman JL (январь 2000). «Множество HAT коактиваторов транскрипции». Направления биохимических наук . 25 (1): 15–9. DOI : 10.1016 / S0968-0004 (99) 01516-9 . PMID 10637607 .
- ^ а б в г д Кумар Р., О'Мэлли Б.В. (2008). Корегуляторы НР и болезни человека . Хакенсак, штат Нью-Джерси: World Scientific. ISBN 978-981-270-536-5. OCLC 261137374 .
- ^ Vosnakis N, Кох М, Шир Е, Кесслер Р, Mely У, Р Didier, Тора л (сентябрь 2017 г.). «Коактиваторы и общие факторы транскрипции имеют две различные динамические популяции, зависящие от транскрипции» . Журнал EMBO . 36 (18): 2710–2725. DOI : 10.15252 / embj.201696035 . PMC 5599802 . PMID 28724529 .
- ^ a b c d e f g Шпигельман Б.М., Генрих Р. (октябрь 2004 г.). «Биологический контроль с помощью регулируемых транскрипционных коактиваторов». Cell . 119 (2): 157–67. DOI : 10.1016 / j.cell.2004.09.037 . PMID 15479634 . S2CID 14668705 .
- ^ Скоулз NS, Weinzierl RO (май 2016). "Молекулярная динамика" нечетких "взаимодействий активатор-коактиватор транскрипции" . PLOS Вычислительная биология . 12 (5): e1004935. Bibcode : 2016PLSCB..12E4935S . DOI : 10.1371 / journal.pcbi.1004935 . PMC 4866707 . PMID 27175900 .
- ^ a b c Thomas MC, Chiang CM (май 2006 г.). «Общий аппарат транскрипции и общие кофакторы». Критические обзоры в биохимии и молекулярной биологии . 41 (3): 105–78. CiteSeerX 10.1.1.376.5724 . DOI : 10.1080 / 10409230600648736 . PMID 16858867 . S2CID 13073440 .
- ^ Decher, Геро (1997-08-29). «Нечеткие наноузлы: к слоистым полимерным мультикомпозитам». Наука . 277 (5330): 1232–1237. DOI : 10.1126 / science.277.5330.1232 . ISSN 0036-8075 .
- ^ a b c d e Хермансон О., Гласс К. К., Розенфельд М. Г. (2002). «Корегуляторы ядерных рецепторов: несколько режимов модификации». Тенденции в эндокринологии и метаболизме . 13 (2): 55–60. DOI : 10.1016 / s1043-2760 (01) 00527-6 . PMID 11854019 . S2CID 38649132 .
- ^ а б Ван Дамм П., Отверстие К, Пимента-Маркес А, Хелсенс К., Вандекеркхове Дж., Мартиньо Р.Г., Геваерт К., Арнесен Т. (июль 2011 г.). «NatF способствует эволюционному сдвигу в ацетилировании N-конца белка и важен для нормальной сегрегации хромосом» . PLOS Genetics . 7 (7): e1002169. DOI : 10.1371 / journal.pgen.1002169 . PMC 3131286 . PMID 21750686 .
- ^ Стархейм KK, Gevaert K, Арнесен T (апрель 2012). «Белковые N-концевые ацетилтрансферазы: когда начало имеет значение». Направления биохимических наук . 37 (4): 152–61. DOI : 10.1016 / j.tibs.2012.02.003 . PMID 22405572 .
- ^ а б в г д Лонард Д.М., О'Мэлли Б.В. (октябрь 2012 г.). «Корегуляторы ядерных рецепторов: модуляторы патологии и терапевтические мишени» . Обзоры природы. Эндокринология . 8 (10): 598–604. DOI : 10.1038 / nrendo.2012.100 . PMC 3564250 . PMID 22733267 .
- ^ a b c d Hsia EY, Goodson ML, Zou JX, Privalsky ML, Chen HW (октябрь 2010 г.). «Корегуляторы ядерных рецепторов как новая парадигма терапевтического воздействия» . Расширенные обзоры доставки лекарств . 62 (13): 1227–37. DOI : 10.1016 / j.addr.2010.09.016 . PMC 5004779 . PMID 20933027 .
- ^ а б «Усилитель» . Изучите науку в Scitable . Проверено 29 ноября 2017 .
- ^ Берк А, Zipursky SL, Мацудаира PT, Балтимор D, Дарнелл J (2000). Лодиш HF (ред.). Молекулярная клеточная биология (4-е изд.). Нью-Йорк: WH Freeman. ISBN 978-0-7167-3136-8. OCLC 41266312 .
- ^ Becnel Л.Б., Дарлингтона Ю.Ф., Orechsner S, Истон-Отмечает Дж, Воткинс СА, McOwiti А, Канканамге WH, Dehart М, Сильва СМ. «CBP». NURSA Molecules . DOI : 10,1621 / 8egsudafco .
- ^ «Ядерные рецепторы» . course.washington.edu . Проверено 29 ноября 2017 .
- ^ Tien JC, Сюй J (ноябрь 2012). «Коактиватор-3 стероидного рецептора как потенциальная молекулярная мишень для лечения рака» . Мнение эксперта о терапевтических целях . 16 (11): 1085–96. DOI : 10.1517 / 14728222.2012.718330 . PMC 3640986 . PMID 22924430 .
- ^ Сладек FM (октябрь 2003). «Ядерные рецепторы как мишени для лекарств: новые разработки в корегуляторах, орфанных рецепторах и основных терапевтических областях». Мнение эксперта о терапевтических целях . 7 (5): 679–84. DOI : 10.1517 / 14728222.7.5.679 . PMID 14498828 . S2CID 16891519 .
- ^ «НУРСА - Молекулы» . nursa.org . Проверено 30 ноября 2017 .
Внешние ссылки [ править ]
- Атлас сигналов ядерных рецепторов (исследовательский консорциум и база данных, финансируемые NIH; включает журнал с открытым доступом, индексируемый PubMed, Сигналы ядерных рецепторов )
- TcoF - Dragon база данных кофакторов транскрипции и белков, взаимодействующих с факторами транскрипции
