| Диметилсульфоксид редуктаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 1.8.5.3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
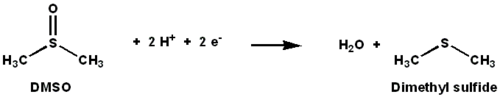
ДМСО-редуктаза представляет собой молибден- содержащий фермент, который катализирует восстановление диметилсульфоксида (ДМСО) до диметилсульфида (ДМС). Этот фермент служит концевой редуктазой в анаэробных условиях у некоторых бактерий, причем ДМСО является концевым акцептором электронов. В ходе реакции атом кислорода в ДМСО переводится в молибден, а затем восстанавливается до воды.
ДМСО-редуктаза (ДМСОР) и другие члены семейства ДМСО-редуктаз уникальны для бактерий и архей . Ферменты этого семейства в анаэробном окислительном фосфорилировании и литотрофном дыхании на основе неорганических доноров . Эти ферменты были созданы для разложения оксоанионов. [1] [2] [3] DMSOR катализирует перенос двух электронов и одного атома кислорода в реакции. Активный центр DMSOR содержит молибден, который в других случаях редко встречается в биологии. [2]
Третичная структура и активный сайт [ править ]
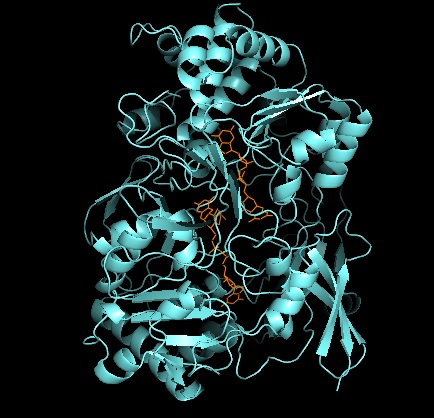
Что касается других членов семейства DMSO-редуктаз, третичная структура DMSOR состоит из Mo-окружающих доменов I-IV, с доменом IV, сильно взаимодействующим с Mo-кофакторами пираноптериндитиолена (P- и Q-птерином) активного сайта. [2] [3] Члены семейства ДМСО-редуктазы различаются по активным сайтам. [3] В случае DMSOR центр Mo находится в двух дитиоленах, обеспечиваемых двумя кофакторами пираноптерина. Эти органические кофакторы, называемые молибдоптеринами, связаны с GMP для создания динуклеотидной формы. Дополнительный пятый кэп-подобный лиганд представляет собой боковую цепь О остатка серина-147, дополнительно классифицируя фермент как ДМСО редуктазу III типа. Серин InType I и II заменен остатками цистеина и аспартата соответственно. В зависимости от окислительно-восстановительного состояния Мо, которое колеблется между IV, V или VI по мере протекания реакции, ядро Мо активного центра также может быть лигировано с атомом кислорода аква-, гидроксо- или оксогруппы, соответственно. . Исследования показали, что конкретная идентичность аминокислоты, используемой для координации ядра Мо, сильно влияет на средний окислительно-восстановительный потенциал Мо и состояние протонирования лигирования кислородных групп, которые являются ключевыми детерминантами в механизме катализа фермента. [2]
Механизм [ править ]
Первоначальные исследования изотопного DMSO 18 установили механизм двойной оксотрансферазы для DMSOR R. sphaeroides . В этом механизме меченый O 18 переносится с субстрата на Mo, который затем переносит O 18 на 1,3,5-триаза-7-фосфаадамантан (PTA) с образованием PTAO 18 . [6] По аналогичному механизму ДМСО переводит O в Mo, и образующийся центр Mo (VI) O восстанавливается, давая воду. [7]
Исследования синтетических комплексов Mo- бисдитиолен предполагают перенос кислорода, перенос электрона. Используя XAS и DFT с S K-краем, эти модельные исследования указывают на согласованное расщепление SO и перенос электронов. Скорости пропорциональны уменьшению прочности связи XO субстрата и увеличению протонного сродства субстрата. [8]
Рентгеновская кристаллография установила, что общая третичная структура фермента остается постоянной в ходе реакции. Однако несколько различных экспериментов, проведенных с DMSOR R. sphaeroides, показали разные результаты для координационной активности четырех потенциальных дитиоленовых лигандов. В то время как одно исследование с помощью рентгеновской кристаллографии пришло к выводу об эквидистантной координации всех четырех лигандов Mo-S в окисленной форме, что подтверждается многочисленными исследованиями рентгеновской спектроскопии поглощения (XAS), другое исследование охарактеризовало асимметричные расстояния Mo-S. Оба исследования, а также электронный парамагнитный резонанс(EPR) исследования предсказали, что активный сайт Mo очень гибкий с точки зрения положения и степени потенциальной координации лигандов. [7] [9]
Данные, предполагающие наличие двух существенно асимметричных кофакторов пираноптерина, были использованы для предположения механизма реакции. В полностью окисленной форме активного центра Mo VI оксогруппа и сериновые лиганды координировались на расстоянии 1,7 A от центра Mo. S1 и S2 P-птерина и S1 Q-птерина были расположены на расстоянии 2,4 А от Мо, а S2 Q-птерина - на расстоянии 3,1 А. Эта асимметрия птерина может быть результатом транс-эффекта оксогруппы, ослабляющего связь S2-Mo, которая расположена прямо напротив оксогруппы. [7]
Напротив, структура полностью восстановленной формы Mo IV активного центра показала, что S1 и S2 P-птерин и S1 Q-птерин сохраняли полную координацию, однако S2 Q-птерина сдвигался от металлического центра, что указывает на снижение координации. . Этот сдвиг в длине связи лиганд-Мо согласуется с предполагаемым механизмом прямого переноса кислорода от субстрата ДМСО к Мо. Более слабая координация дитиолена в восстановленной форме фермента может способствовать прямому связыванию S = O. При восстановлении Мо и протонировании оксогруппы предполагается, что источник электронов цитохрома может связываться с углублением над активным центром и напрямую восстанавливать центр Мо, или же этот цитохром может связываться с хорошо сольватированной полипептидной петлей. в непосредственной близости от Q-птерина, и Q-птерин может опосредовать этот перенос электрона.[7]
Сотовая связь и регулирование [ править ]
У R. sphaeroides DMSOR представляет собой водорастворимый белок, состоящий из одной субъединицы, который не требует дополнительных кофакторов, кроме птерина. У E. coli DMSOR встроен в мембрану и имеет три уникальные субъединицы, одна из которых включает характерный кофактор птерина, другая - четыре кластера 4Fe: 4S , и последняя трансмембранная субъединица, которая связывает и окисляет менахинол. Перенос е- от менахинола к кластерам 4Fe: 4S и, наконец, к активному сайту птерина-Мо генерирует протонный градиент, используемый для генерации АТФ. [7]
DMSOR регулируется преимущественно на уровне транскрипции. Он кодируется геном dor и экспрессируется при активации сигнальным каскадом, который регулируется белками DorS, DorR и DorC. Исследование слияний lacZ (репортерных генов) с соответствующими промоторами dorS, dorR и dorC пришло к выводу, что экспрессия DorR и DorC увеличивается в среде с пониженным содержанием кислорода, но на экспрессию DorS не влияет концентрация кислорода. Экспрессия DorC также увеличивалась с увеличением концентрации ДМСО. [10]
Воздействие на окружающую среду [ править ]
DMS, продукт DMSOR, является компонентом цикла серы . ДМС окисляется до метансульфонатов , которые вызывают конденсацию облаков над открытыми океанами, где альтернативный источник зародышеобразования, пыль, отсутствует. Образование облаков - ключевой компонент в увеличении альбедо Земли и регулировании температуры атмосферы, поэтому этот фермент и реакция, которую он катализирует, могут оказаться полезными на границе контроля климата. [11]
Ссылки [ править ]
- ^ Каплер U, Шефер Н (2014). «Глава 11. Превращения диметилсульфида ». В Kroneck PM, Torres ME (ред.). Металлическая биогеохимия газообразных соединений окружающей среды . Ионы металлов в науках о жизни. 14 . Springer. С. 279–313. DOI : 10.1007 / 978-94-017-9269-1_11 . ISBN 978-94-017-9268-4. PMID 25416398 .
- ^ а б в г McEwan AG, Kappler U (2004). «Семейство ДМСО редуктазы микробных ферментов молибдена» (PDF) . Австралийский биохимик . 35 (3): 17–20. Архивировано из оригинального (PDF) 07 марта 2014 года . Проверено 27 февраля 2014 .
- ^ a b c d e McEwan AG, Ridge JP, McDevitt CA, Hugenholtz P (2002). «Семейство ДМСО редуктазы микробных ферментов молибдена; молекулярные свойства и роль в диссимиляционном восстановлении токсичных элементов». Геомикробиологический журнал . 19 (1): 3–21. DOI : 10.1080 / 014904502317246138 .
- ^ PDB : 1DMS ; Шнайдер Ф., Лёве Дж., Хубер Р., Шинделин Х., Кискер С., Кнеблейн Дж. (Октябрь 1996 г.). «Кристаллическая структура диметилсульфоксидредуктазы из Rhodobacter capsulatus при разрешении 1,88 A». Журнал молекулярной биологии . 263 (1): 53–69. DOI : 10.1006 / jmbi.1996.0555 . PMID 8890912 .
- ^ PDB : 4DMR ; McAlpine AS, McEwan AG, Bailey S (январь 1998 г.). «Кристаллическая структура высокого разрешения ДМСО редуктазы в комплексе с ДМСО». Журнал молекулярной биологии . 275 (4): 613–23. DOI : 10.1006 / jmbi.1997.1513 . PMID 9466935 .
- ^ Schultz BE, Hille R, Holm RH (1995), "Прямой перенос атома кислорода в механизме действия диметилсульфоксидредуктазы Rhodobacter sphaeroides", Журнал Американского химического общества , 117 (2): 827-828, DOI : 10.1021 / ja00107a031 , ISSN 0002-7863
- ^ а б в г д Кискер С., Шинделин Х., Рис, округ Колумбия (1997). «Ферменты, содержащие кофактор молибдена: структура и механизм» (PDF) . Ежегодный обзор биохимии . 66 : 233–67. DOI : 10.1146 / annurev.biochem.66.1.233 . PMID 9242907 .
- ^ Tenderholt AL, Ван JJ, Szilagyi RK, Holm RH, Ходжсон KO, Hedman B, Solomon EI (июнь 2010). «Рентгеновская абсорбционная спектроскопия с K-краем серы и расчеты функционала плотности для Mo (IV) и Mo (VI) = O бис-дитиоленов: понимание механизма переноса оксо в ДМСО редуктазе и родственных функциональных аналогах» . Журнал Американского химического общества . 132 (24): 8359–71. DOI : 10.1021 / ja910369c . PMC 2907113 . PMID 20499905 .
- Перейти ↑ McAlpine AS, McEwan AG, Shaw AL, Bailey S (1997). «Молибденовый активный центр ДМСО редуктазы из Rhodobacter capsulatus: кристаллическая структура окисленного фермента с разрешением 1,82 А и фермента, восстановленного дитионитом, с разрешением 2,8 А». JBIC . 2 (6): 690–701. DOI : 10.1007 / s007750050185 .
- ^ Gunsalus RP (ноябрь 1992). «Контроль потока электронов в Escherichia coli: скоординированная транскрипция генов дыхательного пути» . Журнал бактериологии . 174 (22): 7069–74. PMC 207394 . PMID 1331024 .
- ↑ Sarkar B (21 марта 2002 г.). Тяжелые металлы в окружающей среде . CRC Press. п. 456. ISBN. 978-0-8247-4475-5.