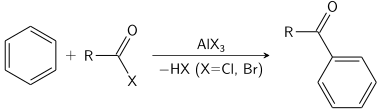Электрофильное ароматическое замещение - это органическая реакция, в которой атом, связанный с ароматической системой (обычно водородом), заменяется электрофилом . Некоторые из наиболее важных электрофильных ароматических замещений - это ароматическое нитрование , ароматическое галогенирование , ароматическое сульфирование и реакция Фриделя – Крафтса алкилирования и ацилирования . [1]
Иллюстративные реакции [ править ]
Наиболее широко распространенный пример этой реакции - этилирование бензола.
Приблизительно 24 700 000 тонн было произведено в 1999 году. [2] (После дегидрирования и полимеризации производится товарный пластиковый полистирол ). В этом процессе твердые кислоты используются в качестве катализатора для образования зарождающегося карбокатиона. Проводятся многие другие электрофильные реакции бензола, хотя в гораздо меньших масштабах они являются ценными путями к ключевым промежуточным соединениям. Нитрование бензола достигается действием иона нитрония как электрофила. Сульфирование с дымящей серной кислоты дает бензолсульфоновую кислоту . Ароматические галогенирование с бромом , хлором, или йод дает соответствующие арилгалогениды. Эта реакция обычно катализируется соответствующим тригалогенидом железа или алюминия.
Реакция Фриделя – Крафтса может быть проведена либо как ацилирование, либо как алкилирование . Часто используется трихлорид алюминия , но можно применять практически любую сильную кислоту Льюиса . Для реакции ацилирования требуется стехиометрическое количество трихлорида алюминия.
Механизм реакции [ править ]
Общий механизм реакции, обозначенный механистический символ Хьюз-Ингольд S E Ar , [3] начинается с ароматическим кольцом атакующего электрофильным E + . Эта стадия приводит к образованию положительно заряженного и делокализованного циклогексадиенильного катиона , также известного как ион арения, промежуточное соединение Веланда или σ-комплекс арена. Было охарактеризовано множество примеров этого карбокатиона , но при нормальных рабочих условиях эти высококислотные частицы будут отдавать протон, присоединенный к sp 3углерод к растворителю (или любому другому слабому основанию) для восстановления ароматичности. Конечный результат - замена H на E в арильном кольце. Иногда другие электрофуги (группы, которые могут уйти без своей электронной пары ), кроме H +, будут отходить, чтобы восстановить ароматичность; эти разновидности включают силильные группы (как SiR 3 + ), карбоксигруппу (как CO 2 + H + ), йодогруппу (как I + ) и третичные алкильные группы, такие как трет- бутил (как R + ). Способность этих типов заместителей уходить иногда используется синтетически, особенно в случае замены силила другой функциональной группой ( ipsoатака). Однако потеря таких групп, как йод или алкил, чаще является нежелательной побочной реакцией.
Влияние групп заместителей [ править ]
Как на региоселективность - различные паттерны замещения аренов - так и на скорость электрофильного ароматического замещения влияют заместители, уже присоединенные к бензольному кольцу. Что касается региоселективности, некоторые группы способствуют замещению в орто- или пара-положениях, тогда как другие группы способствуют замене в мета-положении. Эти группы называются орто-пара-направляющими или мета-направляющими соответственно. Кроме того, некоторые группы увеличивают скорость реакции ( активация ), а другие уменьшают скорость ( деактивация ). Хотя закономерности региоселективности можно объяснить с помощью резонансных структур.влияние на кинетику можно объяснить как резонансными структурами, так и индуктивным эффектом .
Скорость реакции [ править ]
Заместители обычно можно разделить на два класса в отношении электрофильного замещения: активирующие и дезактивирующие по отношению к ароматическому кольцу. Активация заместителей или активирующих групп стабилизировать катионный промежуточный продукт образуется при замещении, жертвуя электроны в циклическую систему, либо путем индуктивного эффекта или резонансные эффекты . Примерами активированных ароматических колец являются толуол , анилин и фенол .
Дополнительная электронная плотность, доставляемая в кольцо заместителем, не распределяется равномерно по всему кольцу, а концентрируется на атомах 2, 4 и 6, поэтому активирующие заместители также являются орто / пара директорами (см. Ниже).
С другой стороны, дезактивирующие заместители дестабилизируют промежуточный катион и, таким образом, снижают скорость реакции за счет индуктивного или резонансного эффектов. Они делают это за счет удаления электронной плотности из ароматического кольца. Дезактивация ароматической системы означает, что обычно требуются более жесткие условия для завершения реакции. Примером этого является нитрование толуола во время производства тринитротолуола.(ТНТ). В то время как первое нитрование активированного толуольного кольца можно проводить при комнатной температуре и с разбавленной кислотой, второе нитрование дезактивированного нитротолуольного кольца уже требует длительного нагревания и более концентрированной кислоты, а третье - при очень сильно дезактивированной динитротолуол, нужно делать в кипящей концентрированной серной кислоте . Группы, которые отводят электроны за счет резонанса, уменьшают электронную плотность, особенно в положениях 2, 4 и 6, оставляя положения 3 и 5 как группы со сравнительно более высокой реакционной способностью, поэтому эти типы групп являются мета-директорами (см. Ниже). Галогены электроотрицательны, поэтому они дезактивируются индукцией, но у них есть неподеленные пары, поэтому они являются донорами резонанса и, следовательно, орто / пара директорами.
Орто / пара директора [ править ]
Группы с неподеленной пары электронов, таких как аминогруппы группы анилина , сильно активации и орто / пункт -directing резонансом. Такие активирующие группы отдают эти неподеленные электроны пи- системе, создавая отрицательный заряд в орто- и пара-положениях. Таким образом, эти позиции являются наиболее реактивными по отношению к бедному электронами электрофилам. Наивысшая плотность электронов находится как в орто, так и в пара-положениях [ требуется пояснение ], хотя эта повышенная реакционная способность может быть компенсирована стерическими препятствиями.между заместителем и электрофилом. Таким образом, конечный результат электрофильного ароматического замещения может быть трудно предсказать, и он обычно устанавливается только путем проведения реакции и определения соотношения орто-замещения по сравнению с пара-замещением.
В дополнение к усиленной нуклеофильной природе исходного кольца, когда электрофил атакует орто- и пара- положения анилина, атом азота может отдавать электронную плотность пи- системе (образуя ион иминия ), давая четыре резонансные структуры (в отличие от три в основной реакции). Это существенно увеличивает стабильность катионного промежуточного продукта.
Когда электрофил атакует мета- положение, атом азота не может передавать электронную плотность пи- системе, давая только три резонансных вкладчика. Это рассуждение согласуется с низкими выходами мета- замещенного продукта.
Другие заместители, такие как алкильные и арильные заместители , также могут передавать электронную плотность пи- системе; однако, поскольку у них отсутствует доступная неподеленная пара электронов, их способность делать это довольно ограничена. Таким образом, они лишь слабо активируют кольцо и не сильно затрудняют мета- позицию.
Направленная орто-металлизация - это особый тип ШАЛ со специальными орто-директорами .
Мета- директора [ править ]
Негалогеновые группы с атомами, которые являются более электроотрицательными, чем углерод, такие как группа карбоновой кислоты (-CO 2 H), отнимают значительную электронную плотность от пи- системы. Эти группы являются сильно деактивирующими группами . Кроме того, поскольку замещенный углерод уже беден электронами, любая структура, имеющая резонансный вклад, в которой имеется положительный заряд на углероде, несущем электроноакцепторную группу (т.е. орто- или пара- атака), менее стабильна, чем другие. Следовательно, эти электроноакцепторные группы являются метауправляемыми, потому что это позиция, которая не имеет такой дестабилизации.
Реакция также намного медленнее (относительная скорость реакции 6 × 10 -8 по сравнению с бензолом), потому что кольцо менее нуклеофильно.
Реакция на пиридин [ править ]
По сравнению с бензолом скорость электрофильного замещения пиридина намного ниже из-за более высокой электроотрицательности атома азота. Кроме того, азот в пиридине легко получает положительный заряд либо за счет протонирования (от нитрования или сульфирования ), либо за счет кислот Льюиса (таких как AlCl 3 ), используемых для катализа реакции. Это делает реакцию еще медленнее за счет наличия смежных формальных зарядов на углероде и азоте или двух формальных зарядов на локализованном атоме. Выполнить электрофильное замещение непосредственно в пиридине практически невозможно.
Чтобы провести реакцию, они могут быть проведены с помощью 2 возможных реакций, которые обе являются косвенными.
Одним из возможных способов замещения пиридина является нуклеофильное ароматическое замещение. Даже без катализаторов атом азота, будучи электроотрицательным, может удерживать отрицательный заряд сам по себе. Другой способ - провести окисление перед электрофильным замещением. Это делает пиридин N- оксидом , который из-за отрицательного атома кислорода делает реакцию быстрее, чем пиридин и даже бензол. Затем оксид можно восстановить до замещенного пиридина.
Ипсо атака [ править ]
Присоединение входящей группы к положению в ароматическом соединении, уже имеющем группу заместителя (кроме водорода). Входящая группа может вытеснить эту замещающую группу, но также сама может быть вытеснена или перемещена в другое положение на следующем этапе. Термин « ipso- подстановка» не используется, поскольку он является синонимом подстановки. [4] Классическим примером является реакция салициловой кислоты со смесью азотной и серной кислот с образованием пикриновой кислоты . Нитрование позиции 2 включает потерю CO 2 как уходящей группы. Десульфирование, при котором сульфонильная группа замещена протоном, является обычным примером. Смотрите такжеПерестановка Хаяши . В ароматических соединениях, замещенных кремнием, кремний реагирует путем замещения ipso .
Пятичленные гетероциклы [ править ]
По сравнению с бензолом фураны , тиофены и пирролы более подвержены электрофильной атаке. Все эти соединения содержат атом с неподеленной парой электронов ( кислород , сера или азот ) в качестве члена ароматического кольца, что существенно стабилизирует катионный промежуточный продукт. Примеры электрофильного замещения в пиррол являются реакция Пикта-Шпенглер и реакция Бишлер-Наперальский .
Асимметричное электрофильное ароматическое замещение [ править ]
Электрофильные ароматические замещения прохиральными углеродными электрофилами были адаптированы для асимметричного синтеза путем перехода на хиральные кислотные катализаторы Льюиса, особенно в реакциях типа Фриделя-Крафтса . Ранний пример касается добавления хлораля к фенолам, катализируемого хлоридом алюминия, модифицированным (-) - ментолом . [5] глиоксилата соединение было добавлено в N, N-диметиланилина с хиральной бисоксазолина лиганд - медь (II) , трифлат каталитической системы , также и вГидроксиалкилирование Фриделя-Крафтса : [6]
В другом процессе алкилирования N-метилпиррол реагирует с кротоновым альдегидом, катализируемый трифторуксусной кислотой, модифицированной хиральным имидазолидиноном : [7]
Индол реагирует с енамидом, катализируемый хиральной фосфорной кислотой, производной от BINOL : [8]
В присутствии 10–20% хирального катализатора достигается 80–90% ее .
Другие реакции [ править ]
- Другие реакции , которые следуют электрофильного ароматического замещения рисунка представляют собой группу ароматических реакций формилирования включая реакции Вильсмайера-Хаака , в реакции Гаттермана Коха и реакции Реймер-Тимана .
- Другими электрофилами являются ароматические соли диазония в диазониевых сочетаниях , диоксид углерода в реакции Кольбе-Шмитта и активированные карбонильные группы в конденсации Пехмана , ион гидроксикарбения в хлорметилировании Бланка через промежуточное соединение (гидроксиметил) арен (бензиловый спирт), хлорильный катион (ClO 3 + ) для электрофильного перхлорилирования .
- В многоступенчатой реакции Лемстедта – Танасеску одним из электрофилов является промежуточный N-нитрозо.
- В реакции Черняка – Эйнхорна (названной в честь Джозефа Черняка и Альфреда Эйнхорна ) электрофилом является производное амида N-метанола [9] [10]
См. Также [ править ]
- Электрофильное галогенирование
- Нуклеофильное ароматическое замещение
Ссылки [ править ]
- ^ Смит, Майкл Б .; Март, Джерри (2007), Расширенная органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Винсент А. Велч, Кевин Дж. Фэллон, Энциклопедия промышленной химии Ульмана «Этилбензол» Хайнца-Петера Гелбке , Wiley-VCH, Weinheim, 2005. doi : 10.1002 / 14356007.a10_035.pub2
- ^ Gawley, Роберт Э. (1999-06-04). «Предложение по (небольшой) модификации механистических дескрипторов Хьюза-Ингольда для реакций замещения». Буквы тетраэдра . 40 (23): 4297–4300. DOI : 10.1016 / S0040-4039 (99) 00780-7 . ISSN 0040-4039 .
- ^ IUPAC , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Онлайн исправленная версия: (2006–) " ipso -attack ". DOI : 10,1351 / goldbook.I03251
- ^ Асимметричное электрофильное замещение фенолов в гидроксиалкилировании Фриделя-Крафтса. Энантиоселективное орто-гидроксиалкилирование, опосредованное хиральными алкоксиалюминийхлоридами Franca Bigi, Giovanni Casiraghi, Giuseppe Casnati, Giovanni Sartori, Giovanna Gasparri Fava и Marisa Ferrari Belicchi J. Org. Chem. ; 1985 ; 50 (25) pp 5018–5022; DOI : 10.1021 / jo00225a003
- ^ Каталитические энантиоселективные реакции Фриделя – Крафтса ароматических соединений с глиоксилатом: простая процедура синтеза оптически активных сложных эфиров ароматической миндальной кислоты Николас Гатергуд, Вэй Чжуанг и Карл Анкер Джргенсен J. Am. Chem. Soc. ; 2000 ; 122 (50) pp 12517–12522; (Статья) doi : 10.1021 / ja002593j
- ^ Новые стратегии в органическом катализе: первое энантиоселективное органокаталитическое алкилирование Фриделя-Крафтса Ник А. Парас и Дэвид В. К. Макмиллан J. Am. Chem. Soc. ; 2001 ; 123 (18) с. 4370–4371; (Связь) doi : 10.1021 / ja015717g
- ^ Катализируемая хиральной кислотой Бренстеда энантиоселективная реакция Фриделя – Крафтса индолов и а-ариленамидов: построение четвертичных атомов углерода И-Ся Цзя, Цзюнь Чжун, Шоу-Фей Чжу, Цань-Мин Чжан и Ци-Линь Чжоу Ангью. Chem. Int. Эд. 2007 , 46, 5565 -5567 дои : 10.1002 / anie.200701067
- ^ Verfahren цур Darstellung фон Benzylphtalimiden Джозеф Tscherniac Немецкий патент 1902 , DE-134979
- ^ Ueber умирают N-Methylolverbindungen дер Säureamide [Erste Abhandlung.] Альфред Айнхорн Эдуард Bischkopff, Бруно Желинский, Густав Шупп, Эдуард Spröngerts, Карл Ladisch и Теодор Mauermayer Liebigs Annalen 1905 , 343 , стр 207-305. DOI : 10.1002 / ИЦПП .19053430207
Внешние ссылки [ править ]
- Реакции ароматического замещения - МГУ