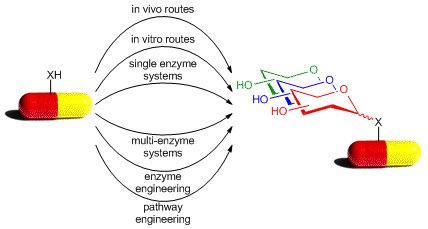
Гликорандомизация - это технологическая платформа для открытия и разработки лекарств, позволяющая быстро диверсифицировать биоактивные небольшие молекулы, ведущие лекарственные препараты и / или одобренные лекарственные средства за счет присоединения сахаров. Первоначально разработанные как простой метод манипулирования углеводными заменами встречающихся в природе гликозидов для получения соответствующих библиотек дифференциально гликозилированных природных продуктов , [1] [2] [3] приложения гликорандомизации расширились и теперь включают как небольшие молекулы (ведущие лекарственные препараты и одобренные препараты), так и даже макромолекулы ( белки ). [4] Также называется «гликодиверсификация», [5]гликорандомизация привела к открытию новых аналогов гликозидов, которые демонстрируют улучшения в эффективности, селективности и / или ADMET по сравнению с исходной молекулой.
Классификация [ править ]
Традиционным методом присоединения сахаров к натуральным продуктам, лекарствам или лекарственным препаратам является химическое гликозилирование . Этот классический подход обычно требует нескольких стадий защиты / снятия защиты в дополнение к ключевой реакции аномерной активации / сочетания, которая, в зависимости от пары гликозильный донор / акцептор, может приводить к смеси аномеров . В отличие от классического химического гликозилирования, методы гликорандомизации расходятся ( т. Е. Отличаются от общего исходного материала, см. Дивергентный синтез ) и не зависят от сахара / агликона.защита / снятие защиты или активация аномерного сахара. Были разработаны две дополнительные стратегии для достижения гликорандомизации / диверсификации: стратегия на основе ферментов, известная как «хемоферментная гликорандомизация», и хемоселективный метод, известный как «неогликорандомизация». Оба метода начинаются со свободного восстанавливающего сахара и целевого агликона, чтобы получить библиотеку соединений, которые различаются только сахарами, добавленными к целевому природному продукту, лекарственному средству или лекарственному свинцу.
Хемоэнзиматическая гликорандомизация [ править ]
Хемоэнзиматическая гликорандомизация была вдохновлена ранними разработками Хатчинсона и его коллег, которые предположили, что гликозилтрансферазы природного продукта способны использовать неродные доноры нуклеотидов сахара. [6] Исходная платформа для chemoenzymatic glycorandomization была основана на набор из двух высоко разрешающих ферментов активации сахара (сахар аномерной киназы и сахар-1-фосфат нуклеотидилтрансферазы ) с получением нуклеотидных библиотек сахара в качестве донора для этих неразборчивых гликозилтрансфераз , где permissivity из соответствующая сахарная киназа [7] и нуклеотидилтрансфераза [8] [9] была расширена с помощью ферментной инженериии направленная эволюция . Первое применение стратегии этих трех ферментов (киназы, нуклеотидилтрансферазы и гликозилтрансферазы) позволило получить набор из> 30 дифференциально гликозилированных ванкомицинов , некоторые члены которых были дополнительно хемоселективно диверсифицированы за счет установки сахаров, несущих хемоселективные ручки. [10] [11] [12] Эта ферментная платформа получила дальнейшее развитие за счет эволюции гликозилтрансферазы [13] и извлечения выгоды из открытия обратимости реакций, катализируемых гликозилтрансферазой, впервые обнаруженных в контексте биосинтеза калихеамицина . [14] [15]
Неогликорандомизация [ править ]
Неогликорандомизация - это метод хемоселективной гликодиверсификации, вдохновленный реакцией «неогликозилирования» на основе алкоксиамина, впервые описанной Peri и Dumy. [16] Эта реакция протекает через оксиимниевый промежуточный продукт, в конечном итоге давая более термодинамически предпочтительный неогликозид с замкнутым кольцом. Реакция неогликозилирования совместима с широким спектром сахаридных и агликоновых функциональных групп, где аномерная стереоспецифичность неогликозида является термодинамически обусловленной. Важно отметить, что структурные и функциональные исследования показывают, что неогликозиды служат хорошими имитаторами их O- гликозидных компараторов. Первое неогликорандомизированное доказательство концепции было сосредоточено на дигитоксине.где быстрое образование и скрининг цитотоксичности линии раковых клеток 78 неогликозидов дигитоксигенина выявили уникальные аналоги с улучшенной противоопухолевой активностью и сниженным потенциалом кардиотоксичности. [17] Эта платформа с тех пор была автоматизирована и использовалась в качестве эффективного инструмента медицинской химии для изменения свойств ряда натуральных продуктов и фармацевтических препаратов . [18]
Сравнение [ править ]
И хемоэнзиматическая гликорандомизация, и неогликорандомизация используют свободные восстанавливающие сахара и незащищенные агликоны и, таким образом, представляют собой заметный прогресс по сравнению с классическими методами гликозилирования. Заметным преимуществом ферментативного подхода является использование соответствующих генов, кодирующих пермиссивные киназы, нуклеотидилтрансферазы и / или гликозилтрансферазы, для применения в синтетической биологии in vivo для обеспечения гликорандомизации in vivo. [19]Однако важно отметить, что ферментативная платформа зависит от проницаемости используемых ферментов. Напротив, основным препятствием для хемоселективной неогликорандомизации является установка ручки алкоксиламина. В отличие от ферментативного подхода, аномерная стереоселективность хемоселективного метода зависит от используемого редуцирующего сахара и в некоторых случаях может приводить к образованию смесей аномеров.
Использует [ редактировать ]
Гликорандомизация используется в фармацевтической промышленности и академическом сообществе для изменения паттернов гликозилирования сахаросодержащих натуральных продуктов или для добавления сахаров к лекарствам / лекарственным препаратам. Он обеспечивает быстрый способ исследования влияния тонкой модификации сахара на фармакологические свойства аналогов натуральных продуктов [20], таким образом, обеспечивая новый подход к открытию лекарств.
Ссылки [ править ]
- ^ Ян, J .; Hoffmeister, D .; Liu, L .; Торсон, Дж.С. (2004). «Гликорандомизация натуральных продуктов». Биоорганическая и медицинская химия . 12 (7): 1577–1584. DOI : 10.1016 / j.bmc.2003.12.046 . PMID 15112655 .
- ^ Langenhan, JM; Гриффит, Бразилия; Торсон, Дж. С. (ноябрь 2005 г.). «Неогликорандомизация и химико-ферментативная гликорандомизация: два дополнительных инструмента для диверсификации натуральных продуктов». Журнал натуральных продуктов . 68 (11): 1696–711. DOI : 10.1021 / np0502084 . PMID 16309329 .
- ^ Гриффит, BR; Langenhan, JM; Торсон, Дж.С. (декабрь 2005 г.). « „ Натуральные продукты подслащивающих“через glycorandomization». Текущее мнение в области биотехнологии . 16 (6): 622–30. DOI : 10.1016 / j.copbio.2005.10.002 . PMID 16226456 .
- ^ Гантт, RW; Peltier-Pain, P; Торсон, Дж.С. (октябрь 2011 г.). «Ферментативные методы глико (диверсификация / рандомизация) лекарственных средств и малых молекул». Отчеты о натуральных продуктах . 28 (11): 1811–53. DOI : 10.1039 / c1np00045d . PMID 21901218 .
- ^ Тибодо, CJ; Мелансон, CE; Лю, HW (26 апреля 2007 г.). «Необычный биосинтез сахара и гликодиверсификация натуральных продуктов». Природа . 446 (7139): 1008–16. Bibcode : 2007Natur.446.1008T . DOI : 10,1038 / природа05814 . PMID 17460661 .
- ^ Маддури, K; Кеннеди, Дж; Ривола, G; Инвенти-Солари, А; Филиппини, S; Занусо, Дж; Коломбо, Алабама; Гевайн, км; Occi, JL; Макнил, диджей; Хатчинсон, CR (январь 1998 г.). «Производство противоопухолевого препарата эпирубицина (4'-эпидоксорубицина) и его предшественника с помощью генно-инженерного штамма Streptomyces peucetius ». Природа Биотехнологии . 16 (1): 69–74. DOI : 10.1038 / nbt0198-69 . PMID 9447597 .
- ^ Хоффмайстер, D; Ян, Дж; Лю, L; Thorson, JS (11 ноября 2003 г.). «Создание первой аномерной D / L-сахарной киназы путем направленной эволюции» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (23): 13184–9. Bibcode : 2003PNAS..10013184H . DOI : 10.1073 / pnas.2235011100 . PMC 263743 . PMID 14612558 .
- ^ Бартон, Вашингтон; Лесняк, Дж; Биггинс, JB; Джеффри, Полицейский; Цзян, Дж; Раджашанкар, КР; Торсон, Дж. С.; Николов, ДБ (июнь 2001 г.). «Структура, механизм и инженерия нуклеотидилилтрансферазы как первый шаг к гликорандомизации». Структурная биология природы . 8 (6): 545–51. DOI : 10.1038 / 88618 . PMID 11373625 .
- ^ Моретти, R; Чанг, А; Peltier-Pain, P; Бингман, Калифорния; Филлипс Г.Н., младший; Thorson, JS (15 апреля 2011 г.). «Расширение разнородности нуклеотидов и сахар-1-фосфат нуклеотидилтрансферазы RmlA посредством направленной эволюции» . Журнал биологической химии . 286 (15): 13235–43. DOI : 10,1074 / jbc.m110.206433 . PMC 3075670 . PMID 21317292 .
- ^ Фу, X; Альберманн, К; Цзян, Дж; Ляо, Дж; Чжан, К; Торсон, Дж.С. (декабрь 2003 г.). «Оптимизация антибиотиков посредством гликорандомизации in vitro». Природа Биотехнологии . 21 (12): 1467–9. DOI : 10.1038 / nbt909 . PMID 14608364 .
- ^ Фу, X; Альберманн, К; Чжан, К; Thorson, JS (14 апреля 2005 г.). «Диверсификация ванкомицина с помощью химиоферментных стратегий». Органические буквы . 7 (8): 1513–5. DOI : 10.1021 / ol0501626 . PMID 15816740 .
- ^ Пельтье-Пейн, P; Марчилло, К; Чжоу, М; Анды, ДР; Thorson, JS (5 октября 2012 г.). «Дисахаридная инженерия природного продукта посредством обратимости тандемного гликозилтрансферазного катализа и неогликозилирования» . Органические буквы . 14 (19): 5086–9. DOI : 10.1021 / ol3023374 . PMC 3489467 . PMID 22984807 .
- ^ Уильямс, GJ; Чжан, К; Торсон, Дж.С. (октябрь 2007 г.). «Расширение неразборчивости гликозилтрансферазы природного продукта путем направленной эволюции». Природа Химическая биология . 3 (10): 657–62. DOI : 10.1038 / nchembio.2007.28 . PMID 17828251 .
- ^ Чжан, C; Гриффит, Бразилия; Fu, Q; Альберманн, К; Fu, X; Ли, И. К.; Ли, Л; Thorson, JS (1 сентября 2006 г.). «Использование обратимости реакций, катализируемых гликозилтрансферазой природного продукта». Наука . 313 (5791): 1291–4. Bibcode : 2006Sci ... 313.1291Z . DOI : 10.1126 / science.1130028 . PMID 16946071 .
- ^ Гантт, RW; Peltier-Pain, P; Курнуайе, WJ; Thorson, JS (21 августа 2011 г.). «Использование простых доноров для управления равновесием реакций, катализируемых гликозилтрансферазой» . Природа Химическая биология . 7 (10): 685–91. DOI : 10.1038 / nchembio.638 . PMC 3177962 . PMID 21857660 .
- ^ Peri, F .; Dumy, P .; Муттер, М. (1998). «Хемо- и стереоселективное гликозилирование гидроксиламинопроизводных: универсальный подход к гликоконъюгатам». Тетраэдр . 54 (40): 12269–12278. DOI : 10.1016 / s0040-4020 (98) 00763-7 .
- ^ Langenhan, JM; Peters, NR; Guzei, IA; Хоффманн, FM; Thorson, JS (30 августа 2005 г.). «Повышение противоопухолевых свойств сердечных гликозидов путем неогликорандомизации» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (35): 12305–10. Bibcode : 2005PNAS..10212305L . DOI : 10.1073 / pnas.0503270102 . PMC 1194917 . PMID 16105948 .
- ^ Гофф, RD; Thorson, JS (1 августа 2014 г.). «Неогликозилирование и неогликорандомизация: инструменты для открытия новых гликозилированных биоактивных зондов и отведений на ранних стадиях» . MedChemComm . 5 (8): 1036–1047. DOI : 10.1039 / c4md00117f . PMC 4111257 . PMID 25071927 .
- ^ Уильямс, GJ; Ян, Дж; Чжан, К; Thorson, JS (21 января 2011 г.). « Прототип рекомбинантных штаммов E. coli для гликорандомизации in vivo» . ACS Химическая биология . 6 (1): 95–100. DOI : 10.1021 / cb100267k . PMC 3025069 . PMID 20886903 .
- ^ Чжан, J; Хьюз, Р.Р .; Сондерс, Массачусетс; Эльшави, SI; Пономарева Л.В.; Чжан, Й; Винчестер, SR; Scott, SA; Сункара, М. Моррис, AJ; Прендергаст, Массачусетс; Шаабан, штат Калифорния; Thorson, JS (28 декабря 2016 г.). «Идентификация нейропротекторных гликозидов споксазомицина и оксахелина с помощью химико-ферментативного гликозильного сканирования» . Журнал натуральных продуктов . 80 (1): 12–18. DOI : 10.1021 / acs.jnatprod.6b00949 . PMC 5337260 . PMID 28029796 .