
Кластеры железо-сера (или кластеры железо-сера в британском написании ) представляют собой молекулярные ансамбли железа и сульфида . Чаще всего они обсуждаются в контексте биологической роли железо-серных белков , которые широко распространены. [2] Многие кластеры Fe – S известны в области металлоорганической химии и являются предшественниками синтетических аналогов биологических кластеров (см. Рисунок).
Металлоорганические кластеры [ править ]
Металлоорганические кластеры Fe – S включают сульфидокарбонилы с формулой Fe 2 S 2 (CO) 6 , H 2 Fe 3 S (CO) 9 и Fe 3 S 2 (CO) 9 . Также известны соединения, которые включают циклопентадиенильные лиганды, такие как (C 5 H 5 ) 4 Fe 4 S 4 . [3]
Неорганические материалы [ править ]
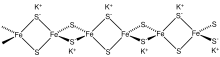
Биологические кластеры Fe – S [ править ]
Кластеры железо-сера встречаются во многих биологических системах, часто как компоненты белков переноса электронов . В ферредоксине белки являются наиболее распространенными кластерами Fe-S в природе. Они содержат центры 2Fe – 2S или 4Fe – 4S. Они встречаются во всех сферах жизни. [4]
Кластеры Fe – S можно классифицировать по их стехиометрии Fe: S [2Fe – 2S], [4Fe – 3S], [3Fe – 4S] и [4Fe – 4S]. [5] Кластеры [4Fe – 4S] встречаются в двух формах: нормальные ферредоксины и белки железа с высоким потенциалом (HiPIP). Оба имеют кубовидную структуру, но используют разные степени окисления. Они встречаются во всех формах жизни. [6]
Соответствующая окислительно-восстановительная пара во всех белках Fe – S - это Fe (II) / Fe (III). [6]
Многие кластеры были синтезированы в лаборатории с формулой [Fe 4 S 4 (SR) 4 ] 2- , которая известна для многих заместителей R и со многими катионами. Были приготовлены варианты, включая неполные кубаны [Fe 3 S 4 (SR) 3 ] 3– . [7]
В Rieske белки содержат Fe-S кластеров , которые координируют как структура 2Fe-2S и могут быть найдены в связанной с мембраной цитохром bc1 комплекса III в митохондриях эукариот и бактерий. Они также являются частью белков хлоропластов, таких как комплекс цитохрома b 6 f в фотосинтезирующих организмах. Эти фотосинтезирующие организмы включают растения, зеленые водоросли и цианобактерии , бактериальные предшественники хлоропластов. Оба являются частью цепи переноса электронов соответствующих организмов, что является решающим шагом в сборе энергии для многих организмов. [8]
В некоторых случаях кластеры Fe – S являются редокс-неактивными, но предполагается, что они играют структурную роль. Примеры включают эндонуклеазу III и MutY. [4] [9]
См. Также [ править ]
Ссылки [ править ]
- ^ Axel Керн, Кристиан Näther, Феликс Studt, Феликс Tuczek (2004). «Применение универсального силового поля к смешанным кластерам Fe / Mo-S / Se с кубаном и гетерокубаном. 1. Замещение серы на селен в ряду [Fe4X4 (YCH3) 4] 2-; X = S / Se и Y = S / Se ". Неорг. Chem . 43 (16): 5003–5010. DOI : 10.1021 / ic030347d . PMID 15285677 .CS1 maint: использует параметр авторов ( ссылка )
- ^ SJ Lippard, JM Berg «Принципы биоинорганической химии» Университетские научные книги: Милл-Вэлли, Калифорния; 1994. ISBN 0-935702-73-3 .
- ^ Огино, Х., Иномата, С., Тобита, Х. (1998). «Абиологические кластеры железо-сера». Chem. Ред . 98 (6): 2093–2122. DOI : 10.1021 / cr940081f . PMID 11848961 . CS1 maint: использует параметр авторов ( ссылка )
- ^ a b Джонсон, округ Колумбия, Дин, Д.Р., Смит, AD, Джонсон, МК (2005). «Структура, функции и формирование биологических кластеров железо-сера». Ежегодный обзор биохимии . 74 : 247–281. DOI : 10.1146 / annurev.biochem.74.082803.133518 . PMID 15952888 . CS1 maint: использует параметр авторов ( ссылка )
- ^ Лилль, Роланд (2015). «Проблема железо-серного белка» . Biochimica et Biophysica Acta . 1853 (6): 1251–1252. DOI : 10.1016 / j.bbamcr.2015.03.001 . PMC 5501863 . PMID 25746719 .
- ^ а б Фишер, N (1998). «Внутримолекулярный перенос электрона в [4Fe – 4S)]». Журнал EMBO : 849–858.
- ^ Рао, П.В. Холм, Р.Х. (2004). «Синтетические аналоги активных сайтов железо-серных белков». Chem. Ред . 104 (2): 527─559. DOI : 10.1021 / Cr020615 + . PMID 14871134 . CS1 maint: использует параметр авторов ( ссылка )
- ^ БИОЛОГИЧЕСКАЯ НЕОРГАНИЧЕСКАЯ ХИМИЯ: структура и реакционная способность . [Sl]: УНИВЕРСИТЕТСКИЕ НАУЧНЫЕ КНИГИ. 2018. ISBN 978-1938787966. OCLC 1048090793 .
- ^ Guan, Y .; Manuel, RC; Arvai, AS; Парих, СС; Мол, КД; Миллер, JH; Lloyd, S .; Тайнер, Дж. А. (декабрь 1998 г.). «Каталитическое ядро MutY, мутантные и связанные структуры аденина определяют специфичность суперсемейства ферментов репарации ДНК». Структурная биология природы . 5 (12): 1058–1064. DOI : 10,1038 / 4168 . ISSN 1072-8368 . PMID 9846876 . S2CID 22085836 .
