| Аденокарцинома легкого | |
|---|---|
| Другие названия | Легочная аденокарцинома |
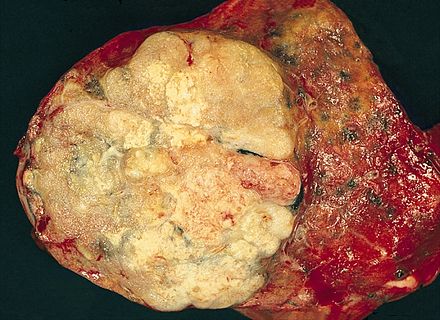 | |
| Макропатологический препарат аденокарциномы легких, удаленный в результате лобэктомии . | |
| Специальность | Онкология |
Аденокарцинома легкого является наиболее распространенным типом рака легких и, как и другие формы рака легких, характеризуется отчетливыми клеточными и молекулярными особенностями. [1] Он классифицируется как один из нескольких немелкоклеточного рака легкого (НМРЛ), чтобы отличить его от мелкоклеточного рака легкого, который имеет другое поведение и прогноз. Аденокарцинома легкого подразделяется на несколько подтипов и вариантов. [2] Признаки и симптомы этого конкретного типа рака легких аналогичны другим формам рака легких, и пациенты чаще всего жалуются на постоянный кашель и одышку.
Аденокарцинома чаще встречается у пациентов, которые курили сигареты в анамнезе, и является наиболее распространенной формой рака легких у молодых женщин и азиатского населения. Патофизиология аденокарциномы сложна, но обычно следует гистологическому прогрессированию от клеток, обнаруженных в здоровых легких, к явно дисморфным или неправильным клеткам. Есть несколько различных молекулярных и генетических путей, которые способствуют этому прогрессированию. Как и многие другие виды рака легких, аденокарцинома легкого к моменту постановки диагноза часто прогрессирует. После выявления поражения или опухоли с помощью различных методов визуализации, таких как компьютерная томография (КТ) или рентген , требуется биопсия для подтверждения диагноза.
Лечение этого рака легкого основано на конкретном подтипе и степени распространения от первичной опухоли. Хирургическая резекция, химиотерапия , лучевая терапия , таргетная терапия и иммунотерапия используются в попытке уничтожить раковые клетки на основе этих факторов. [3]
Признаки и симптомы [ править ]
Большинство пациентов, у которых диагностирован рак легких, обычно имеют местнораспространенное или метастатическое заболевание. Только около трети пациентов на момент постановки диагноза имеют болезнь I стадии . [4] Симптомы, которые проявляет пациент, обычно отражают степень распространения рака. Рак легких, обнаруженный на ранней стадии, может вызывать симптомы, локализованные в дыхательной системе. Однако прогрессирующий рак легких вызывает у пациентов дополнительные признаки и симптомы, вторичные по отношению к раку, распространяющемуся на другие системы органов. [5] В порядке наибольшей частоты наиболее частые признаки рака легких включают: [6]
- кашель, который не проходит или усиливается
- потеря веса
- одышка (одышка или затрудненное дыхание)
- боль в груди, которая может усиливаться при глубоком дыхании, кашле или смехе
- кровохарканье (кашель с кровью или мокротой цвета ржавчины) [7]
- боль в костях
- клуб
- жар
- общее чувство усталости или слабости
- Обструкция верхней полой вены - отек лица, шеи, верхней части туловища. Это вызвано сдавлением сосудов опухолью легкого, что ограничивает возврат крови из верхней части тела. [4]
- дисфагия (проблемы с глотанием или ощущение, что что-то застряло в горле) и охриплость
- новое начало свистящего дыхания без астмы в анамнезе
Клиницисты должны иметь высокий уровень подозрений на рак легких, особенно у пациентов с историей курения. Пациенты с рецидивирующими или неизлечимыми легочными инфекциями (например, бронхитом и пневмонией), которые не реагируют на антибиотики, также должны быть дополнительно обследованы на предмет рака легких. У некурящих женщин и выходцев из Восточной Азии чаще проявляются симптомы основного рака легких в более молодом возрасте. [5] Важно отметить, что многие из этих признаков обычно связаны с другими причинами, не относящимися к раку. [6] Подробная история болезни должна быть получена от каждого пациента, чтобы определить актуальность дальнейшего диагностического обследования и лечения. [ необходима цитата ]
Внелегочные проявления [ править ]
Аденокарцинома, как и другие формы рака легких, на момент постановки диагноза обычно прогрессирует или имеет метастазы. Пациенты могут жаловаться на признаки или симптомы за пределами дыхательных путей, которые представляют гематологическое или метаболическое осложнение злокачественного новообразования, но не обязательно в результате обструкции или метастазов. Они называются паранеопластическими синдромами , которые часто указывают на запущенное заболевание и худший прогноз [ необходима цитата ] . Ниже описаны наиболее распространенные паранеопластические синдромы, связанные с аденокарциномой легкого:
- Гиперкальциемия злокачественного образования чаще встречается при плоскоклеточном раке легкого, но может возникать и при аденокарциноме. Пептид, связанный с паратироидным гормоном (PTHrP), продуцируется опухолевыми клетками и действует аналогично паратироидному гормону (PTH). Производство этого гормонально активного пептида раковыми клетками вызывает усиление резорбции кости за счет активации остеокластов, одной из клеток, ответственных за ремоделирование кости. Когда кость разрушается, кальций попадает в кровоток, что приводит к гиперкальциемии. Признаки и симптомы повышенного содержания кальция в крови включают: жажду, усталость, запор, полиурию (учащенное мочеиспускание) и тошноту. Важно исключить метастазы в кости у пациентов с НМРЛ, поскольку они также имеют гиперкальциемию.
- Гипертрофическая легочная остеоартропатия (HPO) при аденокарциноме встречается довольно редко. Менее чем у 1% пациентов с аденокарциномой легкого это обнаруживается, но когда это действительно происходит, это плохой прогностический фактор. Точный механизм HPO неизвестен, но считается, что он имеет гормональную или нейрогенную этиологию. Триада HPO включает дистальную булаву, артрит и двустороннее симметричное периостальное образование. [4]
Причины [ править ]
Факторы риска [ править ]
Согласно исследованию здоровья медсестер , риск развития аденокарциномы легких существенно возрастает после длительного курения : курильщики, курящие в прошлом 30-40 лет, имеют более чем в два раза больше шансов заболеть аденокарциномой легких по сравнению с никогда не курившими ( относительный риск примерно 2,4); продолжительность более 40 лет увеличивает относительный риск до 5. [8]
Этот рак обычно наблюдается периферически в легких, в отличие от мелкоклеточного рака легкого и плоскоклеточного рака легкого, которые, как правило, располагаются более центрально [9] [10], хотя он также может возникать как центральные поражения. [10] По неизвестным причинам часто возникает в связи с периферическими рубцами легких. Текущая теория заключается в том, что шрам, вероятно, возник вторично по отношению к опухоли, а не вызвал опухоль. [10] Аденокарцинома чаще встречается у курильщиков и является наиболее распространенным типом рака легких, наблюдаемым у некурящих и женщин. [10]Более глубокое вдыхание сигаретного дыма приводит к периферическим поражениям, которые часто встречаются при аденокарциномах легких. Как правило, аденокарцинома растет медленнее и образует меньшие массы, чем другие подтипы. [10] Однако он имеет тенденцию к метастазированию на ранней стадии. [10]
Механизм [ править ]
Патогенез [ править ]
Крупномасштабные исследования, такие как Атлас генома рака (TCGA) , систематически охарактеризовали повторяющиеся соматические изменения, вероятно, способствующие инициации и развитию аденокарциномы легких. [11]
Генные мутации и изменения числа копий [ править ]
Поскольку курение является сильным мутагенным фактором, аденокарцинома легких является одним из типов опухолей с наибольшим количеством мутаций. [12] Общие соматические мутации в аденокарциноме легких затрагивают многие онкогены и гены-супрессоры опухолей , включая TP53 (мутировавший в 46% случаев), EGFR (27%), KRAS (32%), KEAP1 , STK11 и NF1 . [3] Мутации EGFR и KRAS имеют тенденцию проявляться взаимоисключающим образом. Мутации KRAS связаны с привычками к курению, тогда как мутации EGFR чаще встречаются у женщин, людей азиатской национальности и никогда не куривших. [2]
Сообщалось об амплификации числа копий в онкогенах, таких как TERT , MDM2 , EGFR, MET и MYC , а также о делециях генов-супрессоров опухолей, таких как CDKN2A . [11]
Частые изменения происходят в генах, принадлежащих к пути рецепторной тирозинкиназы , из которых EGFR является наиболее ярким примером. Этот путь участвует в пролиферации и выживании клеток и часто не регулируется при раке. Как следствие, были разработаны таргетные методы лечения для ингибирования компонентов мутантного пути. [11] [13]
Хромосомные перестройки [ править ]
Три мембранно-ассоциированных рецептора тирозинкиназы периодически участвуют в слиянии или перестройке в аденокарциномах : ALK , ROS1 и RET , и более восьмидесяти других транслокаций также были зарегистрированы в аденокарциномах легких. [14]
В реаранжировках ALK наиболее распространенным геном-партнером является EML4. [3] Слияния EML4-ALK, как правило, возникают в опухолях, которые не несут мутации EGFR или KRAS, а также имеют более низкую частоту мутаций TP53. Слияние ALK и ROS открывает возможности для таргетной терапии с ингибиторами тирозинкиназы [ необходима ссылка ] .
Патофизиология [ править ]
Дыхательные пути можно разделить на два основных компонента: проводящие дыхательные пути и газообменные дыхательные пути. Газообменные дыхательные пути состоят из альвеол или небольших микроскопических воздушных мешочков, которые отвечают за обмен кислорода и углекислого газа во время нормального дыхания. Альвеолы состоят из двух типов клеток: пневмоцитов I и II типа. Пневмоциты I типа покрывают 95% альвеолярных поверхностей и не способны к регенерации. Пневмоциты II типа встречаются чаще, они составляют 60% клеток альвеолярного эпителия, но составляют только 3% альвеолярной поверхности. [15]
Есть несколько факторов, которые способствуют превращению нормального альвеолярного эпителия в диспластические или предраковые поражения. Аденокарцинома легких развивается поэтапно, поскольку пневмоциты II типа претерпевают последовательные молекулярные изменения, которые нарушают нормальную регуляцию и обмен клеток. Атипичная аденоматозная гиперплазия (ААГ) считается предраковым поражением и, как полагают, в дальнейшем прогрессирует до аденокарциномы in situ и инвазивной аденокарциномы легкого. Поражения AAH имеют размер <5 мм, могут быть одиночными или множественными и имеют вид матового стекла на КТ. По мере накопления большего количества генетических мутаций и нарушения регуляции сигнальных путей нормальных клеток AAH может прогрессировать до аденокарциномы in situ (AIS). Поражения AIS классифицируются как небольшие опухоли <3 см с аномальным ростом пневмоцитов типа II, который ограничен альвеолярным пространством, то есть без инвазии в строму, плевру или сосудистую сеть. Этот тип роста называется «лепидным» и характерен для аденокарциномы легкого на самых ранних стадиях.[15]
Диагноз [ править ]
Диагноз рака легких можно заподозрить на основании типичных симптомов , особенно у человека, курившего в анамнезе. Такие симптомы, как кашель с кровью и непреднамеренная потеря веса, могут потребовать дальнейшего обследования, например, с помощью медицинской визуализации .
Классификация [ править ]
Большинство видов рака легких можно охарактеризовать как мелкоклеточный рак легкого (SCLC) или немелкоклеточный рак легкого (NSCLC). Аденокарцинома легкого является одним из трех основных подтипов НМРЛ, которые также включают плоскоклеточную карциному и крупноклеточную карциному . [15]
Исторически сложилось так, что было много споров по поводу наиболее точного метода описания аденокарциномы легкого, и было опубликовано несколько пересмотров систем классификации. Совсем недавно в 2011 году была опубликована Международная мультидисциплинарная классификация аденокарциномы легких, которая представляет собой консенсус нескольких организаций в отношении более точного описания этого конкретного типа рака легких. [2] Текущая система классификации направлена на более надежное прогнозирование прогноза и определение терапевтического лечения. [4]
При определении классификации учитываются размер опухоли, характер роста клеток и глубина инвазии клеток в нормальную ткань легкого. Следующие названия представляют собой поэтапное патологическое прогрессирование естественного течения аденокарциномы; Аденокарцинома in situ (AIS), минимально инвазивная аденокарцинома (MIA) и инвазивная аденокарцинома. [15] Инвазивная аденокарцинома легкого включает гетерогенную смесь подтипов и вариантов.
Консенсус 2011 года описывает пять подтипов инвазивных аденокарцином, основанных на преобладающем типе клеток. Эти подтипы описаны ниже:
- лепидный преобладающий
- преобладающий ацинар
- сосочковый преобладающий
- микропапиллярный преобладающий
- твердые с преобладанием муцина
Клеточные паттерны, определяющие подтипы, связаны с прогнозом от благоприятного (лепидный) до промежуточного (ацинарный и папиллярный) до плохого (микропапиллярный и солидный). [2]
Четыре дискретных варианта инвазивных аденокарцином, не относящихся к этим пяти подтипам, также включены в текущую классификацию:
- инвазивная муцинозная аденокарцинома
- коллоидная аденокарцинома
- аденокарцинома плода
- кишечная аденокарцинома [4]
Визуализация [ править ]
Рентген грудной клетки ( рентгенограмма ) часто является первым визуализирующим тестом, выполняемым, когда человек испытывает кашель или боль в груди, особенно в условиях первичной медицинской помощи. Рентгенограмма грудной клетки может выявить узелок / образование в легких, указывающих на рак, хотя чувствительность и специфичность ограничены. [ необходима цитата ]
КТ обеспечивает лучшую оценку легких, с более высокой чувствительностью и специфичностью для рака легких по сравнению с рентгенограммой грудной клетки (хотя по-прежнему значительный процент ложноположительных результатов [16] ). Компьютерная томография (КТ), которая специально предназначена для оценки рака легких, включает грудную клетку и верхнюю часть живота. Это позволяет оценить другие соответствующие анатомические структуры, такие как близлежащие лимфатические узлы, надпочечники, печень и кости, которые могут свидетельствовать о метастатическом распространении болезни. [4] Действительно, Целевая группа профилактических служб США рекомендует ежегодно проходить скрининг с применением КТ в низких дозах у взрослых в возрасте от 55 до 80 лет, которые курят 30 упаковок в год и в настоящее время курят или бросили курить в течение последних 15 лет, с некоторыми оговорками. (видетьСкрининг рака легких ). [17]
Визуализация в ядерной медицине, такая как ПЭТ / КТ и сканирование костей , также может быть полезна для диагностики и выявления метастазов в других частях тела. [7] ПЭТ / КТ использует метаболически активный индикатор, который позволяет врачам определять участки тела с гиперметаболизмом. Повышенное поглощение индикатора происходит в злокачественных клетках и в областях воспаления или инфекции. Интеграция визуализации, отражающей метаболическую активность, с обычной компьютерной томографией, обеспечивает более высокую чувствительность и специфичность по сравнению с одной ПЭТ . [4]
МРТ предназначена для пациентов с запущенным заболеванием, когда вероятно поражение внутричерепного или головного мозга. Это также полезно для оценки степени поражения грудной стенки, диафрагмы, плечевого сплетения (например, в случае опухолей верхней борозды ) или позвоночника. [4]
Гистопатология [ править ]
Если возможно, выполняется биопсия любой подозреваемой опухоли легкого, чтобы сделать микроскопическую оценку вовлеченных клеток и, в конечном итоге, требуется для подтверждения диагноза. [7] Для постановки гистологического диагноза и одновременного подтверждения стадии метастазов сначала следует попытаться провести биопсию в отдаленных очагах поражения. Материал биопсии также используется для анализа того, экспрессирует ли опухоль какие-либо специфические мутации, подходящие для тэджетной терапии (например, мутация EGFR или мутация ALK). Биопсия может быть выполнена с помощью бронхоскопии, трансторакальной игольной биопсии и тораскопической хирургии с видеосвязью (VATS). [4]
Хотя было показано, что цитология мокроты имеет ограниченную полезность, плевроцентез или аспирация плевральной жидкости с помощью иглы под ультразвуковым контролем следует выполнять при наличии плеврального выпота . Когда злокачественные клетки идентифицируются в плевральном аспирате пациентов с высоким подозрением на рак легкого, устанавливается окончательный диагноз и стадия (аденокарцинома легкого IV стадии). [4]
Аденокарцинома легкого имеет тенденцию давать положительное окрашивание на муцин, поскольку она происходит из продуцирующих слизь желез легких. Подобно другим аденокарциномам, если эта опухоль хорошо дифференцирована (низкой степени злокачественности), она будет напоминать нормальную железистую структуру. Плохо дифференцированная аденокарцинома не будет напоминать нормальные железы (высокой степени) и будет обнаружена по положительному окрашиванию на муцин (вырабатываемый железами). Аденокарциному также можно отличить по окрашиванию на TTF-1 , клеточный маркер аденокарциномы. [18]
Как обсуждалось ранее, категория аденокарциномы включает ряд подтипов, и любая опухоль имеет тенденцию быть гетерогенной по составу. Несколько основных подтипов в настоящее время признаны Всемирной организацией здравоохранения (ВОЗ) [1] и Международной ассоциацией по изучению рака легких (IASLC) / Американским торакальным обществом (ATS) / Европейским респираторным обществом (ERS): [19] [20 ] [21] аденокарцинома с преобладанием лепидных клеток, аденокарцинома с преобладанием ацинаров, аденокарцинома с преобладанием папиллярных клеток, аденокарцинома с преобладанием микропапиллярных клеток, аденокарцинома с преобладанием солидных и солидных аденокарциномов с преобладанием муцина.В 80% этих опухолей будут распознаваться компоненты более чем одного подтипа. Хирургически резецированные опухоли следует классифицировать по всестороннему гистологическому подтипу, описывающему паттерны поражения с шагом 5%. Затем преобладающий гистологический подтип используется для классификации опухоли в целом. [2] Преобладающий подтип является прогностическим для выживаемости после полной резекции. [22]
Чтобы выявить аденокарциноматозную линию солидного варианта, можно продемонстрировать внутриклеточную продукцию муцина. Очаги плоской метаплазии и дисплазии могут присутствовать в эпителии проксимальнее аденокарциномы, но они не являются предшественниками этой опухоли. Скорее, предшественник периферических аденокарцином был назван атипичной аденоматозной гиперплазией (ААГ). [10] Микроскопически AAH представляет собой хорошо разграниченный очаг пролиферации эпителия, содержащий клетки кубовидной или низко столбчатой формы, напоминающие клубные клетки или пневмоциты II типа . [10] Они демонстрируют различные степени цитологической атипии, включая гиперхромазию , плеоморфизм., выступающие ядрышки . [10] Однако атипия не в такой степени, как при явных аденокарциномах. [10] Поражения AAH являются моноклональными и имеют много общих молекулярных аберраций (например, мутаций KRAS ), которые связаны с аденокарциномами. [10]
Печатное кольцо и светлоклеточная аденокарцинома больше не являются гистологическими подтипами, а скорее являются цитологическими признаками, которые могут встречаться в опухолевых клетках нескольких гистологических подтипов, чаще всего солидной аденокарциноме. [19]
Лечение [ править ]
Лечение аденокарциномы легкого зависит от нескольких факторов, включая стадию , резектабельность, рабочий статус , гистологию и геномные изменения, приобретенные отдельной опухолью. [23] Как и в случае с большинством видов рака, подходы к лечению можно условно разделить на 5 категорий: хирургия, химиотерапия, лучевая терапия, таргетная терапия и иммунотерапия. [ необходима цитата ]
Хирургия [ править ]
Аденокарциномы легких на ранних стадиях (I, II и IIIA) обычно лечат хирургическим путем, чтобы удалить опухоль с помощью пневмонэктомии или лобэктомии , если при визуализирующих исследованиях и биопсии выясняется, что опухоль может быть резектабельна, и если пациент считается в состоянии перенести операцию. [10] Часто применяется видеоассистированная тораскопическая хирургия (VATS), которая заключается во введении тораскопа в небольшой разрез, сделанный в груди; через этот небольшой разрез можно удалить мочку через зрительную трубу. [23]
Химиотерапия [ править ]
Для запущенных (стадия IV) и неоперабельных опухолей легких терапией первой линии является дуплетная химиотерапия на основе платины, сочетающая цисплатин или карбоплатин с другим цитотоксическим агентом. [3] Режимы лечения сильно зависят от состояния здоровья и реакции каждого пациента, и когда риск нежелательных явлений может значительно ухудшить качество жизни, более рекомендуется базовая поддерживающая терапия. Химиотерапия также используется в качестве адъювантной терапии после хирургического вмешательства для уничтожения оставшихся раковых клеток у пациентов со стадиями IIA, IIB и IIIA NSCLC. [23]
Лучевая терапия [ править ]
Аденокарцинома - это немелкоклеточная карцинома легкого , и она не так чувствительна к лучевой терапии, как мелкоклеточная карцинома легкого . [10] Однако лучевая терапия может использоваться в качестве адъювантной терапии для пациентов, перенесших операцию резекции, чтобы снизить риск рецидива рака легких. Он также может принести пользу неоперабельным опухолям, локализованным в грудной клетке, и быть частью паллиативной помощи для улучшения качества жизни пациентов, не отвечающих на операцию или химиотерапию. [23]
Таргетная терапия [ править ]
Таргетная терапия доступна для аденокарцином легких с определенными молекулярными характеристиками. Ингибиторы тирозинкиназы (TKI) были разработаны для нацеливания на мутантные компоненты рецепторного тирозинкиназного пути, такие как EGFR, ALK [25] и ROS1, которые часто изменяются при аденокарциномах легких.
Было показано, что TKI EGFR первого поколения, включая гефитиниб и эрлотиниб , более эффективны при лечении пациентов с мутацией EGFR по сравнению с цитотоксической химиотерапией. Ингибиторы второго поколения, такие как афатиниб и дакомитиниб, обеспечивают более широкую область применения, поскольку они способны воздействовать не только на сам белок EGFR , но и на другие члены семейства EGFR , такие как HER2 и HER4 (также известные как ERBB2 и ERBB4). и они показали улучшенную выживаемость без прогрессированияпо сравнению с гефитинибом. Поскольку наиболее частой причиной приобретенной устойчивости к TKI первого поколения является вторая мутация EGFR в кодоне 790, TKI EGFR третьего поколения, осимертиниб , также был разработан для воздействия на эту новую мутацию. [3] Амплификация МЕТ - еще один известный механизм приобретенной устойчивости. [2]
Ингибиторы ALK, такие как кризотиниб, показали свою эффективность против опухолей, содержащих слияния ALK. Большинство пациентов, ранее получавших кризотиниб, получили пользу от ингибиторов ALK второго поколения, включая церитиниб , алектиниб и бригатиниб . Устойчивость к ингибиторам ALK может возникать при новых приобретенных мутациях или амплификациях ALK. [3]
Также ROS1-положительные опухоли показали высокую чувствительность к ингибиторам ALK из-за высокой гомологии между киназными доменами ROS1 и ALK. [3]
Иммунотерапия [ править ]
Иммунный ответ можно предотвратить путем активации иммунных контрольных точек , которые заключаются в связывании белка-лиганда (например, PD-L1 ) с рецептором (например, PD-1 ) на поверхности иммунных клеток. Как следствие, раковые клетки, экспрессирующие PD-L1, могут инактивировать Т-клетки, тем самым способствуя росту опухоли. Ингибиторы иммунных контрольных точек были разработаны для восстановления опосредованного Т-клетками противоопухолевого иммунитета путем блокирования лиганда или рецептора. [ необходима цитата ]
Иммунные ингибиторы контрольных точек были одобрены для НМРЛ, в том числе анти-PD-1 nivolumab и pembrolizumab . Агенты против PD-1 используются для пациентов с запущенным НМРЛ, опухоли которых прогрессируют после цитотоксической химиотерапии первой линии. Пембролизумаб был создан как новый стандарт лечения пациентов с запущенным или метастатическим НМРЛ с высокими уровнями экспрессии PD-L1, и ответы еще более выражены для опухолей с высокой мутационной нагрузкой (т.е. с повышенным числом мутаций). [3]
Терапевтические подходы, сочетающие несколько ингибиторов иммунных контрольных точек или одного ингибитора иммунных контрольных точек и цитотоксического агента, проходят клинические испытания по состоянию на 2018 год. [3] [26] Потенциальная роль анти-PD-1 агентов в качестве неоадъювантной терапии при операбельных НМРЛ также изучается. . [27]
Эпидемиология [ править ]
Что касается других подтипов рака легких, заболеваемость аденокарциномой легких тесно связана с курением.
Заболеваемость аденокарциномой легких увеличивалась во многих развитых западных странах за последние несколько десятилетий, с долей, достигающей 43,3% всех случаев рака легких в США по состоянию на 2012 г. [28], таким образом заменяя плоскоклеточный рак легкого как наиболее распространенный тип рака. рак легких. Это в значительной степени может быть связано с уменьшением количества курящих, что способствует гистологии аденокарциномы. Действительно, хотя курение по-прежнему является самым сильным фактором риска, аденокарцинома легких на сегодняшний день является наиболее распространенной среди некурящих на протяжении всей жизни (<100 сигарет за всю жизнь). [29]
Ссылки [ править ]
- ^ a b Трэвис У.Д., Брамбилла Э, Мюллер-Хермелинк HK, Харрис CC, ред. (2004). Патология и генетика опухолей легкого, плевры, тимуса и сердца (PDF) . Классификация опухолей Всемирной организации здравоохранения. Лион: IARC Press. ISBN 978-92-832-2418-1. Архивировано из оригинального (PDF) 23 августа 2009 года . Проверено 27 марта 2010 года .
- ^ Б с д е е Travis WD, Brambilla Е, М, Noguchi Nicholson AG, Geisinger КР, Yatabe Y, и др. (Февраль 2011 г.). «Международная ассоциация по изучению рака легких / Американское торакальное общество / Европейское респираторное общество, международная мультидисциплинарная классификация аденокарциномы легких» . Журнал торакальной онкологии . 6 (2): 244–85. DOI : 10.1097 / JTO.0b013e318206a221 . PMC 4513953 . PMID 21252716 .
- ^ a b c d e f g h я Бошофф, Крис; Моргенштерн, Даниэль; Хербст, Рой С. (24 января 2018 г.). «Биология и лечение немелкоклеточного рака легкого». Природа . 553 (7689): 446–454. Bibcode : 2018Natur.553..446H . DOI : 10.1038 / nature25183 . ISSN 1476-4687 . PMID 29364287 . S2CID 4463109 .
- ^ a b c d e f g h i j редактор., Grippi, Michael A. (2015-04-14). Легочные болезни и расстройства Фишмана . ISBN 9780071807289. OCLC 898053564 .CS1 maint: дополнительный текст: список авторов ( ссылка )
- ^ a b Хорн Л., Пао В., Джонсон Д.Х. (2012). «Глава 89». В: Longo DL, Kasper DL, Jameson JL, Fauci AS, Hauser SL, Loscalzo J (ред.). Принципы внутренней медицины Харрисона (18-е изд.). Макгроу-Хилл. ISBN 978-0-07-174889-6.
- ^ a b «Признаки и симптомы немелкоклеточного рака легких» . Cancer.org . Американское онкологическое общество. 16 мая 2016 года . Проверено 11 марта 2018 года .
- ^ a b c «Тесты на немелкоклеточный рак легкого» . Американское онкологическое общество. 23 июня 2017 года . Проверено 11 марта 2018 года .
- ^ Кенфилд С. А., Вэй Е. К., Стампферы MJ, Рознер Б.А., Колдицы Г.А. (июнь 2008). «Сравнение аспектов курения среди четырех гистологических типов рака легких» . Контроль над табаком . 17 (3): 198–204. DOI : 10.1136 / tc.2007.022582 . PMC 3044470 . PMID 18390646 .
- ^ Travis WD, Travis LB, Девеса SS (январь 1995). "Рак легких". Рак . 75 (1 приложение): 191–202. DOI : 10.1002 / 1097-0142 (19950101) 75: 1+ <191 :: АИД-CNCR2820751307> 3.0.CO; 2-Y . PMID 8000996 .
- ^ Б с д е е г ч я J K L M Mitchell RS, Кумар V, Аббас А.К., Фаусто N (2007). «Глава 13, вставка по морфологии аденокарциномы». Базовая патология Роббинса (8-е изд.). Филадельфия: Сондерс. ISBN 978-1-4160-2973-1.
- ^ a b c Исследовательская сеть Атласа генома рака (июль 2014 г.). «Комплексное молекулярное профилирование аденокарциномы легкого» . Природа . 511 (7511): 543–550. Bibcode : 2014Natur.511..543T . DOI : 10,1038 / природа13385 . ISSN 1476-4687 . PMC 4231481 . PMID 25079552 .
- ^ Мариамидзе, Армаз; Аредес, Наталия Д .; Ли, Чон Иль; Рубин, Марк А .; Вестервельт, Питер; Тайн, Брайан Ван; Лей, Тимоти; Хит, Шэрон; Говиндан, Рамасвами (28 марта 2018 г.). «Масштабируемый открытый научный подход к вызову мутаций экзомов опухоли с использованием нескольких геномных конвейеров» . Клеточные системы . 6 (3): 271–281.e7. DOI : 10.1016 / j.cels.2018.03.002 . ISSN 2405-4712 . PMC 6075717 . PMID 29596782 .
- ^ Ссылка, Genetics Home. «Рак легких» . Домашний справочник по генетике . Проверено 6 мая 2019 .
- ^ http://atlasgeneticsoncology.org/Tumors/TranslocLungAdenocarcID6751.html
- ^ а б в г Бруникарди. (2014). Принципы хирургии Шварца, 10e . Макгроу-Хилл. OCLC 941117341 .
- ^ Госснер J (апрель 2014). «Обследование на рак легких - не забудьте рентгенограмму грудной клетки» . Всемирный радиологический журнал . 6 (4): 116–8. DOI : 10,4329 / wjr.v6.i4.116 . PMC 4000607 . PMID 24778773 .
- ^ Целевая группа превентивных услуг США (декабрь 2016 г.). «Заключительная рекомендация: рак легкого: скрининг» . Проверено 10 марта 2018 .
- ^ Всемирный отчет о раке 2014 . Всемирная организация здоровья. 2014. С. Глава 5.1. ISBN 978-9283204299.
- ^ a b Van Schil PE, Asamura H, Rusch VW, Mitsudomi T, Tsuboi M, Brambilla E, Travis WD (февраль 2012 г.). «Хирургические последствия новой классификации аденокарциномы IASLC / ATS / ERS» . Европейский респираторный журнал . 39 (2): 478–86. DOI : 10.1183 / 09031936.00027511 . PMID 21828029 .
- ^ Трэвис В. Д., Брамбилла Э, Ван Шил П., Скаглиотти Г. В., Хубер Р. М., Скульер Дж. П., Ванстенкисте Дж., Николсон А.Г. (август 2011 г.). «Сдвиг парадигмы рака легких, как это определено в новой классификации аденокарциномы легких IASLC / ATS / ERS» . Европейский респираторный журнал . 38 (2): 239–43. DOI : 10.1183 / 09031936.00026711 . PMID 21804158 .
- ^ Васкес М, Картер Д, Брэмбилла Е, Gazdar А, Ногучи М, Трэвис WD, Хуан Y, Чжан L, R Ип, Yankelevitz DF, Хеншке ДИ (май 2009 г.). «Одиночные и множественные резецированные аденокарциномы после КТ-скрининга рака легких: гистопатологические особенности и их прогностическое значение» . Рак легких . 64 (2): 148–54. DOI : 10.1016 / j.lungcan.2008.08.009 . PMC 2849638 . PMID 18951650 .
- ^ Рассел PA, Wainer Z, Райт GM, Daniels M, Conron M, Williams RA (сентябрь 2011). «Предсказывает ли подтип аденокарциномы легких выживаемость пациента? Клинико-патологическое исследование, основанное на новой международной мультидисциплинарной классификации аденокарциномы легких Международной ассоциации по изучению рака легких / Американского торакального общества / Европейского респираторного общества». Журнал торакальной онкологии . 6 (9): 1496–504. DOI : 10.1097 / JTO.0b013e318221f701 . PMID 21642859 . S2CID 26574271 .
- ^ a b c d Заппа, Сесилия; Муса, Шейкер А. (23.06.2016). «Немелкоклеточный рак легкого: современное лечение и будущие достижения» . Трансляционные исследования рака легких . 5 (3): 288–300–300. DOI : 10.21037 / tlcr.2016.06.07 . ISSN 2226-4477 . PMC 4931124 . PMID 27413711 .
- ^ Курильщиками считаются нынешние или бывшие курильщики со стажем более 1 года. См. Страницу изображений в Commons, где указаны проценты в цифрах. Справка:
- Таблица 2 в: Kenfield SA, Wei EK, Stampfer MJ, Rosner BA, Colditz GA (июнь 2008 г.). «Сравнение аспектов курения среди четырех гистологических типов рака легких» . Контроль над табаком . 17 (3): 198–204. DOI : 10.1136 / tc.2007.022582 . PMC 3044470 . PMID 18390646 .
- ^ Арбор, Кэтрин С .; Рили, Грегори Дж. (Февраль 2017 г.). «Диагностика и лечение ALK-положительного НМРЛ» . Гематологические / онкологические клиники Северной Америки . 31 (1): 101–111. DOI : 10.1016 / j.hoc.2016.08.012 . ISSN 0889-8588 . PMC 5154547 . PMID 27912826 .
- ^ Хеллманн, Мэтью Д .; Чуляну, Тюдор-Элиаде; Плузански, Адам; Ли, Чон Сок; Оттерсон, Грегори А .; Одижье-Валетт, Кларисса; Миненса, Элиза; Линарду, Елена; Бургерс, Сяак (31.05.2018). «Ниволумаб плюс ипилимумаб при раке легких с высоким мутационным бременем опухоли» . Медицинский журнал Новой Англии . 378 (22): 2093–2104. DOI : 10.1056 / NEJMoa1801946 . ISSN 0028-4793 . PMC 7193684 . PMID 29658845 .
- ^ Форд, Патрик М .; Чафт, Джейми Э .; Смит, Келли Н .; Анагносту, Валсамо; Cottrell, Tricia R .; Hellmann, Matthew D .; Захурак, Марианна; Ян, Стивен С .; Джонс, Дэвид Р. (24 мая 2018 г.). «Неоадъювантная блокада PD-1 при резектабельном раке легкого» . Медицинский журнал Новой Англии . 378 (21): 1976–1986. DOI : 10.1056 / NEJMoa1716078 . ISSN 0028-4793 . PMC 6223617 . PMID 29658848 .
- ^ "Просмотрите таблицы и рисунки - Обзор статистики рака SEER (CSR) 1975-2012" . ВИДЯЩИЙ . Проверено 22 февраля 2019 .
- ^ Gandara, DR; Хаммерман, П.С.; Сос, МЛ; Лара, ПН; Хирш, Франция (2015-05-15). «Плоскоклеточный рак легкого: от геномики опухоли до лечения рака» . Клинические исследования рака . 21 (10): 2236–2243. DOI : 10.1158 / 1078-0432.CCR-14-3039 . ISSN 1078-0432 . PMC 4862209 . PMID 25979930 .