| STT3 | ||||||||
|---|---|---|---|---|---|---|---|---|
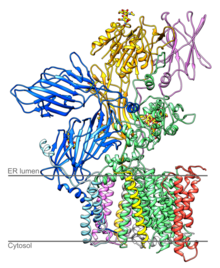 Состав дрожжевого ОСТ [1] | ||||||||
| Идентификаторы | ||||||||
| Символ | STT3 | |||||||
| Pfam | PF02516 | |||||||
| Клан пфам | CL0111 | |||||||
| ИнтерПро | IPR003674 | |||||||
| OPM суперсемейство | 242 | |||||||
| Белок OPM | 3rce | |||||||
| CAZy | GT66 | |||||||
| Мембранома | 275 | |||||||
| ||||||||
Олигосахарилтрансфераза или OST ( EC 2.4.1.119 ) представляет собой комплекс мембранных белков, который переносит 14- сахарный олигосахарид от долихола к формирующемуся белку . Это разновидность гликозилтрансферазы . Сахар Glc 3 Man 9 GlcNAc 2 (где Glc = глюкоза , Man = манноза и GlcNAc = N- ацетилглюкозамин ) присоединен к остатку аспарагина (Asn) в последовательности Asn-X- Ser или Asn-X- Thr. где X - любая аминокислота, кроме пролина . Эта последовательность называется секвоном гликозилирования . Реакция катализируется ОСТ является центральным шагом в N -связанной гликозилирования пути .
Местоположение [ править ]
OST является компонентом транслокона в мембране эндоплазматического ретикулума (ER) . Связанный с липидом сердцевинный олигосахарид собирается на мембране эндоплазматического ретикулума и переносится олигосахарилтрансферазным комплексом на выбранные остатки аспарагина формирующихся полипептидных цепей . [3] Активный сайт OST расположен примерно в 4 нм от просвета мембраны ER. [4]
Обычно он действует во время трансляции, когда формирующийся белок входит в ER, но это котрансляционное гликозилирование, тем не менее, называется посттрансляционной модификацией . Было обнаружено несколько примеров использования OST после завершения перевода. [5] [6] В настоящее время считается, что посттрансляционная активность может происходить, если белок плохо свернут или сворачивается медленно. [6]
Структура и функции [ править ]
OST дрожжей состоит из восьми различных мембранных белков в трех подкомплексах (один из них - OST4 ). [7] [8] Эти октомеры не образуют олигомеры более высокого порядка , и три из восьми белков сами гликозилируются. [7] ОЗТ у млекопитающих, как известно, имеет аналогичный состав. [9] [10]
Считается, что для OST требуется много подразделов, потому что он должен: [11]
- Расположитесь рядом с порой транслокона.
- Узнавать и связывать олигосахарилдолихол.
- Сканируйте зарождающийся белок, чтобы распознать и связать секвоны.
- Переместите эти два больших субстрата в их надлежащие места и формы.
- Активируйте атом азота амида Asn для фактического переноса олигосахарида.
- Освободите его подложки.
Каталитически активная субъединица OST называется STT3. У эукариот существуют два паралога, называемые STT3A и STT3B . STT3A в первую очередь отвечает за котрансляционное гликозилирование растущего полипептида, когда он проникает в просвет эндоплазматического ретикулума, тогда как STT3B может также опосредовать посттрансляционное гликозилирование. [12] Структура PglB , прокариотического гомолога STT3, была решена. [13] Высокое сходство последовательностей между прокариотическим и эукариотическим STT3 предполагает, что их структуры похожи.
Клиническое значение [ править ]
Синдромы CDG - это генетические нарушения пути гликозилирования. Они помечены как «Тип I», если дефектный ген относится к ферменту, участвующему в сборке или переносе предшественника Glc 3 Man 9 GlcNAc 2 -долихола. Их называют «Тип II», если дефектная стадия возникает после действия OST в пути N- связанного гликозилирования или включает O- связанное гликозилирование . [14]
См. Также [ править ]
- STT3A
- STT3B
Ссылки [ править ]
- ^ Дикий R, Kowal J, J Эйринг, Нгва Е.М., Aebi М, Лочер КП (2018). «Структура дрожжевого олигосахарилтрансферазного комплекса дает представление о N-гликозилировании эукариот» . Наука . 359 (6375): 545–550. Bibcode : 2018Sci ... 359..545W . DOI : 10.1126 / science.aar5140 . PMID 29301962 .
- ^ Пфеффер S, Дудек Дж, Gogala М, Шорра S, Linxweiler J, S Ланг, Беккер Т, Бекман R, R Циммерман, Фёрстера F (2014). «Структура комплекса олигосахарилтрансферазы млекопитающих в транслоконе нативного белка ER» . Nat. Commun . 5 (5): 3072. Bibcode : 2014NatCo ... 5.3072P . DOI : 10.1038 / ncomms4072 . PMID 24407213 .
- ^ Zufferey R, Knauer R, Burda P, Stagljar I, te Heesen S, Lehle L, Aebi M (октябрь 1995 г.). «STT3, высококонсервативный белок, необходимый для активности дрожжевой олигосахарилтрансферазы in vivo» . EMBO J . 14 (20): 4949–60. DOI : 10.1002 / j.1460-2075.1995.tb00178.x . PMC 394598 . PMID 7588624 .
- ^ Nilsson IM, фон Heijne G (март 1993). «Определение расстояния между активным центром олигосахарилтрансферазы и мембраной эндоплазматического ретикулума». J. Biol. Chem . 268 (8): 5798–801. PMID 8449946 .
- ^ Плесс Д.Д., Леннарц В.Дж.; Леннарц (январь 1977 г.). «Ферментативное превращение белков в гликопротеины» . Proc. Natl. Акад. Sci. США . 74 (1): 134–8. Bibcode : 1977PNAS ... 74..134P . DOI : 10.1073 / pnas.74.1.134 . PMC 393212 . PMID 264667 .
- ^ a b Duvet S, Op De Beeck A, Cocquerel L, Wychowski C, Cacan R, Dubuisson J (февраль 2002 г.). «Гликозилирование белка оболочки Е1 вируса гепатита С происходит посттрансляционно в мутантной клеточной линии СНО с дефицитом маннозилфосфорилдолихола» . Гликобиология . 12 (2): 95–101. DOI : 10.1093 / glycob / 12.2.95 . PMID 11886842 .
- ^ a b Knauer R, Lehle L (январь 1999 г.). «Комплекс олигосахарилтрансфераз из дрожжей». Биохим. Биофиз. Acta . 1426 (2): 259–73. DOI : 10.1016 / S0304-4165 (98) 00128-7 . PMID 9878773 .
- ^ Dempski RE, Imperiali B (декабрь 2002). «Олигосахарилтрансфераза: привратник секреторного пути». Curr Opin Chem Biol . 6 (6): 844–50. DOI : 10.1016 / S1367-5931 (02) 00390-3 . PMID 12470740 .
- ↑ Nilsson I, Kelleher DJ, Miao Y, Shao Y, Kreibich G, Gilmore R, von Heijne G, Johnson AE (май 2003 г.). «Фотоперекрестное связывание растущих цепей с субъединицей STT3 олигосахарилтрансферазного комплекса» . J. Cell Biol . 161 (4): 715–25. DOI : 10,1083 / jcb.200301043 . PMC 2199356 . PMID 12756234 .
- ^ Karaoglu D, Келлер DJ Гилмор R (октябрь 2001). «Аллостерическая регуляция обеспечивает молекулярный механизм для предпочтительного использования полностью собранного олигосахарида, связанного с долихолом, олигосахарилтрансферазой дрожжей». Биохимия . 40 (40): 12193–206. DOI : 10.1021 / bi0111911 . PMID 11580295 .
- ↑ Imperiali B (ноябрь 1997 г.). «Гликозилирование белков: Битва титанов». Счета химических исследований . 30 (11): 452–459. DOI : 10.1021 / ar950226k .
- Перейти ↑ Ruiz-Canada C, Kelleher DJ, Gilmore R (январь 2009 г.). «Котрансляционное и посттрансляционное N-гликозилирование полипептидов с помощью различных изоформ OST млекопитающих» . Cell . 136 (2): 272–83. DOI : 10.1016 / j.cell.2008.11.047 . PMC 2859625 . PMID 19167329 .
- ^ Лизак C, Gerber S, Numao S, M Aebi, Локэр КП (июнь 2011). «Рентгеноструктура бактериальной олигосахарилтрансферазы». Природа . 474 (7351): 350–5. DOI : 10,1038 / природа10151 . PMID 21677752 .
- ^ Марквардт T, Денеке J (июнь 2003). «Врожденные нарушения гликозилирования: обзор их молекулярных основ, клинических проявлений и специфических методов лечения». Евро. J. Pediatr . 162 (6): 359–79. DOI : 10.1007 / s00431-002-1136-0 . PMID 12756558 .
Внешние ссылки [ править ]
- олигосахарилтрансфераза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)