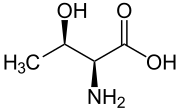
 Скелетная формула из L -threonine | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Треонин | |||
| Другие имена 2-амино-3-гидроксибутановая кислота | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.704 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| UNII |
| ||
CompTox Dashboard ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| C 4 H 9 N O 3 | |||
| Молярная масса | 119,120 г · моль -1 | ||
| (H2O, г / дл) 10,6 (30 °), 14,1 (52 °), 19,0 (61 °) | |||
| Кислотность (p K a ) | 2,63 (карбоксил), 10,43 (амино) [1] | ||
| Страница дополнительных данных | |||
| Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т. Д. | |||
Термодинамические данные | Фазовое поведение твердое тело – жидкость – газ | ||
Спектральные данные | УФ , ИК , ЯМР , МС | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Треонин (символ Thr или Т ) [2] представляет собой аминокислоту , которая используется в биосинтезе из белков . Он содержит α-аминогруппу (которая находится в протонированной -NH+
3Форма в биологических условиях), A карбоксильной группы (которая находится в депротонированной -COO - форма в биологических условиях) и боковая цепь , содержащая гидроксильную группу , что делает его полярные, незаряженные аминокислоты. Он необходим для человека, то есть организм не может его синтезировать: он должен быть получен с пищей. Треонин синтезируется из аспартата в таких бактериях, как кишечная палочка . [3] Он кодируется всеми кодонами, начинающими AC (ACU, ACC, ACA и ACG).
Боковые цепи треонина часто связаны водородными связями; наиболее часто образующиеся маленькие мотивы основаны на взаимодействиях с серином : ST-повороты , ST-мотивы (часто в начале альфа-спиралей) и ST-скобки (обычно в середине альфа-спиралей).
Модификации [ править ]
Остаток треонина подвержен многочисленным посттрансляционным модификациям . Гидроксильная боковая цепь может пройти O -связанное гликозилирование . Кроме того, треонина подвергаются фосфорилирования под действием треонина киназы . В фосфорилированной форме его можно назвать фосфотреонином . Фосфотреонин имеет три потенциальных координационных сайта (карбоксильная, аминная и фосфатная группа), и определение способа координации между фосфорилированными лигандами и ионами металлов, происходящих в организме, важно для объяснения функции фосфотреонина в биологических процессах. [4]
Это является предшественником из глицина , и может быть использовано в качестве пролекарства , чтобы надежно поднять уровни мозга глицина.
История [ править ]
Треонин был последней из 20 открытых протеиногенных аминокислот. Он был обнаружен в 1936 году Уильям Камминг Роуз , [5] сотрудничает с Кертисом Мейера. Аминокислота была названа треонином, потому что она была подобна по структуре треоновой кислоте , четырехуглеродному моносахариду с молекулярной формулой C 4 H 8 O 5 [6]
| |
| L- треонин (2 S , 3 R ) и D- треонин (2 R , 3 S ) |
| |
| L- аллотреонин (2 S , 3 S ) и D- аллотреонин (2 R , 3 R ) |
Треонин - одна из двух протеиногенных аминокислот с двумя хиральными центрами, второй - изолейцин . Треонин может существовать в виде четырех возможных стереоизомеров со следующими конфигурациями: (2 S , 3 R ), (2 R , 3 S ), (2 S , 3 S ) и (2 R , 3 R ). Однако название L- треонин используется для обозначения одного диастереомера , (2 S , 3 R ) -2-амино-3-гидроксибутановой кислоты. Второй стереоизомер (2 S , 3 S), который редко встречается в природе, называется L- аллотреонином. [7] Два стереоизомера (2 R , 3 S ) - и (2 R , 3 R ) -2-амино-3-гидроксибутановая кислота не имеют большого значения. [ необходима цитата ]
Биосинтез [ править ]
Как незаменимая аминокислота, треонин не синтезируется в организме человека и должен присутствовать в белках с пищей. Взрослым людям требуется около 20 мг / кг массы тела в день. [8] В растениях и микроорганизмах треонин синтезируется из аспарагиновой кислоты через α-аспартил-полуальдегид и гомосерин . Гомосерин подвергается О- фосфорилированию; этот эфир фосфорной кислоты подвергается гидролизу одновременно с перемещением группы ОН. [9] Ферменты, участвующие в типичном биосинтезе треонина, включают:
- аспартокиназа
- β-аспартат-полуальдегиддегидрогеназа
- гомосериндегидрогеназа
- гомосеринкиназа
- треонинсинтаза .
Метаболизм [ править ]
Треонин метаболизируется по крайней мере тремя способами:
- У многих животных он превращается в пируват через треониндегидрогеназу . Промежуточный продукт в этом пути может подвергаться тиолизу с помощью КоА с образованием ацетил-КоА и глицина .
- У человека ген треонин дегидрогеназы является неактивным псевдогеном , [10] , так треонин преобразуется в альфа-ketobutyrate . Механизм первой стадии аналогичен механизму, катализируемому сериндегидратазой , и реакции серин- и треониндегидратазы, вероятно, катализируются одним и тем же ферментом. [11]
- Во многих организмах это О-фосфорилируется с помощью киназы подготовки к дальнейшему метаболизму. Это особенно важно для бактерий в процессе биосинтеза кобаламина ( витамина B12 ), поскольку продукт превращается в (R) -1-аминопропан-2-ол для включения в боковую цепь витамина. [12]
Источники [ править ]
Продукты с высоким содержанием треонина включают творог , птицу , рыбу , мясо , чечевицу , черную черепаху [13] и семена кунжута . [14]
Рацемический треонин можно получить из кротоновой кислоты путем альфа-функционализации с использованием ацетата ртути (II) . [15]
Ссылки [ править ]
- ^ Доусон, RMC и др., Данные для биохимических исследований , Оксфорд, Clarendon Press, 1959.
- ^ «Номенклатура и символика аминокислот и пептидов» . Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано 9 октября 2008 года . Проверено 5 марта 2018 .
- ^ Раис, Бадр; Шассаньоль, Кристоф; Леттелье, Тьерри; Упал, Дэвид; Мазат, Жан-Пьер (2001). «Синтез треонина из аспартата в бесклеточных экстрактах Escherichia coli: динамика пути» . J Biochem . 356 (Pt 2): 425–32. DOI : 10.1042 / bj3560425 . PMC 1221853 . PMID 11368769 .
- ^ Jastrzab, Рената (2013). «Исследования новых комплексов фосфотреонина, образующихся в бинарных и тройных системах, включая биогенные амины и медь (II)». Журнал координационной химии. 66 (1): 98-113. DOI: 10.1080 / 00958972.2012.746678
- ^ Словарь ученых . Дейнтит, Джон., Гьертсен, Дерек. Оксфорд: Издательство Оксфордского университета. 1999. с. 459. ISBN. 9780192800862. OCLC 44963215 .CS1 maint: другие ( ссылка )
- ^ Мейер, Кертис (20 июля 1936 г.). «Пространственная конфигурация альфа-амино-бета-гидрокси-н-масляной кислоты» (PDF) . Журнал биологической химии . 115 (3): 721–729. DOI : 10.1016 / S0021-9258 (18) 74711-X .
- ^ «Номенклатура и символика аминокислот и пептидов (Рекомендации 1983 г.)». Чистая и прикладная химия . 56 (5): 601, 603, 608. 1 января 1984 г. doi : 10.1351 / pac198456050595 .
- ^ Институт медицины (2002). «Белок и аминокислоты» . Нормы потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот с пищей . Вашингтон, округ Колумбия: The National Academies Press. С. 589–768.
- ^ Lehninger, Альберт L .; Нельсон, Дэвид Л .; Кокс, Майкл М. (2000). Принципы биохимии (3-е изд.). Нью-Йорк: У. Х. Фриман. ISBN 1-57259-153-6..
- ^ Stipanuk, Martha H .; Кодилл, Мари А. (13 августа 2013 г.). Биохимические, физиологические и молекулярные аспекты питания человека - электронная книга . Elsevier Health Sciences. ISBN 9780323266956.
- ^ Бхардвадж, Ума; Бхардвадж, Равиндра. Биохимия для медсестер . Pearson Education India. ISBN 9788131795286.
- ^ Фанг, H; Канг, Дж; Чжан, Д. (30 января 2017 г.). «Микробное производство витамина B 12 : обзор и перспективы на будущее» . Фабрики микробных клеток . 16 (1): 15. DOI : 10,1186 / s12934-017-0631-у . PMC 5282855 . PMID 28137297 .
- ^ «Ошибка» . ndb.nal.usda.gov .
- ^ «Данные о питании SELF - Факты о питании, информация и калькулятор калорий» . Nutritiondata.self.com . Проверено 27 марта 2018 года .
- ^ Картер, Герберт Э .; Уэст, Гарольд Д. (1940). «дл-треонин» . Органический синтез . 20 : 101.; Сборник , 3 , с. 813.
Внешние ссылки [ править ]
- Биосинтез треонина
- CID 205
- CID 6288