 | |
| Имена | |
|---|---|
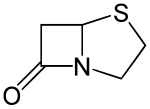
| Название ИЮПАК (5R) -4-тиа-1-азабицикло [3.2.0] гептан-7-он | |
| Другие имена 1-Аза-7-оксо-4-тиабицикло [3.2.0] гептан | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| C 5 H 7 N O S | |
| Молярная масса | 129,18 г · моль -1 |
| Родственные соединения | |
Родственные соединения | Clavam |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |

Пенамы - это первичные скелетные структуры, которые определяют подкласс пенициллина из более широкого семейства бета-лактамных антибиотиков и родственных соединений. Они представляют собой бициклические кольцевые системы, содержащие фрагмент β-лактама, слитый с пятичленным тиазолидиновым кольцом. [1] Из-за напряжения кольца и ограничений амидного резонанса структура нестабильна и очень чувствительна к каталитическому расщеплению по амидной связи. [2] Бензилпенициллин (пенициллин G) является исходным натуральным продуктом, который содержит структуру пенама.
Структура и связь [ править ]
Пенамы не имеют гибких структур из-за их состава из жестких маленьких колец. Четырехчленное кольцо и пятичленное кольцо не компланарны. Вместо этого структура заблокирована в сморщенной (т. Е. Изогнутой) форме из-за пирамидальной геометрии азота плацдарма. Пирамидализация (χ = 54 °) и скручивание связи CN (τ = 18 °) вызваны деформацией исключения неподеленной пары из планарности с циклическими кольцами и эффектами электростатического отталкивания. В результате искаженная связь CN вызывает несовпадение орбиталей карбонильного углерода и неподеленной пары азота, что допускает резонансное перекрытие. Длина амидной связи CN составляет 1,406 Å и имеет более выраженный характер одинарной связи, чем в нециклических третичных амидах. Длина связи CO составляет 1,205 Å, который короче связей CO в нециклических третичных амидах. [3]
Свойства [ править ]
Стабильность [ править ]
Общая термодинамическая стабильность Penam основана на суммировании эффектов дестабилизации кольцевой деформации (RSE) и эффектов стабилизации амидного резонанса (ARE). Поскольку эффекты дестабилизации намного перевешивают эффекты стабилизации, пенамы термодинамически нестабильны и реагируют на нуклеофильные реакции, которые способствуют расщеплению β-лактамного кольца. [4]
Эффект кольцевой деформации [ править ]
Пенамы в первую очередь дестабилизируются из-за больших углов и деформаций кручения, которые связаны с четырехчленным β-лактамным кольцом, внутренние валентные углы которого составляют 90º. [5] Основываясь на схожих энергиях деформации, наблюдаемых в пенамах и автономных β-лактамных кольцах, конденсированное пятичленное кольцо, вероятно, не вносит вклад в общий эффект деформации, в отличие от его шестичленного кольцевого аналога в цефамах, которое помогает снизить кольцевую деформацию. [4] В результате реакции раскрытия кольца, например гидролиз, являются термодинамически благоприятными для снятия напряжения кольца. [5]
Эффект резонанса амида [ править ]
Пенамы стабилизируются за счет амидных резонансных эффектов. В отличие от традиционных третичных амидов, которые делокализируют неподеленную пару азота на кислород карбонильной группы и приводят к образованию двойной связи у связи CN, амидный резонанс в пенаме в основном возникает между азотом и карбонильным углеродом, что частично положительно из-за индуктивного эффекта карбонильной группы. кислород. Это результат перекрывающихся взаимодействий между неподеленной парой ВЗМО на азоте и НСМО углерода. Однако из-за пирамидализации азота и искаженной связи CN степень стабилизации амидного резонанса снижается по сравнению с планарными амидами, такими как β-лактамный фрагмент, которые имеют выровненные орбитали для перекрытия. [6] [3]
Реакции [ править ]
Пенамы реактивны по отношению к каталитическому расщеплению посредством гидролиза из-за склонности карбонильного углерода к нуклеофильной атаке. [5] Это объясняется его частичным положительным (электрофильным) характером, который возникает из-за того, что электронная плотность немного поглощается карбонильным атомом кислорода и, следовательно, отсутствием сопряжения между азотом и карбонильной группой. Хотя амидные связи обычно не реагируют на расщепление из-за своего характера частичной двойной связи, пирамидализация и искажение связи CN делают амидную связь в пенамах характером одинарной связи, которая более реактивна к расщеплению. [4] [6] [3] Кроме того, разрыв связи CN является термодинамически выгодным, поскольку раскрытие β-лактамного кольца снижает напряжение кольца. [5]
Катализированное расщепление [ править ]
Раскрытие цикла пенамов может быть гидролизом, катализируемым кислотой или основанием . [4] [6] В кислых условиях вода действует как нуклеофил, который атакует электрофильный углерод карбонильной группы. В основных условиях гидроксид действует как нуклеофил. В ферментах гидроксильная группа остатка серина действует как нуклеофил. [5] Независимо от того, какие нуклеофильные частицы атакуют электрофильный углерод карбонильной группы, нуклеофил связывается, образуя третичный углеродный промежуточный продукт. Электроны переносятся с связи CN на атом азота, который действует как уходящая группа. В результате связь CN разрывается, образуя карбоновую кислоту и вторичный амин. [5]
Ссылки [ править ]
- ↑ Новак, Игорь; Чуа, Пей Хуан (01.09.2006). «Вычислительное исследование фармакофоров: β-лактамы». Журнал физической химии . 110 (35): 10521–10524. Bibcode : 2006JPCA..11010521N . DOI : 10.1021 / jp063162b . ISSN 1089-5639 . PMID 16942059 .
- ^ Патрик Грэхэм (2017-03-23) "5. Фармацевтические препараты и медицинской химии", Органическая химия: Очень краткое введение , Oxford University Press, стр 71-89,. Дои : 10,1093 / АкТрейд / 9780198759775.003.0005 , ISBN 978-0-19-875977-5
- ^ a b c Гловер, Стивен А .; Россер, Адам А. (14.06.2012). «Надежное определение амидности ациклических амидов и лактамов». Журнал органической химии . 77 (13): 5492–5502. DOI : 10.1021 / jo300347k . ISSN 0022-3263 . PMID 22646836 .
- ^ а б в г Новак Игорь; Чуа, Пей Хуан (01.09.2006). «Вычислительное исследование фармакофоров: β-лактамы». Журнал физической химии . 110 (35): 10521–10524. Bibcode : 2006JPCA..11010521N . DOI : 10.1021 / jp063162b . ISSN 1089-5639 . PMID 16942059 .
- ^ a b c d e f Патрик, Грэм (2017-03-23), «5. Фармацевтические препараты и медицинская химия», Органическая химия: очень краткое введение , Oxford University Press, стр. 71–89, doi : 10.1093 / actrade /9780198759775.003.0005 , ISBN 978-0-19-875977-5
- ^ a b c Ху, Фэн; Лаланцет, Роджер; Шостак, Михал (2016-03-08). «Структурная характеристика N-алкилированных скрученных амидов: последствия для резонанса амидной связи и N-C-расщепления». Angewandte Chemie International Edition . 55 (16): 5062–5066. DOI : 10.1002 / anie.201600919 . ISSN 1433-7851 . PMID 26953809 .